头颈4D-CTA 结合SDF-1a/CXCR4 信号通路评估颅内后交通动脉瘤破裂风险的价值
徐艺铭,钟剑锋,李 斌,周欣颜,朱红丽,梁 靖,廖承德
(昆明市延安医院放射科,云南 昆明 650051)
颅内动脉瘤(intracranial aneurysm,IA)是临床中致死率与伤残率极高的脑血管疾病,发病率约2%~5%。IA 破裂后12%的患者在到达医院前死亡,1 个月内超过50%的死亡率,剩余超过30%的患者将进一步出现迟发性神经功能缺失,患者预后极差[1],动脉瘤的发生发展涉及遗传、血流动力学、环境以及生活习惯等多种因素,但其确切的病理生理机制尚未阐明,后交通动脉一般借大脑后动脉与动眼神经分开而不与其接触,当血管分叉处动脉瘤突然增大便可压迫动眼神经,导致动眼神经麻痹等严重的后果;另一方面,随着体检的普及和成像技术的发展,颅内未破裂的后交通动脉瘤的检出率明显增高,这些动脉瘤将会如何发展?破裂的风险有多少?对患者及家属至关重要。4D-CTA 成像是一种无创血管造影技术,可实现图像的实时处理和定量分析,在脑卒中等脑血管疾病的诊断中已经取得了良好的效果[2]。同时,血清学检查也已广泛应用于临床,基质细胞衍生因子-1(SDF-1a)属于 CXCR 趋化因子家族,是一种炎性趋化因子,来源于骨髓间充质干细胞,SDF-1a 能与趋化因子受体4(CXCR4)特异性结合,形成SDF-1a/CXCR4 生物轴,参与血管生成和炎症反应等生物学过程[3]。Shi 等[4]发现预后良好的急性缺血性脑卒中患者的 SDF-1a 水平低于预后不良者,提示 SDF-1a 水平与患者病情严重程度及预后不良呈正相关。然而,SDF-1 a 在颅内动脉瘤破裂诊断中少有报道,在动脉瘤发生发展的研究中,SDF-1a/CXCR4 信号通路通过影响血管壁的炎症反应及平滑肌功能,从而在后交通动脉瘤的发生、发展和破裂中起到了关键作用,逐渐成为了新的研究焦点,并且少有影像学结合基础方面共同研究颅内动脉瘤,本研究利用 4DCTA 结合SDF-1 a 在评估颅内后交通动脉瘤破裂风险方面的价值。
1 资料与方法
1.1 一般资料
将 2022 年 2 月至 2023 年 2 月期间接受治疗的 50 例未破裂颅内后交通动脉瘤患者和 50 例破裂颅内后交通动脉瘤患者分为未破裂组 1 和破裂组 1。在破裂 1 组中,男性24 例,女性26 例,年龄 51~73 岁,平均年龄(62.30±3.44)岁。2 组的总体数据均衡,具有可比性(P>0.05)。未破裂组男性 29 例,女性 21 例,年龄 49~71 岁,平 均(61.05±3.57)岁。破裂组男 24 例,女 26 例,年龄 50~74 岁,平均(62.30±3.47)岁。2 组间一般资料平衡良好,具有可比性(P>0.05)。
1.2 纳入和排除标准
纳入标准[5]:(1)通过脑血管造影术确诊为颅内动脉瘤的患者;(2)首次确诊的患者;(3)有明确病变动脉的患者;(4)患者及其家属签署知情同意书的患者。
排除标准:(1)合并感染者;(2)因外伤继发颅内动脉瘤者;(3)并发其他脑血管畸形者;(4)对造影剂过敏者;(5)并发恶性肿瘤者。2 组数据同时适用于纳入标准和排除标准。本研究通过昆明市医学委员会批准(2023-223-01)。
1.3 4D-CTA
使用日本佳能320 层 CT 扫描仪进行扫描,扫描范围覆盖整个大脑,管电压为 120 kV,电流为 300 mA;扫描总时间为 14.30 s,扫描管旋转一圈的时间为 0.75 s。向肘前静脉注射碘佛醇(300 mg 碘/mL,30 mL)和 30 mL 生理盐水,然后进行动态扫描。
1.4 图像后处理
将所获得的原始图像及减影图像传送至Start Vitrea 工作站,重建层厚0.5 mm、层间距0.4 mm,从多角度、多方位观察。(1)动脉瘤的瘤颈是指动脉瘤与载瘤动脉相交的两点间连线,瘤高是指动脉瘤底部最高处与动脉瘤颈部中点的连线,瘤颈比(AR)=瘤高/瘤颈(图1);(2)动脉瘤的大小:寻找动脉瘤的最大宽度与瘤高2 个数值中的最大者;动脉瘤的最大宽度定义为垂直于瘤高的、连接动脉瘤两侧壁的最大段长度;动脉瘤的瘤高与载瘤动脉直径比(SR)=瘤高/载瘤动脉平均直径(图1)。(3)VOR=Volume(动脉瘤体积)/ Ostium Area(动脉瘤底面积),见图1。
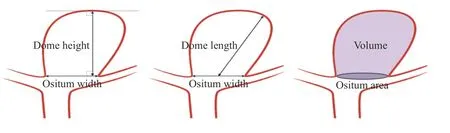
图1 AR、SR 及 VOR 测量简图Fig.1 AR,SR,and VOR measurement diagrams
破裂组右侧大脑中动脉瘤。0%~100% 代表4D-CTA 中的10 个期相,在这 10 幅动态图中,10%、60%、90%连续3 个期限可见动脉瘤瘤底出现搏动点,见图2。
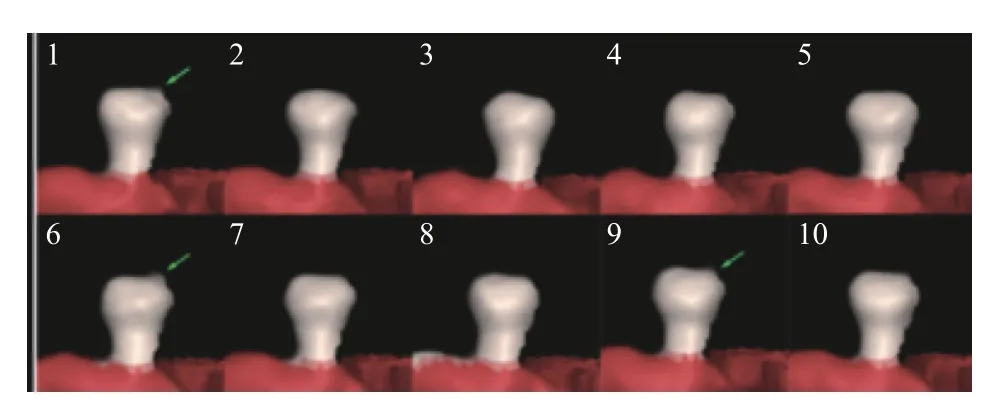
图2 4D-CTA 搏动点示意图Fig.2 Schematic diagram of 4D-CTA pulsatile points
图像都在多个层面上进行旋转重建,整个动脉瘤显示在同一位置,以减少测量误差;多层旋转重建后动脉瘤边界的自动追踪显示了动脉口面积和动脉瘤体积并在下图自动显示,见图3。

图3 AR、SR 及 VOR 数值 测量图示并动脉瘤基底部见异常搏动点(黄箭头所示)Fig.3 Diagram of 4D measurement of AR,SR,and VOR values(shown by yellow arrow)
4D-CTA 成像经过图像渲染后可以更接近DSA图像,见到经过动脉瘤侧壁喷射出血液,见图4。
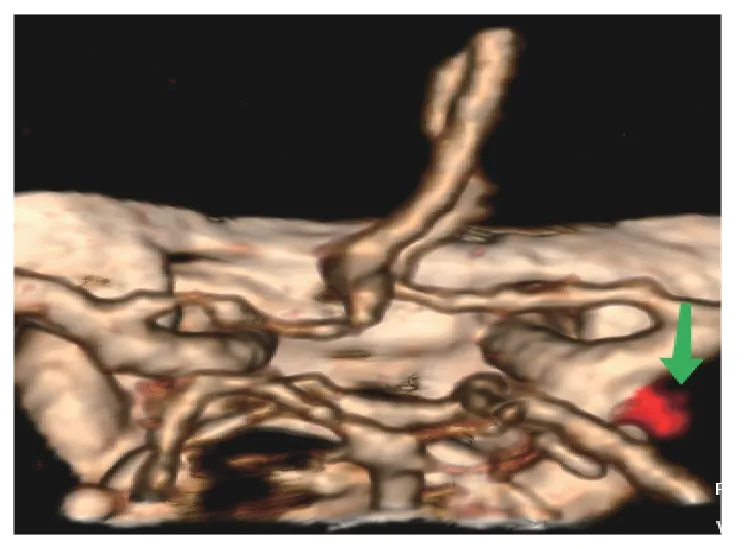
图4 4D-CTA 成像 后交通动脉异常搏动点(绿箭头)Fig.4 Abnormal pulse points of Traffic artery after 4DCTA(green arrow)
1.5 检测 SDF-1 水平
抽取每位患者的外周肘静脉血(5 mL)并离心。然后采集血清,使用酶联免疫吸附试验(西门子)检测SDF-1a 水平。
1.6 分组方法
未破裂组 1 的患者接受保守治疗,并随访 12个月以后观察动脉瘤破裂情况。在此基础上,动脉瘤破裂的患者被纳入破裂组2,动脉瘤未破裂的患者被纳入未破裂组2。
1.7 观察指标
(1)4D-CTA 成像特征:记录肿瘤颈宽(Wn)、肿瘤体高(H)、肿瘤长径/母动脉平均直径(AR)、肿瘤长径(L)、母动脉平均直径(DA)、H/DA(SR)和 H/Wn;(2)SDF-1:记录并比较 SDF-1 水平。
1.8 统计学处理
统计分析采用 SPSS24.0 软件,绘制接收者操作特征曲线(ROC)并计算曲线下面积(AUC),据此检验 4D-CTA 结合SDF-1 对颅内动脉瘤破裂的诊断和预测价值。P<0.05 为差异有统计学意义。
2 结果
2.1 破裂组1 和非破裂组1 影像数据结合SDF-1 水平联合诊断
破裂组1 和非破裂组1 SDF-1 结合颅内后交通动脉瘤Wn、AR、L、SR)和血清SDF-1 组合联合诊断,破裂1 组SDF-1 水平[(149.48±13.22)µg/L 高于非破裂1 组[(135.03±11.01)µg/L(t=5.90,P<0.001),差异有统计学意义,见表1。4D-CTA 测量Wn、AR、L、SR)和血清SDF-1 水平为检验变量,绘制ROC 曲线。Wn、AR、L、SR、SDF-1 及其联合诊断颅内后交通动脉瘤破裂的AUC 均>0.70,联合诊断有价值(表2、图5)。
表1 破裂组1 和非破裂组1 SDF-1 对比[µg/L,()]Tab.1 Comparison of SDF-1 between unruptured group 1 and ruptured group 1 [µg/L,()]
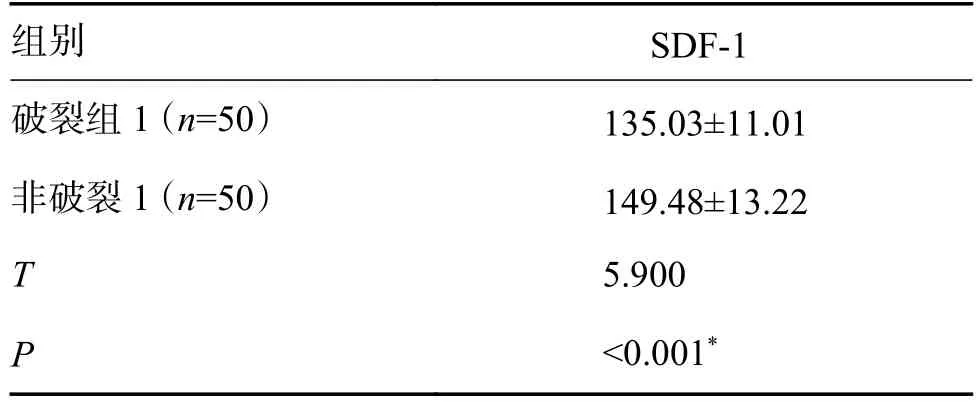
表1 破裂组1 和非破裂组1 SDF-1 对比[µg/L,()]Tab.1 Comparison of SDF-1 between unruptured group 1 and ruptured group 1 [µg/L,()]
*P<0.05。
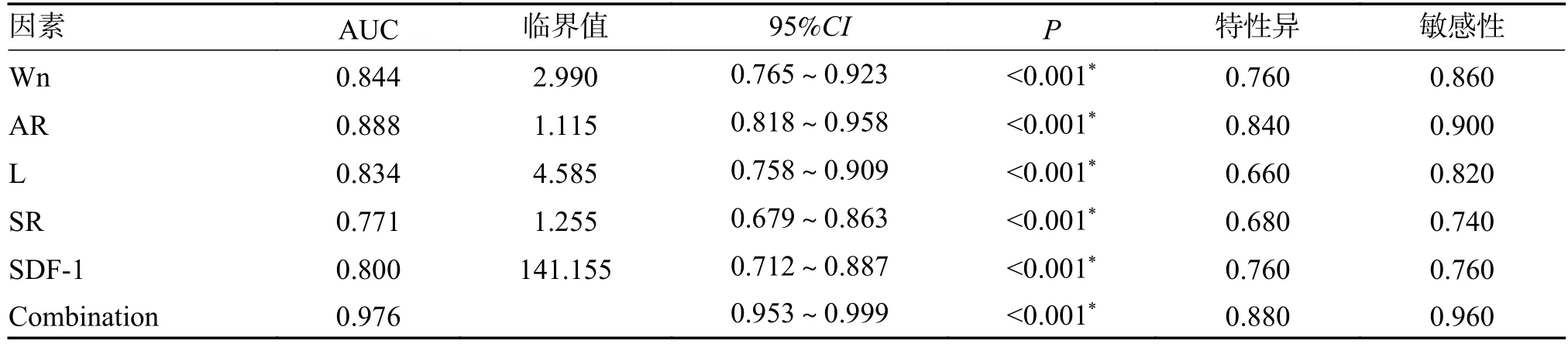
表2 4D-CTA 联合SDF-1 对颅内后交通动脉瘤破裂的诊断价值Tab.2 Diagnostic value of 4D-CTA combined with SDF-1 in the rupture of intracranial posterior communicating aneurysms.

图5 4D-CTA 联合SDF-1 对颅内后交通动脉瘤破裂的诊断价值Fig.5 Diagnostic value of 4D-CTA combined with SDF-1 in the rupture of intracranial posterior communicating aneurysms
2.2 破裂组2 和非破裂组2 SDF-1 水平和以及颅内动脉瘤Wn、AR、L、SR)和血清SDF-1水联合诊断
破裂组2 的 SDF-1 水平[(142.38±11.22)µg/L]高于非破裂组 2 [(128.13±10.22)µg/L](t=4.660,P<0.001),差异有统计学意义,见表3。4D-CTA 测量Wn、AR、L、SR 及入院时血清SDF-1 水平为检验变量,绘制 ROC 曲线,结果发现,Wn、AR、L、SR 和SDF-1 在颅内后交通动脉瘤破裂诊断中的 AUC 均大于 0.70,提示其组合值具有预测价值(表4、图6)。
表3 破裂组2 和非破裂组2 SDF-1 对比[µg/L,()]Tab.3 Comparison of SDF-1 between unruptured group 2 and ruptured group 2 [µg/L,()]

表3 破裂组2 和非破裂组2 SDF-1 对比[µg/L,()]Tab.3 Comparison of SDF-1 between unruptured group 2 and ruptured group 2 [µg/L,()]
*P<0.05。
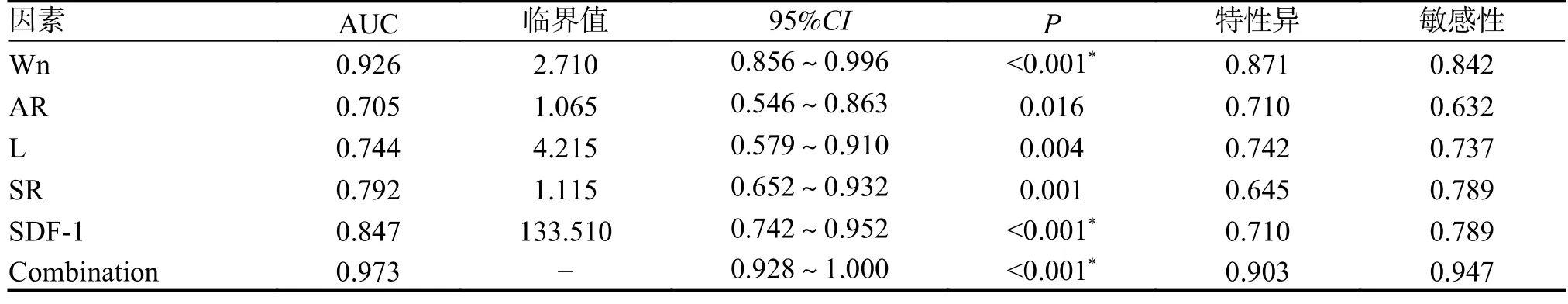
表4 联合SDF-1 对颅内后交通动脉瘤破裂的预测价值Tab.4 Predictive value of combined SDF-1 for rupture of intracranial posterior communicating aneurysms

图6 4D-CTA 联合SDF-1 对颅内后交通动脉瘤破裂的预测价值Fig.6 Predictive value of 4D-CTA combined with SDF-1 for ruptured intracranial aneurysms
3 讨论
颅内动脉瘤是常见的脑血管疾病,后交通动脉瘤破裂具有发病急、病情重的特点,是导致蛛网膜下腔出血的主要原因[6-7]。未破裂的后交通动脉瘤可通过动脉瘤栓塞等多种方式进行治疗消除动脉瘤破裂的风险[8],但破裂动脉瘤与未破裂动脉瘤的治疗方案和预后不同,因此及时有效地诊断颅内动脉瘤是否有破裂倾向对临床治疗具有重要意义。血管造影是诊断颅内动脉瘤的 "金标准";然而,由于血管造影术具有创伤大且存在血管内膜损伤等并发症的风险,其临床应用受到一定限制;同时由于DSA 常用观察角度会遗漏病灶,无法像4D-CTA 脑动脉瘤形态学分析软件可以自由旋转并全方位观察;4D-CTA 是一种无创血管造影技术并在3D-CTA 的基础上增加了时间维度,比DSA 扫描速度快可以减低患者辐射量,同时可实现对心动周期不同阶段血管壁形态变化的实时观察[9],可以更客观的观察到动脉瘤的大小、形态、血供等动态信息,为诊断提供数据支持[10]。目前,临床上对颅内动脉瘤的病因和发病机制仍不清楚,但一般认为与炎症反应密切相关。De Paepe M E 等[11]报道,颅内动脉瘤的形态特征与动脉瘤壁的炎症反应密切相关。Jiang 等[12]也认为后动脉瘤破裂患者动脉瘤壁的补体激活程度高于未破裂的后交通动脉瘤患者,这表明炎症与颅内后交通动脉瘤的变性和破裂有关,同时SDF-1是一种趋化因子,是激活炎症级联和血管生成的重要角色。Newberry J 等[13]研究发现,SDF-1 可促进营养血管生成和炎症细胞的迁移与增殖,与颅内后交通动脉瘤的发生和发展密切相关。本研究中,破裂组1 和非破裂组1 SDF-1 水平和以及颅内动脉瘤Wn、AR、L、SR 和血清SDF-1 组合联合诊断,破裂1 组SDF-1 水平(149.48±13.22)µg/L 高于非破裂1 组(135.03±11.01)µg/L(t=5.90,P<0.001),差异有统计学意义;破裂组2和非破裂组2 SDF-1 水平和以及颅内动脉瘤Wn、AR、L、SR 和血清SDF-1 水平联合诊断,破裂组2 的 SDF-1 水平(142.38±11.22)µg/L 高于非破裂组 2(128.13±10.22)µg/L(t=4.660,P<0.001),差异有统计学意义,提示具有一定的预测价值。原因如下:(1)SDF-1 可改变动脉瘤壁的性质,促进后交通动脉瘤周围的炎症反应,诱导炎性细胞(内皮细胞和巨噬细胞)通过血管进入动脉瘤壁,从而导致动脉瘤破裂;(2)炎症细胞可通过后交通动脉瘤的血管浸润,动脉瘤外的基质在炎症细胞分泌的蛋白酶作用下发生变形,从而使动脉瘤更加脆弱,导致结构失去完整性,最终引起后交通动脉瘤破裂[14]。此外,SDF-1 可与 CXCR4 结合形成 SDF-1/CXCR4 生物轴,在炎症细胞的募集中发挥重要作用,有利于细胞在病变部位的聚集,从而加重颅内动脉瘤的炎症反应,导致动脉瘤破裂[15]。此外,在诊断和预测颅内动脉瘤破裂方面,4D-CTA 结合 SDF-1 的 AUC 分别为 0.976 和0.973,大于任何单一参数。
综上所述,建立包含SDF-1a/CXCR4 信号通路信息在内的“颅内后交通动脉瘤破裂风险预测模型”,有助于提供准确的颅内后交通动脉瘤破裂预警,最终为探索动脉瘤的发生机制、破裂风险预测和治疗开创新方法。本研究由于样本量不足,日后将会加大样本量进一步研究影响后交通动脉瘤破裂的风险因素,并延长随访时间进一步确认结论。为患者提供合适的治疗方案。

