金樱子多糖、车前子多糖和冬葵果多糖体内外抗炎效果比较
彭松,卢炫圻,林芳竹,毛宁宁,于亚明,于琳,施宗傲,王德云*
(1. 南京农业大学动物医学院,江苏 南京 210095;2. 南京中兽医药研究中心,江苏 南京 210018)
炎症是一种适应性反应,由有害刺激和条件触发,如果急性炎症无法调节,则会导致慢性炎症、自身免疫和过度组织损伤。在一些疾病的临床治疗过程中,往往需要通过抗炎类药物来阻止炎症所带来的损伤[1]。中药抗炎在近年来已成为一个重要的研究领域,针对一些炎症疾病,传统中药制剂在临床治疗以及试验研究中均表现出了良好的抗炎功效[2]。多糖作为大多数中药的主要成分,由重复单糖残基通过糖苷键聚合而成,具有丰富的生物活性,其中多糖抗炎活性研究引起越来越多人的关注[3]。
金樱子(RosalaevigataMichx)多糖是从蔷薇科蔷薇属金樱子的干燥果实中提取的一种酸性杂多糖,具有抗氧化、降血脂、抗肿瘤和抑菌抗炎等作用[4];冬葵果(FructusMalvaepolysaccharide)多糖从锦葵科植物冬葵的干燥成熟果实中提取,含有中性多糖、酸性多糖、肽聚糖和低聚糖,具有清除自由基和抑制脂质过氧化的作用[5];车前子(PlantaginisSemenGrowth)多糖是从车前子中提取的一种酸性杂多糖,具有整肠通便、调节血糖、降低血脂、抗氧化、抗炎及防治动脉粥样硬化的作用[6]。因此,本试验以细胞炎症模型和小鼠肠道炎症模型为研究对象,探讨金樱子多糖、车前子多糖和冬葵果多糖的抗炎作用,筛选出抗炎效果最好的多糖,以期为多糖类抗炎剂的研发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验药物
5-氨基水杨酸购于上海毕得医药科技股份有限公司;金樱子、车前子、冬葵果药材购于南京大华中药店。
1.1.2 细胞系和实验动物
RAW264.7细胞购于上海纪宁生物科技有限公司。8周龄ICR小鼠购自扬州大学比较医学中心,在试验前适应性饲养7 d。所有动物相关试验均严格按照试验动物福利伦理的要求及南京农业大学IACUC实验动物护理和使用指南进行。
1.1.3 主要试剂
脂多糖(LPS,美国Sigma公司);DMEM培养基、胎牛血清、青霉素-链霉素双抗(美国Gibco公司);小鼠肿瘤坏死因子(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素10(IL-10)、白细胞介素6(IL-6)ELISA试剂盒(杭州联科生物技术有限公司);RNA反转录试剂盒(南京诺唯赞生物有限公司);葡聚糖硫酸钠(DSS,分子量36~50 kDa,美国MP公司);磷酸盐缓冲液(PBS,南京奥青生物技术有限公司);10× PBS 缓冲液(北京索莱宝科技有限公司);D-无水葡萄糖(分析纯,中国药品生物制品检定所);其余试剂均为分析纯。
1.1.4 试验仪器
旋转蒸发仪SY-5000(上海亚荣生化仪器厂);冷冻干燥机(宁波新芝生物科技股份有限公司);离心机(美国Thermo公司);Multiskan FC酶标仪(赛默飞世尔上海仪器有限公司)
1.2 多糖的提取及含量测定
金樱子多糖的提取:将干燥的去核金樱子果肉粉末按质量比1∶5加入95%的乙醇,80 ℃冷凝回流脱除脂质,烘干,加入质量20倍的蒸馏水,95 ℃提取2.5 h,重复3次,收集滤液浓缩,按体积比1∶4与100%乙醇混合,静置过夜后4 000g离心10 min,收集沉淀,Sevage法除蛋白(氯仿∶正丁醇=4∶1)重复10 次。把沉淀加蒸馏水重新溶解后,透析,冻干,获得金樱子多糖。
冬葵果多糖的提取:将冬葵果粉末,按药材∶石油醚=1∶3(体积比),60 ℃水浴加热,回流脱脂;过滤,按滤渣∶乙醇=1∶3(体积比),80 ℃水浴加热,回流除醇溶物;过滤,按滤渣∶水=1∶9(体积比),80 ℃提取2 h,提取3 次,合并滤液,浓缩至原来体积的1/4。在滤液中加入一定量无水乙醇至最终醇浓度为80%,进行醇沉,收集沉淀,挥发有机溶剂,蒸馏水溶解,按Sevage试剂∶多糖溶液=1∶3(体积比),除蛋白,重复10 次,离心取水相,透析,冻干,得到冬葵果多糖。
车前子多糖的提取:将干燥的车前子用80%乙醇浸泡24 h,滤渣乙醇。干燥后,加入10倍体积蒸馏水,沸水浴回流提取3 h,重复3 次,离心,合并滤液,浓缩至滤液体积的1/5。浓缩液中加入无水乙醇,使乙醇终浓度达80%,4 ℃醇沉过夜,收集沉淀,依次用无水乙醇、丙酮、乙醚各洗2次,蒸馏水溶解,Sevage法除蛋白,重复10 次,透析,醇沉,冻干,得精制车前子多糖。
所有多糖均采用硫酸-苯酚法测定多糖含量,以葡萄糖为基准物质,校正系数为0.999 7。测得金樱子多糖含量为78.9%,车前子多糖含量为68.1%,冬葵果多糖含量为77.4%。
1.3 RAW264.7细胞存活率的测定
取处于对数生长期的RAW264.7细胞,接种到96孔板中,每孔100 μL,细胞密度约为5×105个/mL,在37 ℃和5%的CO2条件下培养12 h。在处理组中加入不同浓度的多糖溶液(31.25、62.5、125、250、500、1 000、2 000、4 000 μg/mL),培养24 h,加入MTT溶液(5 mg/mL),培养4 h,在490 nm处测量吸光度。细胞存活率=药物组OD值/空白组OD值×100%。
1.4 细胞上清液中NO、IL-6、TNF-α、IL-1β含量的测定
取处于对数生长期的RAW264.7细胞,接种到24孔板中,每孔1 mL,细胞密度约为5×105个/mL,在培养箱中培养过夜。加入不同浓度的多糖溶液(500、250、125 μg/mL),2 h后,加入LPS(1 μg/mL)培养24 h。收集细胞上清液,用Griess方法测量上清液中的NO含量。根据ELISA试剂盒说明书,测定细胞上清液中IL-6、TNF-α、IL-1β的含量。
1.5 细胞因子mRNA表达量的测定
同1.3方法处理细胞后,根据试剂盒说明书提取总RNA,逆转录成cDNA,在NCBI数据库中检索相关基因序列,使用Primer 6.0设计引物(引物由北京擎科生物技术有限公司合成),基因引物如表1。配置10 μL体系,包括2×ChamQ SYBR qPCR Master Mix 5 μL、前引物0.4 μL、后引物0.4 μL、50×ROX Reference Dye2为0.4 μL、cDNA模板1 μL,无菌双蒸水7.8 μL。反应程序为:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,4 ℃终止反应。以β-actin为内参基因,采用2-ΔΔCt计算基因表达的相对量。
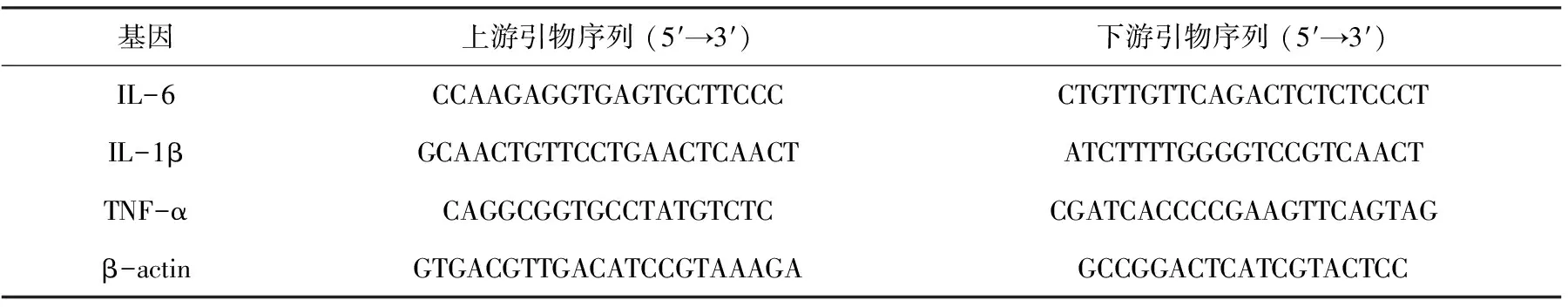
表1 相关基因引物
1.6 动物模型构建及分组
ICR小鼠适应性饲养1周后,平均分为6组,每组6只,分别为空白对照组,模型组(葡聚糖硫酸钠,DSS),阳性药组(5-氨基水杨酸),金樱子多糖组,车前子多糖组和冬葵果多糖组。试验期间除空白对照组给予蒸馏水外,其余各试验组均给予5% (重量/体积),DSS饮水,连续饮用7 d。同时各治疗组每天分别灌服5-氨基水杨酸(200 mg/kg)或某种多糖(200 mg/kg),空白组与模型组灌服等量生理盐水,持续7 d。
1.7 疾病活动指数(DAI)评分和结肠长度测定
参考文献[7]进行DAI评分。评分标准包括:体重减轻评分,粪便成型程度和粪便隐血程度。具体来说,体重无明显减轻计为0分;减轻1%~5%计为1分;减轻5%~10%时计为2分;减轻10%~15%则计为3分;减轻15%以上计为4分。粪便呈正常颗粒状计为0分;当粪便稍松软时计为1分;粪便呈中度松软时计为2分;当粪便不成形时计3分;呈水样粪便时则计为4分。通过粪便潜血试验检测,当粪便潜血试验为阴性时计0分;粪便检测弱阳性时计1分;当粪便呈隐血阳性时计2分;粪便隐血试验检测结果呈强阳性时计3分;若肉眼可见小鼠明显血便则计4分。三者相加即为DAI评分。
末次给药后,禁食不禁水24 h,麻醉小鼠后采集全段结直肠,测量结直肠长度。
1.8 结肠病理组织学观察
采集小鼠结肠组织置于4%多聚甲醛固定,用石蜡包埋并切片,HE染色,显微镜下观察并拍照。组织病理学评分则通过评价炎症、黏膜损伤和腺体损伤程度进行评分,三者评分之和进行计算。具体评分细则如下:炎症程度不明显计为0分;轻度计为1分;中度计为2分;重度计为3分。黏膜损伤程度不明显计为0分;损伤在黏膜层计为1分;损伤到达黏膜下层计为2分;损伤到达肌层和浆膜层计为3分。腺体损伤程度不明显计为0分;少量腺体扩张计为1分;多灶性腺体扩张计为2分;部分腺体消失计为3分。
1.9 结肠组织中炎性细胞因子的检测
称取结肠组织,加入5倍体积PBS(含1% PMSF),充分研磨,离心,收集上清液,-20 ℃保存。根据ELISA试剂盒说明书,测定结肠组织中IL-6、TNF-α、IL-1β、IL-10的浓度。
1.10 数据统计与分析
试验数据用Excel初步整理计算,用SPASS 18.0进行分析,设定P<0.05为有显著性差异,P<0.01为有极显著性差异,用GraphPad Prism 9.0软件作图,结果均以“平均数±标准差”表示。
2 结果与分析
2.1 多糖对RAW264.7细胞存活率的影响
如图1所示,当3种多糖浓度≤1 mg/mL时,各组细胞存活率与空白组无显著性差异(P>0.05),安全性好。可以看出在500 μg/mL时均有增殖趋势,故3种多糖均选择浓度为500、250和125 μg/mL进行后续细胞试验。

注:与空白组相比,***表示P<0.001;ns表示差异不显著(P>0.05)。
2.2 多糖对LPS诱导的RAW264.7细胞上清液中炎性介质含量的影响
如图2所示,与空白组相比,LPS组NO、IL-6、TNF-α和IL-1β含量极显著增高(P<0.001);与LPS组相比,金樱子多糖组在浓度为500 μg/mL时,可极显著降低NO、IL-6、TNF-α和IL-1β的含量(P<0.01),250 μg/mL时可显著降低NO、IL-6、TNF-α和IL-1β的含量(P<0.05);车前子多糖组在浓度为500 μg/mL时,可显著降低NO、IL-6、TNF-α和IL-1β的含量(P<0.05);冬葵果多糖不同剂量组有降低趋势,但与LPS组相比无显著性差异(P>0.05)。

注:与LPS组相比,*表示P<0.05,**表示P<0.01,***表示P<0.001。下同。
2.3 多糖对LPS诱导的RAW264.7细胞分泌细胞因子mRNA含量的影响
如图3所示,与空白组相比,LPS组显著提高了炎性细胞因子IL-1β、IL-6及TNF-α的 mRNA的表达量(P<0.001)。与LPS组相比,3种多糖都不同程度地抑制了促炎细胞因子的表达。金樱子多糖组在浓度为500 μg/mL时,能够极显著抑制促炎细胞因子IL-6、TNF-α、IL-1β的mRNA表达量(P<0.001),在浓度为250 μg/mL时,能够极显著抑制促炎细胞因子IL-6、TNF-α、IL-1β的mRNA表达量(P<0.01);车前子多糖组在浓度为500 μg/mL时,能够显著抑制促炎细胞因子IL-6、TNF-α的mRNA的表达量(P<0.05);冬葵果多糖不同剂量组有抑制促炎细胞因子mRNA表达的趋势,但与LPS组相比均无显著性差异(P>0.05)。
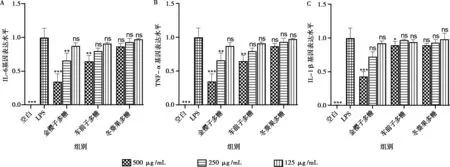
图3 多糖对细胞因子IL-6(A)、TNF-α(B)和IL-1β(C)基因mRNA表达水平的影响
2.4 多糖对DSS诱导的溃疡性结肠炎小鼠DAI评分和结肠长度的影响
试验期间通过检测小鼠体重变化、粪便性状、便血情况对各组小鼠进行疾病活动指数评分。结果表明,从造模第4天开始,除空白组外,其余试验组小鼠体重下降、便血,至第7 天,DSS组仍有明显便血,而使用5-氨基水杨酸和3种多糖治疗后,便血情况有不同程度的缓解,以此进行DAI评分。如图4 A所示,与空白组小鼠相比,DSS组小鼠DAI评分在试验期间升高。与DSS组相比,金樱子多糖组和阳性药组的DAI评分显著下降(P<0.05),而车前子多糖组和冬葵果多糖组呈下降趋势,但无显著性差异(P>0.05)。如图4B所示,与空白组相比,DSS组小鼠的结肠长度显著缩短(P<0.001),而金樱子多糖和阳性药治疗后可极显著缓解DSS引起的结肠长度缩短(P<0.01),车前子多糖可显著缓解DSS引起的结肠长度缩短(P<0.05),冬葵果多糖有缓解趋势,但无显著性差异(P>0.05)。
注:与DSS组相比,*表示P<0.05,**表示P<0.01,***表示P<0.001。下同。
2.5 多糖对DSS诱导的溃疡性结肠炎小鼠结肠病理组织学评分的影响
如图5所示,与空白组小鼠相比,DSS组小鼠结肠黏膜上皮破损严重,腺体排列不规则甚至消失,炎性细胞浸润和隐窝大量缺失,组织病理学评分显著升高。与DSS组相比,多糖组和阳性药组的小鼠结肠组织整体结构较正常,黏膜下层水肿和炎性细胞浸润减少,肠黏膜和腺体更清晰。如图6所示,与DSS组相比,金樱子多糖组和阳性药组的结肠病理组织学评分极显著降低(P<0.001),车前子多糖组的结肠病理组织学评分显著降低(P<0.05),而冬葵果多糖组的结肠病理组织学评分有降低趋势,但无显著性差异(P>0.05)。

A. 空白组;B. 模型组;C. 阳性药组;D. 金樱子多糖组;E. 车前子多糖组;F. 冬葵果多糖组;黑色箭头代表炎性细胞浸润,红色箭头代表隐窝。

图6 小鼠结肠组织病理学评分
2.6 多糖对DSS诱导的溃疡性结肠炎小鼠结肠细胞因子分泌的影响
如图7所示,与空白组相比,DSS组小鼠结肠组织中IL-6、TNF-α及IL-1β的含量极显著升高(P<0.001),IL-10显著降低(P<0.05)。与DSS组小鼠相比,金樱子多糖组和阳性药组IL-6、TNF-α、IL-1β及IL-10含量均表现出极显著差异(P<0.001);车前子多糖组的IL-6和IL-10含量表现出极显著性差异(P<0.01),TNF-α和IL-1β含量表现出显著性差异(P<0.05)。冬葵果多糖组的细胞因子含量与DSS组相比表现出差异,但差异不显著性(P>0.05)。

图7 多糖对溃疡性结肠炎小鼠结肠组织细胞因子分泌的影响
3 讨论
炎症是一种复杂的免疫反应,可保护器官免受感染和组织损伤。受控的炎症反应对宿主有益,可清除宿主组织中免疫刺激并恢复正常生理功能。然而,细胞因子IL-6、TNF-α和IL-1β的上调可诱导血管内皮细胞外的黏附因子表达,导致中性粒细胞、单核细胞和淋巴细胞募集,然后从血管中移出到损伤组织,促进炎症的发生[8]。IL-10可以阻止活化的巨噬细胞释放炎症介质,从而缓解炎症[9]。
多糖是许多植物的主要成分之一,已被证实具有免疫增强、抗炎、抗肿瘤和神经保护活性。金樱子多糖是从中药金樱子(性平,味酸、甘、涩,归肾经、膀胱经、大肠经)中提取,由阿拉伯糖(26.5%)、鼠李糖(7.6%)、木糖(3.5%)、甘露糖(0.9%)、半乳糖(31.9%)、葡萄糖(5.7%)和半乳糖醛酸(23.9%)组成[10];冬葵果多糖是从蒙药冬葵果(性凉,味甘、涩,归大肠经、小肠经、膀胱经)中提取,主要由阿拉伯糖(18.75%)、半乳糖(37.5%)和葡萄糖(43.75%)组成[11];车前子多糖是从中药车前子(性寒,味甘,归肾经、肝经、肺经、小肠经)中提取,主要由木糖(56.7%)、阿拉伯糖(21.6%)、半乳糖(3%)、葡萄糖和半乳糖醛酸(18.4%)等组成的酸性杂多糖[12]。研究表明[13],植物多糖可以用作天然抗炎药,其通过对趋化因子、黏附因子表达和相关酶活性的抑制,调节细胞因子的生成,从而影响白细胞向炎症部位的募集、黏附以及渗出,达到抗炎效果。
本研究的体外试验通过MTT法确定3种多糖的安全浓度范围(≤1 mg/mL),并选择细胞最佳生长浓度,在LPS诱导的RAW264.7细胞炎症模型中进行体外抗炎作用的探讨。结果表明,LPS可显著提高NO、IL-6、TNF-α和IL-1β的含量以及促炎细胞因子mRNA的表达,说明体外炎症模型成功。同时,在多糖浓度为500 μg/mL,金樱子多糖对炎性介质表达的抑制作用强于车前子多糖和冬葵果多糖;在多糖浓度为250 μg/mL时,只有金樱子多糖有显著抑制炎性介质表达,提示金樱子多糖的体外抗炎效果优于车前子多糖和冬葵果多糖。体内试验基于中药的归经,选择DSS诱导的溃疡性结肠炎模型探讨3种多糖的体内抗炎作用,结果表明,以相同浓度的3种多糖干预小鼠溃疡性结肠炎模型后,相较于车前子多糖和冬葵果多糖,金樱子多糖可明显提高结肠长度,IL-10含量,降低DAI评分,促炎细胞因子(IL-6、IL-1β、TNF-α)含量,保护结肠组织完整性。提示金樱子多糖有最佳的抑制炎症发生的效果,改善结肠炎状况。据报道[14],糖醛酸的含量对多糖的抗炎活性有很大的影响,高糖醛酸含量的多糖具有更强的抗炎活性。金樱子多糖中的糖醛酸含量占比高于车前子多糖和冬葵果多糖,推测金樱子多糖的抗炎活性强于车前子多糖和冬葵果多糖可能与其高糖醛酸含量有关,此论点需进一步试验验证。
综上所述,本研究提取了3种植物多糖,借助体内、体外炎症模型初步探讨并对比了其抗炎作用。结果表明,金樱子多糖能通过下调体内外模型炎性介质的水平发挥较好的抗炎作用,为多糖类抗炎剂的研发和防治溃疡性结肠炎的发生提供了试验依据。

