猪繁殖与呼吸综合征病毒2型TaqMan MGB探针荧光定量PCR方法的建立
徐之恒,孙少辉,董友富,唐伟明,徐孝宙,邢军,李豪,孙刘妹,万进,王聪*,张振东*
(1. 扬州大学医学院(转化医学研究院),江苏 扬州 215001;2. 中牧实业股份有限公司,北京 100070;3. 江苏科技大学生物技术学院,江苏 镇江 212018;4. 江苏农林职业技术学院,江苏 句容 212400)
猪繁殖与呼吸综合征(PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种以母猪的繁殖障碍、生长猪的呼吸道疾病以及感染猪的继发感染为主要临床表现的重要疫病,给我国生猪产业带来了巨大的经济损失[1-2]。PRRSV分为PRRSV1(欧洲型)与PRRSV2(美洲型)两个种,我国主要以PRRSV2的流行为主[3]。根据ORF5基因序列,PRRSV2共分为9个谱系,我国主要流行4个谱系(谱系1、3、5、8)[4]。2006年我国暴发高致病性PRRSV(HP-PRRSV),其nsp2基因存在30个氨基酸的缺失(1+29)[5];2013年类NADC30毒株传入我国,其nsp2基因存在131个氨基酸的缺失(111+1+19)[6];2017年开始,类NADC34毒株在我国多个省份被检出,其nsp2基因的缺失特征为连续的100个氨基酸[7]。近年来,疫苗演化毒株、谱系1的类NADC30/NADC34毒株及不同谱系之间的重组毒株频繁检出[8-9],使得PRRSV田间流行毒株呈现出明显的多样性和复杂性,严重困扰着我国猪场的生产发展,尤其在生物安全防控较差的猪场,PRRS时有暴发流行。为做好PRRS的预警、防控及净化工作,临床生产中往往通过对新生仔猪睾丸处理液、家猪口水液、临断奶弱仔猪血液等样本的检测,及时了解猪群PRRSV的感染状态,进而适时采取不同的控制措施。因此,建立一种特异性强、灵敏度高、操作简单的检测方法对PRRS的筛查、诊断、防控及净化工作意义重大[10]。本研究根据国内PRRSV2不同谱系流行毒株的情况,选取ORF6基因保守区域设计合成了1对引物和1条MGB探针,建立了一种通用型的TaqMan MGB荧光定量PCR(RT-qPCR)检测方法,以期为临床上PRRS的快速诊断及科学防控提供技术支撑。
1 材料与方法
1.1 病毒核酸与临床样品
猪瘟病毒(CSFV)、PRRSV(欧洲型与美洲型)、猪伪狂犬病毒(PRV)、猪圆环病毒2型(PCV2)、猪圆环病毒3型(PCV3)、猪细小病毒(PPV)和猪流行性腹泻病毒(PEDV)的核酸样本均由本实验室保存;30份PRRSV阳性病料(RT-PCR初检阳性)来自江苏省不同地区规模化猪场。
1.2 主要试剂
Bio Flux Simply P病毒 DNA/RNA提取试剂盒购自杭州博日科技股份有限公司;PrimeScript RT reagent Kit购自宝生物工程(大连)有限公司;2×EsTaqMasterMix(Dye)反应酶购自江苏康为世纪生物科技股份有限公司;DL2000 Plus DNA Marker、FastPure Plasmid Mini Kit及AceQ®qPCR Probe Master Mix均购自南京诺唯赞生物科技股份有限公司;pMD19-T 载体购自宝生物工程(大连)有限公司。
1.3 主要仪器
PCR扩增仪,购自美国 Applied Biosystems 公司;CFX96 Touch实时荧光定量PCR仪,购自美国Bio-Rad公司;琼脂糖凝胶电泳仪,购自北京六一仪器厂;凝胶成像分析系统,购自南京麦高德生物科技有限公司。
1.4 引物与探针的设计合成
选取PRRSV2不同谱系常见参考毒株ORF6基因的保守区域,设计并合成荧光定量PCR方法的上下游引物及探针序列。PRRSV2-F:5′-TTGCTAGGCCGCAAGTACAT-3′;PRRSV2-R:5′-GGACGACAAATGCGTGGTTA-3′;PRRSV2-P:5′ FAM-TCTGGCCCCTGCCCA-MGB-3′。引物和探针由浙江尚亚生物技术有限公司合成。
1.5 标准阳性质粒的制备
以PRRSV2阳性样品的 cDNA作为模板,使用上述引物进行PCR 扩增。将PCR 产物凝胶回收并纯化后克隆至pMD19-T载体,送至浙江尚亚生物技术有限公司测序鉴定,测序成功的阳性质粒命名为p19T-PRRSV2-M。使用微量紫外分光光度计测定阳性质粒浓度,并计算质粒拷贝数。质粒拷贝数=质粒浓度(μg/mL)×6.02×1023(copies/mol)/质粒碱基数×660(g/mol)。随后按照泊松分布的原理进行10倍倍比稀释质粒标准品,稀释至1×108~1×101copies/μL,每次稀释样品时,涡旋仪震荡30 s,移液枪吹打50次,重复3次,使质粒充分溶解于ddH2O中,做好标记,保存于-20 ℃冰箱备用。
1.6 RT-qPCR反应体系、反应条件的优化及标准曲线的建立
采用20 μL反应体系,2×AceQ qPCR Probe Master Mix 10 μL,探针(10 μmol/L)0.3 μL,上下游引物(10 μmol/L)分别设置3个体积,即0.4、0.6、0.8 μL以优化反应体系,模板1 μL,ddH2O 补齐至20 μL。反应条件为:预变性95 ℃ 5 min;变性95 ℃ 10 s,分别设置56 ℃、58 ℃和 60 ℃以优化反应的退火温度,退火时间31 s,循环数40个。将标准质粒10倍倍比稀释后,按照已优化的方法进行扩增,每个梯度设置3个重复,以Ct值为Y轴,标准品拷贝指数为X轴,由荧光定量PCR仪自动生成标准曲线。
1.7 特异性试验
用本实验室保存的PRRSV、CSFV、PRV、PCV2、PCV3、PEDV、PPV的核酸样本为模板,进行RT-qPCR反应,验证该方法的特异性。
1.8 重复性试验
用1×107~1×104copies/μL的阳性标准质粒进行RT-qPCR,每个梯度设置 3 个重复,根据检测所得Ct值计算组内标准差和变异系数;在不同时间段(间隔1周)对不同稀释度(107、106、105、104copies/μL)的标准质粒进行3次检测,根据所得Ct值计算组间标准差和变异系数(CV)。
1.9 临床样品的检测
取本实验室从江苏省部分猪场收集的30份PRRSV阳性病料,利用Bio Flux Simply P病毒DNA/RNA提取试剂盒提取PRRSV RNA,反转录cDNA为模板,按照本研究建立的方法进行RT-qPCR扩增,以验证本研究建立方法的有效性。
2 结果
2.1 标准质粒的制备
使用本研究设计的上下游引物扩增出目的片段(图略),将其克隆至pMD19-T载体上,测序后与所选区域的基因序列完全一致。测定阳性质粒浓度为203.64 ng/μL,根据拷贝数计算公式得出阳性质粒原始拷贝数为4.74×1010copies/μL,先将阳性质粒稀释至1×1010copies/μL,再按照泊松分布的原理对其进行10倍倍比稀释,取1×108~1×101copies/μL阳性质粒进行RT-qPCR检测。
2.2 反应体系和条件的确定
经过退火温度和引物探针配比的优化,最终确定了PRRSV2 TaqMan MGB实时荧光PCR扩增反应体系:2×AceQ qPCR Probe Master Mix 10 μL,探针(10 μmol/L)0.3 μL,上下游引物(10 μmol/L)各0.4 μL,模板1 μL,ddH2O补充至20 μL。扩增条件:95 ℃预变性5 min;95 ℃ 10 s,60 ℃ 31 s,采集 FAM 通道荧光,共进行40个循环。
2.3 标准曲线的建立
使用拷贝数为1×108~1×101copies/μL的标准品进行RT-qPCR,每组3个重复,设置1组阴性对照(模板为ddH2O )。结果显示,该基因的扩增曲线均呈现较为典型的S型(图1),不同稀释度下的扩增曲线间距均匀,阴性对照无扩增。以起始模板拷贝数的对数为X轴,Ct值为Y轴,绘制标准曲线,可见不同稀释度下呈现出良好的线性关系(图2)。以不同稀释度下的Ct值(表1)绘制标准曲线回归方程:y=-3.563x+41.659,R2=0.994,最低检测下限为10 copies/μL。
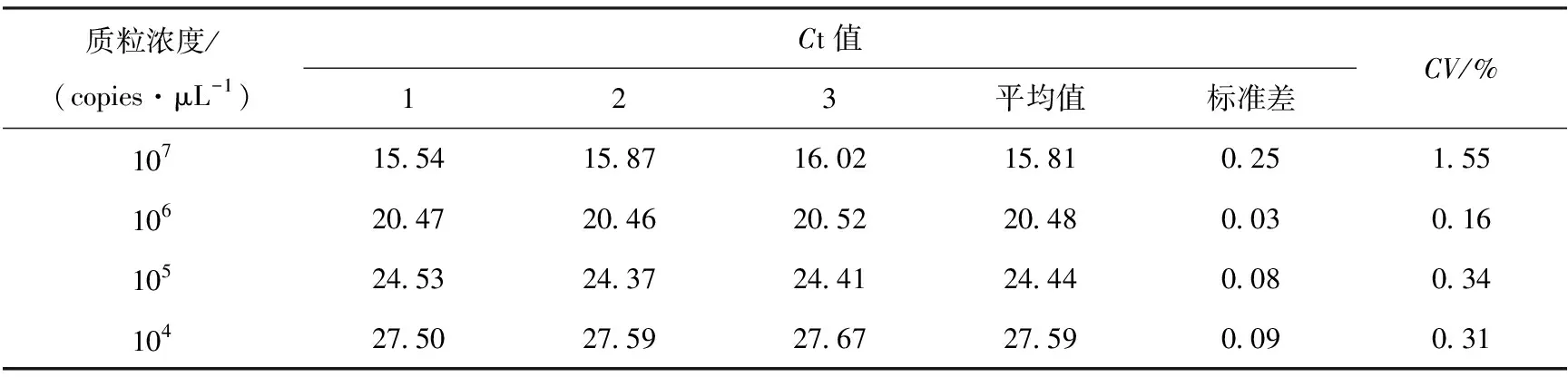
表1 荧光定量PCR批内重复性试验

图1 PRRSV2 ORF6基因TaqMan MGB RT-qPCR扩增曲线

图2 PRRSV2 ORF6基因TaqMan MGB RT-qPCR标准曲线
2.4 特异性试验
使用本研究建立的PRRSV2 ORF6基因 TaqMan MGB RT-qPCR方法对PRRSV1、PRRSV2、CSFV、 PRV、PCV2、PCV3、PEDV、PPV的核酸及阴性对照(ddH2O)进行扩增,结果如图3所示,只有PRRSV检测为阳性,其他核酸和阴性对照均为阴性,表明本研究建立的方法具有良好的特异性。

图3 PRRSV2 ORF6基因TaqMan MGB RT-qPCR方法的特异性检测结果
2.5 重复性试验
将p19T-PRRSV2-M质粒原液稀释至1×107~1×104copies/μL进行批内与批间重复性试验。结果显示批内变异系数分别为1.55%、0.16%、0.34%和0.31%(表1);批间变异系数分别为1.68%、1.32%、1.28%和1.07%(表2)。

表2 荧光定量PCR批间重复性试验结果
2.6 PRRSV临床阳性样品的检测
使用本研究建立的方法对30份PRRSV阳性样品进行检测,结果显示,30份阳性样品均具有明显的扩增曲线,阳性率100%,Ct值区间范围在22~36(图4),表明本试验所建立的方法可用于临床样品的检测。

图4 临床阳性样品的RT-qPCR检测结果
3 讨论
目前PRRS的防控依然是我国养猪业面临的最重大问题之一。不管是后备猪的更新入群,还是仔猪的保健免疫,通过实验室手段进行早期PRRSV的评估筛查,及时发现隐性带毒猪,对PRRS的防控具有非常重要的意义[11-12]。2017年,农业农村部对全国核心育种场提出了PRRS的净化要求和标准,即连续24个月以上无PRRS临床病例,且野毒感染病原学和抗体阴性,所以PRRS的净化工作更是离不开实验室检测。匈牙利通过实验室连续检测,结合灭活苗免疫及后备猪更新的方式实现了PRRS的净化[13]。2018年非洲猪瘟传入我国,为做好病原的早期筛查及精准剔除,RT-qPCR检测方法被广泛应用[14],极大地推动了我国动物疫病检测领域的发展,这也更有利于我国PRRS等疫病的防控与净化工作。
PRRSV是一种单股正链RNA病毒,全长约15 kb,具有快速变异与演化的特性[3-4]。近年来,我国PRRSV2的流行毒株发生变化,且多样性和复杂性明显增多[15],因此,建立一种特异性强、敏感度高的通用型检测方法对当前PRRS的诊断监控非常重要。PRRSV至少含有10个开放阅读框,编码多种非结构蛋白和结构蛋白[16],本研究通过大量比对GenBank上登录的PRRSV2不同谱系毒株的片段序列,发现编码主要结构蛋白M的ORF6基因上存在一段高度保守序列,设计了特异性扩增PRRSV2不同谱系毒株ORF6基因的引物对和探针。TaqMan-MGB探针是在经典TaqMan方法上经改良后发展而来的一种水解型探针,特异性大大增强,目前多种动物病原的RT-qPCR检测方法对TaqMan-MGB探针进行了更新与优化,且表现出了非常好的应用效果[17-19]。本研究通过优化反应条件和反应体系,在进行敏感性、特异性、重复性试验后,建立了检测PRRSV2 ORF6基因的TaqMan MGB探针RT-qPCR方法,该方法对CSFV、PRV、PCV2等常见的病原均无交叉反应,对不同滴度的阳性标准质粒模板均具有典型的扩增曲线,Ct值与浓度之间呈现良好的线性关系,最低检出浓度为10 copies/μL,相比于已报道的普通PCR方法,敏感性显著提高且检测时间大大缩短[20-21]。重复性试验显示组间与组内的离散度小,表明该方法具有良好的重复性。对30份PRRSV阳性样品(血样、唾液样、组织样、睾丸处理液等)进行检测,结果均为阳性,但与初检Ct值存在0.5~1.2的差异,这可能与样品长期存放的核酸降解有关。
综上,本研究所建立的TaqMan MGB探针RT-qPCR方法是一种特异、灵敏、高效且可应用于临床上不同种类样品的检测方法,为PRRSV2感染的快速诊断及防控净化提供了技术手段。

