鸭骨髓源树突状细胞的诱导培养及功能分析
李玲,祝博森,朱婷,钟睿,郭子杰,李睿婷,洪伟鸣,徐海
(江苏农牧科技职业学院,江苏 泰州 225300)
自从上世纪70年代Steinman等[1]发现树突状细胞(dendritic cell,DC)以来,研究人员对DC及其功能的认知不断深入,作为机体最重要的专职抗原递呈细胞(antigen presenting cell,APC),DC在启动获得性免疫和维持免疫耐受方面发挥重要作用,同时也是连接先天免疫与获得免疫之间的重要桥梁[2-3]。根据DC的来源、功能及其表面标志物的不同,可分为经典DC、浆细胞样DC和单核细胞来源DC[4-5]。根据抗原的来源和性质,DC主要通过MHCⅠ、Ⅱ类和交叉提呈途径对抗原进行加工和递呈。内源性抗原被DC降解成抗原多肽并装载于MHCⅠ类分子,提呈给CD8+T细胞,以诱导细胞免疫为主;而外源性抗原通过吞噬、胞饮、受体介导等内吞作用被DC摄取,加工后装载到MHCⅡ类分子,提呈给CD4+T细胞,主要激发体液免疫[3,6]。
虽然DC在机体内分布较为广泛,但细胞的实际数量小,且难以与其他类型细胞进行有效地分离纯化[7],因此需要建立体外培养方法来获得大量高纯度的DC,从而便于开展生物学、免疫学以及医学等领域的研究工作。目前,体外培养哺乳动物DC的技术已相对成熟,鼠源、猪源和人源DC均有成功报道的案例[8-10]。而家禽DC体外培养的报道相对较少,仅见付佳等[11]、张淑君等[12]利用白细胞介素4(IL-4)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)成功诱导培养出鸡骨髓源DC。由于缺乏鸭源的诱导因子以及鸭DC表面标志物特异性二抗,制约了鸭DC诱导培养方法的建立及后续鉴定工作的开展。因此,建立鸭DC体外诱导培养方法对进一步研究其生物学功能及鸭其他相关疾病的研究工作均具有重要意义。
本研究尝试利用鼠源的重组IL-4、GM-CSF作为诱导因子,诱导鸭骨髓源单核细胞向DC定向分化,从而建立鸭骨髓源DC的体外培养方法,并结合形态学观察、DC表面标志物检测以及生物学功能测定对制备的DC做进一步分析。
1 材料与方法
1.1 试验材料
SPF鸭胚购于山东昊泰实验动物繁育有限公司,本实验室自行孵化,并饲养至7日龄用于后续试验。
重组鼠IL-4 (货号214-14,PeproTech公司),重组鼠GM-CSF (货号315-03,PeproTech公司),PE Anti-CD11c抗体(货号ab210309,Abcam公司),FITC Anti-CD86抗体(货号ab2342237,Abcam公司),FITC Anti-MHC Ⅱ抗体(货号ab24882,Abcam公司),淋巴细胞分离液和配套分离管(天津灏洋公司),CCK-8溶液(货号CA1210,Solarbio公司),RPMI 1640培养液和胎牛血清(美国Gibco公司),脂多糖(LPS)(货号L5293,Sigma公司),鸭白细胞介素2 (IL-2)和鹅γ干扰素 (IFN-γ) (南京森贝伽生物科技有限公司),mRNA提取试剂盒及分子生物学(大连宝生物公司)。其余试剂均为分析纯。
光学倒置显微镜(日本尼康公司),流式细胞仪(美国BD公司),ELSIA酶标仪(美国Bio-Rad公司),台式离心机(美国Beck-man公司),荧光定量PCR仪(美国ThermoFisher公司)。
1.2 鸭骨髓细胞的分离培养
翅静脉注入空气处死7日龄雏鸭,然后浸泡于75%酒精2~5 min,转至无菌水中浸泡1 min以去除酒精。在洁净工作台内剥离出所有股骨和胫骨,剔除骨头上粘连的肌肉组织,再浸泡于含2%双抗的PBS中5 min。剪去骨头两端,用无菌PBS反复冲洗出骨髓至平皿中,直至骨髓腔变白。收集骨髓悬液,经200目尼龙网过滤小碎片和肌肉组织。滤过液用PBS洗涤2次并重悬至3 mL,按照等体积比将骨髓细胞缓缓加入预先装有淋巴细胞分离液的离心管中,1 500 r/min离心25 min,小心吸取中间白雾层细胞至另一离心管中,PBS洗涤2次,用3 mL含10%胎牛血清的RPMI 1640培养液重悬细胞,台酚蓝染色计数并计算细胞活力。
1.3 DC诱导分化条件的优化
如表1所示,选择血清、IL-4和GM-CSF这3个因素,每个因素对应2个浓度水平,设计正交试验,对比A、B、C、D共4个培养组中DC的吞噬能力。用RPMI 1640培养液调整制备的骨髓单核细胞浓度至2×105个/mL,2 mL每孔铺细胞至6孔板中,置于37 ℃、5% CO2培养箱中持续培养。每隔1 d更换50%的培养液,同时补足工作浓度的IL-4、GM-CSF,并于诱导培养后的第5天加入工作浓度为1 μg/mL的LPS,刺激48 h后收集细胞。诱导培养期间,用光学倒置显微镜观察细胞形态变化并拍照记录。

表1 细胞培养条件优化
1.4 DC吞噬功能的测定
参照文献[13],分别在诱导培养后第1、3、5、7天从4个培养组收集细胞,计数后调整细胞浓度至1×105个/mL,转移500 μL细胞至12孔细胞板,加入等体积0.1%中性红生理盐水溶液,37 ℃孵育2 h,收集细胞并用PBS缓冲液洗涤3次,加入500 μL 1% SDS溶液,室温作用2 h裂解细胞,取100 μL至ELISA板中,并设置3个重复,测定波长570 nm处吸光值,以OD值表示DC的吞噬能力。
1.5 流式检测DC表面标志物
采用最佳培养条件,收集培养至第7天的DC,1 000 r/min离心10 min后弃上清液,用PBS缓冲液重悬细胞,并调整细胞浓度至5×105个/mL;调整未经诱导培养的骨髓单核细胞至相同浓度。分别将2种细胞分成4等份,取其中3份分别加入工作浓度的抗CD11c、CD80和MHCⅡ荧光二抗,室温避光孵育30 min,另1份不做处理用作空白对照。孵育后的细胞用PBS缓冲液洗涤细胞3次(1 000 r/min离心5 min),最后用200 μL PBS重悬细胞,经流式细胞仪检测DC表面标志物的表达情况。
1.6 DC培养上清液中细胞含量测定
选择最佳培养条件,分别在诱导培养第1、3、5、7天细胞中收集200 μL培养配液,5 000 r/min离心10 min,收集上清液,-80 ℃冻存备用。根据细胞因子检测试剂盒操作说明书,分别测定DC培养上清液中IL-2和IFN-γ的含量。
1.7 同种异体混合淋巴细胞反应
分离雏鸭外周血淋巴细胞[14],调整细胞浓度并以每100 μL 1×105个接入96孔板作为应答细胞。诱导培养DC至第5天,将细胞等分成2组,其中1组添加工作浓度的LPS来促进DC成熟,另1组不做任何处理。48 h后分别收集2组DC作为刺激细胞。按照1∶1、1∶5和1∶10的比例混合刺激细胞和应答细胞,置于37 ℃继续培养48~72 h,每个样品设置3个重复,并同时设置应答细胞、刺激细胞的对照。培养结束后,每孔加入10 μL CCK-8溶液,继续孵育4 h,读取450 nm处吸光值(OD450)。按照公式计算刺激指数(SI),SI=(试验组OD450值-刺激细胞对照OD450值)/应答细胞OD450值。
1.8 数据统计和分析
采用SPSS 19.0软件包对数据进行分析,One-way ANOVA法检验差异显著性,试验结果以“平均数±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 体外培养鸭骨髓源DC形态观察
从鸭骨髓中分离的单核细胞经GM-CSF和IL-4诱导后逐渐向DC定向分化。每天于倒置显微镜下观察细胞形态变化,结果显示:刚分离的骨髓单核细胞呈球状,直径较小自然沉降于细胞板底部,轻轻晃动即重新悬浮。诱导培养至第3天,部分细胞贴壁、拉伸,可见短小刺突(图1A);继续培养至第5天,大部分细胞贴壁生长,且以菱形结构为主,刺突增多(图1B);经LPS刺激后,DC趋于成熟且呈多形性,刺突明显增多且粗壮(图1C)。经诱导分化,体外培养的细胞形态上呈现出典型的DC特性,初步说明已成功培养出目的细胞。
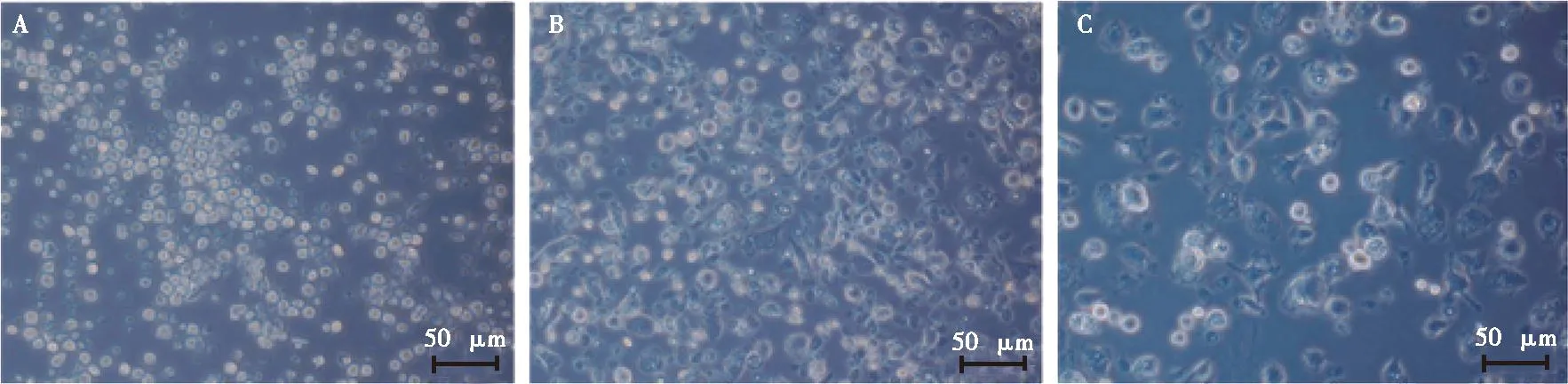
A、 B、 C. 分别为诱导培养第3、5和7天的细胞形态。
2.2 不同培养体系中DC吞噬能力的比较
如图2所示,用15%胎牛血清、20 ng/mL IL-4和40 ng/mL GM-CSF的C组所诱导的DC吞噬能力最强。此外,随着诱导培养天数的增加,其DC吞噬能力亦相应增强,并在培养后第5天达到高峰;而LPS刺激熟化48 h后的DC,其吞噬能力有所下降。上述吞噬能力的差异,间接说明通过优化诱导培养条件可以提高单位时间内DC的活力和数量,且成熟后的DC吞噬能力较成熟前略有下降。

图2 不同培养条件的DC吞噬能力比较
2.3 DC表面标志物检测
分别用抗鸡源、鼠源DC表面标志物的荧光抗体标记制备的鸭骨髓源DC,经过流式细胞仪检测发现,诱导分化至第7天的DC表面标志物的表达量(图3D、E、F)较起始的骨髓单核细胞(图3A、B、C)有显著上调,DC表面标志物CD11c、CD80、MHC Ⅱ的表达量分别为80.08%、81.27%和91.47%。该结果表明成功诱导培养出DC,且具有较高的纯度。
2.4 DC分泌细胞因子的含量
根据细胞因子检测试剂操作说明书,测定不同时间点细胞培养上清液中IL-2和IFN-γ的含量变化。从表2可以看出,随着培养天数的增加,2种细胞因子的分泌量整体呈上升趋势,IL-2的含量在第3、5天差异不显著。培养至第5天的DC经LPS刺激后,在第7天DC分泌细胞因子量显著上升,IL-2和IFN-γ的含量分别达到(51.28±2.16)和(113.36±8.64)pg/mL,比刺激前提高约2倍。

表2 树突状细胞培养上清液中细胞因子含量测定 pg/mL
2.5 DC激活淋巴细胞的能力
DCs作为刺激细胞与淋巴细胞按照不同比例混合培养,从图4可以看出,DC作为刺激细胞可以刺激淋巴细胞增殖,但LPS刺激成熟后的DC激活淋巴细胞的能力更强。成熟前后的DC与淋巴细胞以1∶5比例混合培养时,其刺激能力较强,SI值分别达到1.3和1.7。

注:*表示P<0.05。
3 讨论
现在普遍认为绝大多数的DC发育起源于骨髓造血干细胞,然后在多种细胞因子(GM-CSF、FLT3L)和转录因子(PU.1、E2-2、Id2、Batf3、IRF4、IRF8)的共同作用下,骨髓造血干细胞定向分化成髓系和淋巴系DC前体细胞,这些前体细胞进入血液循环,最后在淋巴组织和非淋巴组织中进一步分化成熟[15-16]。在体内,GM-CSF对DC的分化是非必需的,但在体外,该因子可以促进骨髓造血干细胞或单核细胞向DC定向分化,是维持DC发育和分化的最根本的细胞因子[17]。此外,IL-4能够协同GM-CSF增强细胞集落的生产,刺激细胞增殖并维持DC的成熟状态,TNF-α可以刺激DC趋于成熟[18]。目前,已经建立的DC体外诱导培养方法都必需有细胞因子的参与。
本试验中首次采用鼠源GM-CSF和IL-4联合刺激培养鸭骨髓单核细胞向DC的定向分化。刘迪[19]利用重组人源GM-CSF、IL-4体外诱导培养出鸡骨髓源DC,说明异源细胞因子也可以用于DC的诱导培养。为了确保DC体外诱导培养的成功,本试验针对培养体系中的血清、GM-CSF和IL-4这3个关键因素进行正交试验优化,通过评价不同时间点DC的吞噬能力最终确定最佳培养条件,发现在培养基中添加15%胎牛血清、20 ng/mL的IL-4和40 ng/mL的GM-CSF诱导培养的DC吞噬能力最强。在培养后3 d,可以在显微下观察到细胞从球形向菱形的转变,继续培养至第7天可以明显看到典型的树突状细胞形态。细胞表面特异性标志物是鉴定细胞的关键,本试验中由于缺乏鸭DC表面标志物的荧光二抗,故选择抗鸡MHCⅡ、抗鼠CD11c和CD80的抗体进行替代,用于流式检测鸭DC的纯度,从结果可以看出,3个抗体均能与鸭表面标志物结合,其CD11c、CD80和MHC Ⅱ的表达量分别达到80.08%、81.27%和91.47%,显现出较高的纯度。综合DC形态学变化和表面标志物的检测结果,表明已经在体外成功培养出高品质的鸭骨髓源树突状细胞。
有研究表明,未成熟的DC能够高效地摄取病原体、死亡细胞和其他抗原物质,并对其进行加工处理[20],此时DC表面的MHCⅠ、Ⅱ类分子,T细胞共刺激因子以及黏附分子的表达量较低[21];而成熟的DC的抗原摄取能力下降,但MHCⅠ、Ⅱ类分子,共刺激分子和黏附分子等表达量上调,此外还会分泌和表达一些细胞因子和趋化因子来调控T细胞分化[22]。本试验中用LPS刺激培养至第5天的DC以促进其成熟,成熟后的DC吞噬能力下降,而培养上清液中分泌的IL-2、IFN-γ量显著增加,并且成熟的DC更能刺激淋巴细胞的增殖。这些试验结果与上述报道相符,说明制备的细胞具备了树突状细胞的基本生物学功能,进一步证明了体外诱导培养鸭骨髓源DC取得成功。
综上,本研究诱导培养的鸭骨髓源DC具备较高的纯度,能够满足后续科学研究的需求,为鸭DC相关研究奠定了坚实的基础。

