镍基物料中铁分析方法建立
李霞 宁骏斌 李涵 刘群 李春芳


摘 要:本研究采用氢氧化镧为载体,在pH=10的氨性缓冲溶液中共沉淀富集分离铁,使用空气-乙炔火焰,于原子吸收分光光度计波长248.3 nm处测定铁。结果表明,原子吸收法测定铁样品的RSD在3.21%~12.85%,加标回收率为90.0%~105.0%。
关键词:火焰原子吸收光谱法,镍基物料,铁分析方法,氢氧化镧
DOI编码:10.3969/j.issn.1002-5944.2024.07.035
0 引 言
金川公司是我国最大的电解镍生产商,镍基溶液中微量元素铁、铝含量是工艺控制的关键指标,其高低直接影响到电解镍的质量和等级的判定。精炼中控镍基体溶液中微量杂质元素铁、铝量是电解镍产品工艺控制过程中一项重要质量控制指标,含量的高低在不同生产工序中都有明确的限量要求。对于铁元素的分析,40多年来一直执行《硫氰酸盐-乙酸乙酯萃取滴定比色法》分析标准,该标准稳定可靠,从制定至今在电解镍产品生产过程中,为保证产品质量发挥了积极的作用。但该方法最低值为0.00020 g/L,车间要求零号镍铁的指标小于0.00020g/L,分析数据必须以真实数据报出,不能打界限值,因此,现有的分析方法不满足零号镍对铁指标的要求。在镍系统新液中镍浓度约为50~80 g/L、钠离子约为35~45 g/L、硫酸根约为80~200 g/L、氯离子约为60~90 g/L、铜约为0.10~5.0 g/L、钴约为0.1~10 g/L,阴离子和阳离子都会干扰铁的测定,镍与铁的比例为:1600000:1,液体物料干扰倍数约是固体物料的8倍,大量阴离子的存在也会干扰铁的测定。采用硫氰酸盐-乙酸乙酯滴定比色法测定时,大量钴的存在,严重干扰铁的测定,无法看到铁与硫氰酸盐形成的红色络合物,只能看到钴与硫氰酸盐形成的蓝色络合物,目视比色法无法消除钴对铁的干扰。采用原子吸收法测定时,样品含盐量约18%~25%。待测的微量元素含量已接近原子吸收仪器的最低检出限量,不用稀释(或小比例稀释)直接测定仪器雾化系统和燃烧头会出现积盐和堵塞,致使原子吸收仪器无法正常连续工作,稀释虽然解决了原子吸收仪器无法正常连续工作的问题,但使得本来很低的微量元素含量变的更低,导致仪器无法有效检出。需要对铁的分析方法进一步开发,满足生产需求。
1 实验部分
1.1 仪器及试剂
240FS型原子吸收光谱仪(安捷伦公司);镍铜铁钴锰复合灯;氯化铵(分析纯);硝酸镧溶液(50 g/L);硝酸(1+1);硝酸(1+4);氨水(ρ0.90 g/mL);氨水(1+10);盐酸(ρ1.19 g/mL);氨性缓冲溶液:称取70 g氯化铵溶于水中,加600 mL氨水用水稀释至1000 mL。
铁标准贮存溶液:称取1.4297 g三氧化二铁(99.90%以上)于500 mL烧杯中,加入20 mL盐酸,盖上表皿,低温加热溶解至小体积,取下冷却,用水冲洗表皿及杯壁,移入l000 mL容量瓶中,以水定容。此溶液l mL含l mg铁(Ⅲ)。
铁标准溶液:移取10.00 mL铁标准贮存溶液于200 mL容量瓶中,加入10 mL盐酸,以水定容。此溶液1 mL含50 ug铁[1]。
1.2 实验方法
1.2.1 工作曲线的绘制
移取0.00、1.00、2.00、4.00、6.00 mL铁标准溶液,置于一组100 mL容量瓶中,分别加入10 mL硝酸,以水稀释至刻度,混匀[2]。此溶液中铁浓度依次为0.00、0.50、1.00、2.00、3.00 mg/L,采用工作曲线法在原子吸收光谱仪上绘制工作曲线。
1.2.2 样品分析
1.2.2.1 空白试验
随同试料作空白试验。
1.2.2.2 共沉淀分离富集
按照样品含量分取一定量的试料,将试料置于500 mL三角烧杯中,加入2 mL硝酸镧溶液,在搅拌下,加入50 mL氨性缓冲溶液,搅拌2~3 min。将三角烧杯中共沉淀物移入玻砂漏斗中,用氨水洗涤定量转移,真空抽滤至干,再用水冲洗玻砂漏斗壁及共沉淀物一次,真空抽滤至干。加入2 mL硝酸于玻砂漏斗中,待沉淀溶解后抽滤于25 mL比色管中,再每次用2 mL硝酸洗涤玻砂漏斗三次,洗涤液合并于25mL比色管中,以水定容、摇匀。样品含量较高时,可进行稀释后测定。
1.2.2.3 试液测定
使用空气—乙炔火焰,于原子吸收分光光度计波长248.3 nm处以水调零,测量铁的吸光度,从工作曲线上查出相应的铁的浓度,扣除空白样品的浓度,计算样品含量。
2 实验结果及讨论
2.1 共沉淀剂的选择
经查阅大量资料,共沉淀有两种方式。一是采用氨水做沉淀剂,氨水与铵盐在pH=8~10的缓冲溶液中,使铁定量沉淀[3];二是在热的稀酸性溶液中,采用水合二氧化锰形成共沉淀富集,使铁定量沉淀[4],与溶液中的镍、钴分离。通过加标回收率实验,两种方式均可富集铁,采用水合二氧化锰形成共沉淀富集分离后,待测溶液中含有大量的锰,约3 g/L,锰量小于2 g/L时不干扰铁的测定,大于2 g/ L时对铁的测定有影响是正干扰,而且随着锰量的增大,铁的干扰更大。因此,采用在pH=8~10时铁与氢氧化镧形成共沉淀与镍、钴分离的方法,效果令人满意。
2.2 共沉淀劑硝酸镧用量的选择
分别向镍电积新液和镍电解新液样品中,加入不同量的硝酸镧溶液[5],测定溶液中铁的吸光度,硝酸镧的用量在1~4 mL时,样品的吸光度处于一个平台,在此选择硝酸镧用量为2 mL。
2.3 氨性缓冲溶液用量选择
分别向镍电积新液和镍电解新液样品中,加入不同量的氨性缓冲溶液,测定溶液中铁吸光度。缓冲溶液的用量在40~70 mL时,样品的吸光度处于一个平台,本文选择缓冲溶液用量为50 mL。
2.4 溶解液及其酸度的选择
对硝酸和盐酸两种溶解液进行比较,实验发现硝酸作为溶解液溶解共沉淀的速度明显优于盐酸,因此选用硝酸作为溶解液。通过实验对溶解液硝酸的浓度进行了选择。随着硝酸浓度的增加,吸光度值越高,沉淀溶解更加彻底,本实验选择硝酸浓度为(1+4)的即可满足分析要求。
2.5 稀释倍数的影响
镍基溶液中的铁含量变化较大,镍电解新液中铁的含量极低,为了保证在试验条件下铁的富集效果,在规定的试验条件下,分取不同体积的镍电解新液和混合阳极液进行分离富集后测定。镍电解新液中铁含量低,取样量小,吸光度低,取样量太大,样品结果偏低,对镍电解新液铁含量在0.000010~0.00060 g/L的样品,取样量在30.00~60.00mL均可,选择镍电解新液取样量为50.00 mL,对高含量的铁,取样量不影响结果测定,均可被富集。
2.6 分离效果
选取镍电解新液、镍电积新液、混合阳极液、萃余液,采用该方法沉淀后,对沉淀前后的溶液进行了各元素含量的比对,数据见表1。
由表1的数据可以看出,分离后溶液中含有少量的干扰元素,除杂效果明显,均不干扰原子吸收法测定铁。
2.7 方法的检出限
按实验方法,在仪器最佳工作条件下,测定试剂空白11次,以测定结果标准偏差的3倍为方法检出限,以标准偏差的10倍作为该方法的测定下限。
由表2可看出,该方法的检出限为0.042 mg/L,测定下限为0.14 mg/L。
3 试样分析
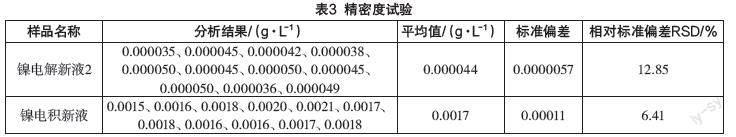
3.1 精密度试验
按照拟定的分析步骤分别对镍电解新液、镍电积新液、混合阳极液样品,测定11次,测定结果见表3。
从表3中的数据可以看出,不同的人测定11次,其RSD在6.41%~12.85%,满足分析要求。
3.2 样品加标回收试验
为了考察本方法的准确度,分别对镍电解新液、镍电积新液、混合阳极液样品,按实验方法进行加标回收试验,测定结果见表4。
从表4中的数据可以看出,样品的回收率为90.0%~105.0%,能够满足实际样品分析对准确度的要求。
3.3 方法对照试验
为了考察本方法的准确度,采用目视比色法与本方法进行对照,测定结果见表5。
从表5中的数据可以看出,两种方法对照结果吻合较好,该方法可以用于镍系统样品中铁的分析。
4 结 语
由以上试验结果可以看出,氢氧化镧沉淀富集分离镍系统样品中的铁是可行的,样品测定的RSD为3.21%~12.85%,稳定性能满足分析要求,样品加标回收率为90.0%~105.0%,准确度可满足分析要求。本方法经分离后,待测溶液中几乎无干扰离子,准确度高、精密度好,可滿足镍系统样品中铁的含量检测要求。
参考文献
[1]编委会编.化学分离富集方法与应用[M].长沙:中南工业大学出版社,1997:23.
[2]刘晓丽,潘丽娟,李希凯,等.分光光度法测定镍基物料中铝分析方法的研究[J].世界有色金属,2022(12):135-138.
[3]韩凤扬,唐卫华,吴小玲.镍铜合金中铁元素化学分析方法[J].化学工程与装备,2021(11):217-219.
[4]周建红.铜精矿中铁含量的不同分析方法研究[J].南方金属,2018(4):12-14.
[5]易承学,徐茜.“化学实验技术”大赛中铁含量测定方法影响因素分析[J].镇江高专学报,2023,36(1):113-117.
作者简介
李霞,高级工程师,研究方向为冶金矿石、金属物料等分析。
(责任编辑:张瑞洋)

