贵州南瓜蒂药材质量标准提升研究
傅 建 赵燕云 刘艳飞 李美位 张前飞*
1.贵州中医药大学药学院,贵州 贵阳 550025;2.贵阳市食品药品检验检测中心,贵州 贵阳 550081
南瓜蒂(CucurbitamoschataDuchesne ex Poir)始载于《本草纲目拾遗》[1],书中言“凡瓜熟皆蒂落,惟南瓜其蒂坚牢不可脱”。南瓜蒂味苦,微甘,性平,归肺、肝经。有解毒消肿、利水、清热安胎等功效,主要用于治疗痈疡,疔疮,烫伤,也可用于疮溃不敛,水肿腹水,保胎等证[2]。现代药理学研究[3-5]表明南瓜蒂中的葫芦素B和E具有广泛的生物活性,如抗肿瘤、抗肝癌、抗胃癌、保肝及提高机体免疫力等。南瓜蒂收载于《上海市中药材标准》 (1994年版)[6]和《贵州省中药材、民族药材质量标准》 (2003年版)[7]。由于制定年代较早、基础研究较为薄弱,只记载了其性状、显微鉴别等少数质量检查项,已无法满足当前的临床用药。为深入了解贵州南瓜蒂的物质基础,提升其药材质量标准,笔者对南瓜蒂水分、总灰分、酸不溶性灰分和豆甾醇进行定性和定量研究,为提升贵州南瓜蒂的地方标准,提高用药安全奠定基础。
1 材料与方法
1.1 仪器 高效液相色谱系统(美国安捷伦,Agilent Technologies 1260 InfintyⅡ);蒸发光散射检测器(美国格雷斯奥泰,Alltech 3300 ELSD);超声波清洗仪(上海科导超声仪器有限公司,型号:sk8200H);紫外仪(上海金达生化仪器有限公司);电子天平(十万分之一,岛津,型号:AUW120D;万分之一,上海菁海仪器有限公司,型号:FA2204N)。
1.2 材料 甲醇(色谱纯,安徽天地高纯溶剂有限公司);无水乙醇(分析纯,国药集团化学试剂有限公司);硅胶板GF254(青岛海洋化工);盐酸(优级纯,国药集团化学试剂有限公司);乙酸乙酯、二氯甲烷(分析纯,上海申博化工有限公司);石油醚(分析纯,重庆川东化工集团有限公司);磷钼酸(分析纯,科密欧化学试剂有限公司);豆甾醇(上海诗丹德标准技术服务有限公司,大于等于98%);12批南瓜蒂药材均采自贵州省不同区域,开阳、德江、江口、绥阳、扎佐、贵阳,由贵州中医药大学药学院生药教研室孙庆文教授鉴定为葫芦科植物南瓜(CucurbitamoschataDuchesne ex Poir)的瓜蒂。1~12批次分别用S1~S12表示,药材信息见表1。12批南瓜蒂批号为:20170901、20170902、20170903、20170904、20170905、20170906、20170907、20170908、20170909、20170910、20170911、20170912。
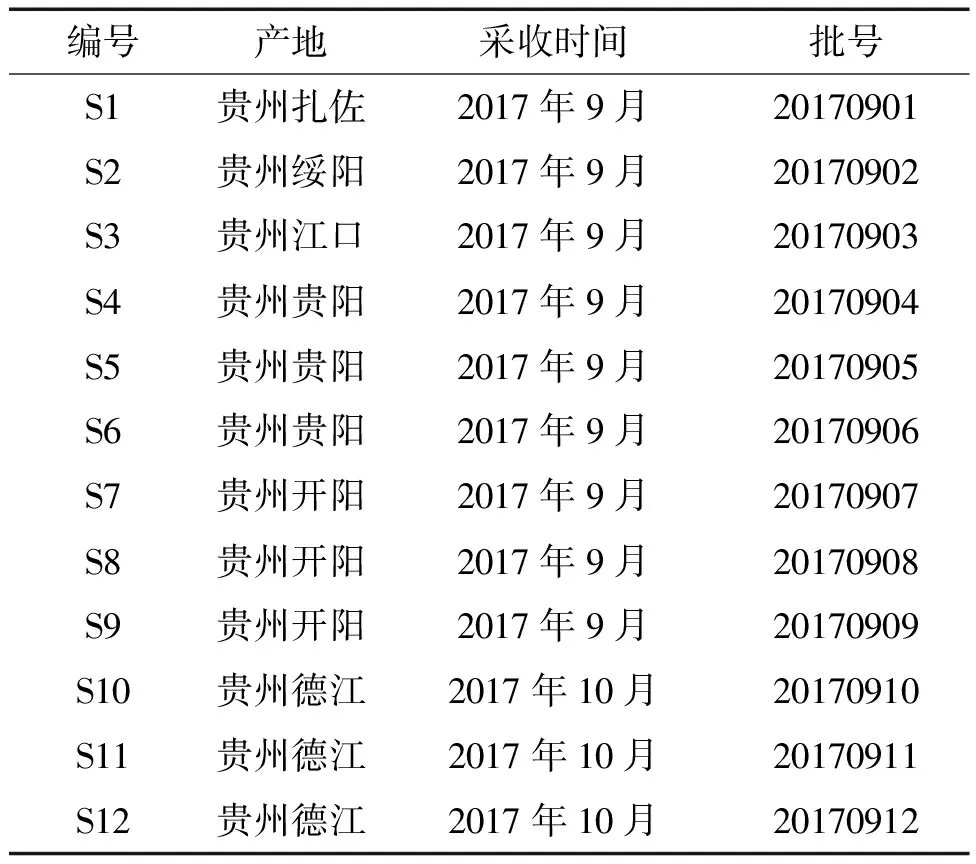
表1 南瓜蒂饮片产地信息一览表
2 方法与结果
本文分别对上述12批次的南瓜蒂进行水分、总灰分、酸不溶性灰分、薄层色谱定性鉴别和HPLC-ELSD定量研究。
2.1 水分含量测定 按照2020版《中国药典》四部(通则0832)的水分测定法第二法(烘干法)[8]。取供试品约2 g,平铺于干燥至恒重的扁形称量瓶中,厚度不超过5 mm,精密称定,开启瓶盖在 105 ℃ 干燥5 h,将瓶盖盖好,移置干燥器中,放冷30 min,精密称定,再在上述温度干燥1 h,放冷,称重,至连续两次称重的差异不超过5 mg为止。根据减失的重量,计算供试品中含水量(%)。结果见表2。
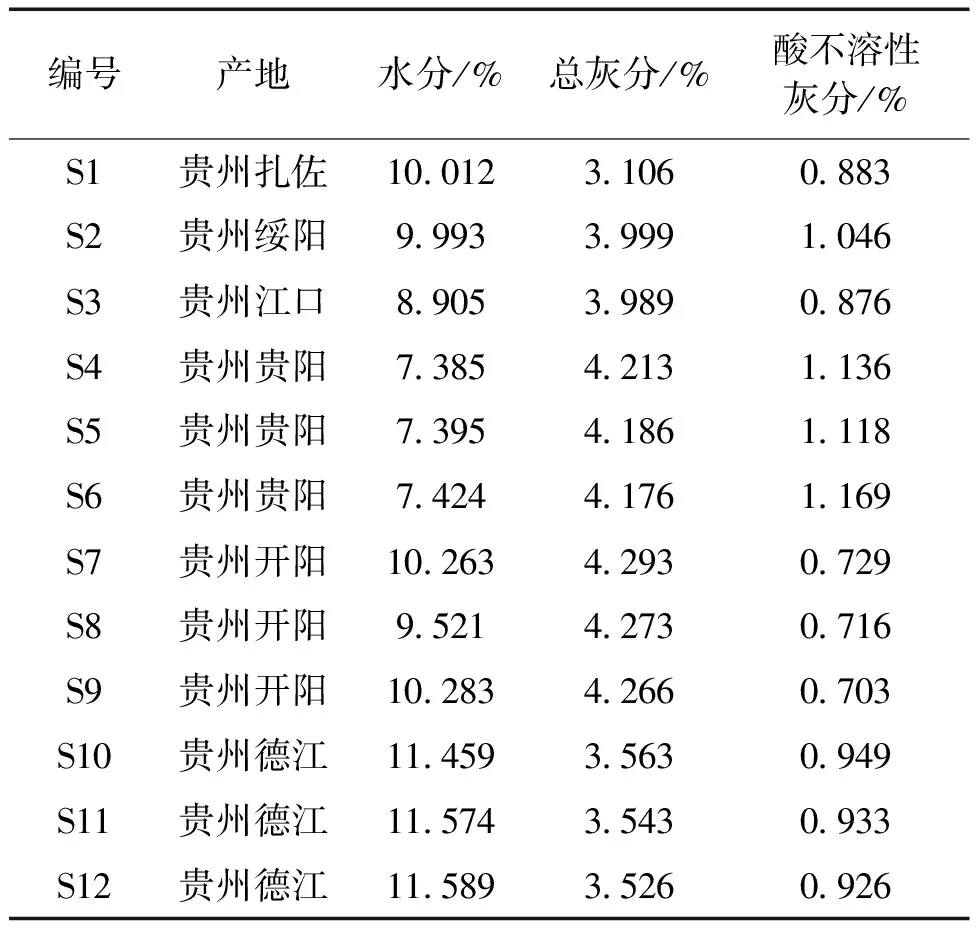
表2 南瓜蒂酸不溶性的测定
2.2 总灰分和酸不溶性灰分 按《中国药典》2020版第四部(通则2302)的灰分测定法进行测定,对总灰分、酸不溶性灰分进行考察。测定用的南瓜蒂粉碎,通过二号筛,混合均匀后,取供试品约3.0 g,置炽灼恒重的坩埚中,称定重量(精确至0.01 g),缓缓炽热,注意避免燃烧,至完全炭化时,逐渐升高温度至550 ℃,使完全灰化并至恒重,根据残渣重量,计算供试品总灰分含量(%)。取上述灰分置于坩埚中,缓慢加入稀盐酸约10 mL,用表面皿覆盖坩埚,置水域上加热10 min,表面皿用热水5 mL冲洗,洗液放入坩埚中,用无灰滤纸滤过,坩埚内的残渣用水洗于滤纸上,并洗涤至洗液不显氯化物反应为止。滤渣连同滤纸移置同一坩埚中,干燥,炽灼至恒重。根据残渣重量,计算供试品中算不溶性灰分的含量(%)。结果见表2。
2.3 豆甾醇定性分析(薄层色谱法)
2.3.1 对照品溶液的制备 精密称取10 mg豆甾醇对照品,加甲醇溶解并定容至10 mL,摇匀,制成1 mg/mL的豆甾醇溶液。
2.3.2 供试品溶液的制备 取不同批号的南瓜蒂打粉后,过三号筛,分别精密称取1.000 g置于具塞三角瓶中,分别加入20 mL甲醇,超声1 h,补足减失的重量。精密量取续滤液25 μL,蒸干,残渣加甲醇使溶解,定容至10 mL,滤过,取续滤液,即得。
2.3.3 定性分析 取上述制备好的对照品溶液与供试品溶液,分别点于硅胶GF254薄层板上,以二氯甲烷-乙酸乙酯(20∶1)为展开剂,展开,取出,晾干,在紫外仪下观察后,喷以5%磷钼酸试剂,用热风枪加热至斑点显色清晰。观察供试品与对照品斑点的位置。结果图1所示,豆甾醇与南瓜蒂药材在相同的Rf值处显示对应的斑点。初步确定南瓜蒂药材及饮片中含有豆甾醇,为了进一步证实,接下来将采用高效液相色谱-蒸发光散射法进行验证。
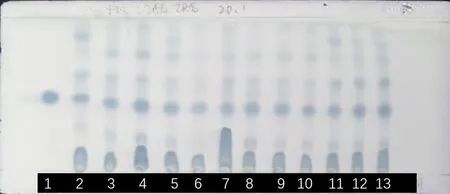
1.豆甾醇对照品;2.贵州扎佐;3.贵州绥阳;4.贵州江口;5.贵州贵阳;6.贵州贵阳;7.贵州贵阳;8.贵州开阳;9.贵州开阳;10.贵州开阳;11.贵州德江;12贵州德江;13.贵州德江
2.4 豆甾醇含量测定(高效液相色谱-蒸发光散射法)
2.4.1 对照品溶液的制备 精密称定,豆甾醇对照品2.58 mg,加甲醇溶解并定容至10 mL,即得。
2.4.2 供试品溶液的制备 按照“2.3.2 供试品溶液的制备”项下制备供试品。
2.4.3 色谱条件 InertustainC18色谱柱(4.6 nm×250 nm,5 μm),检测器为ELSD,流动相为甲醇-水(90∶10),流速1.0 mL·min-1,柱温30 ℃,漂移管温度80 ℃,气体体积流量1.5 mL·min-1,进样量20 μL。色谱图如图2所示。
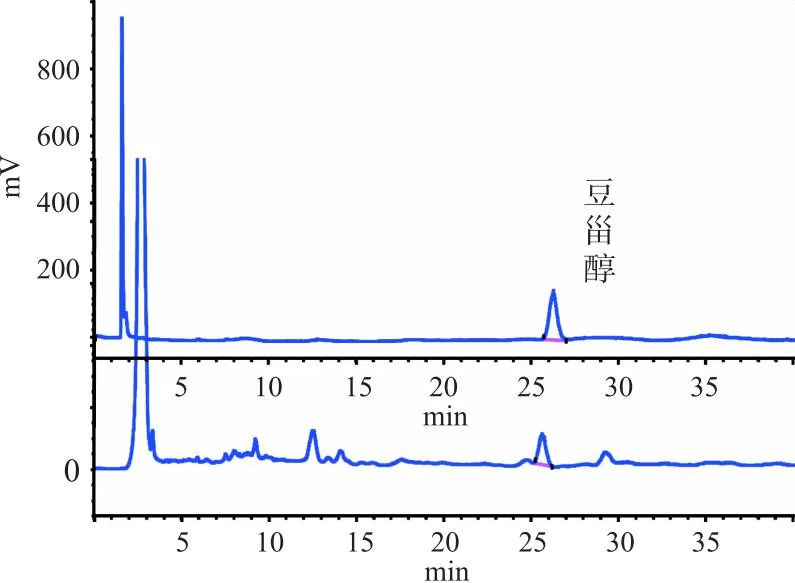
注:上图为对照品色谱图;下图为供试品色谱图
2.4.4 线性关系考察 精密吸取不同体积的对照品2 μL、5 μL、10 μL、12 μL、15 μL、18 μL、20 μL,按照“2.4.3”项色谱条件下测定峰面积,以峰面积为纵坐标,进样浓度为横坐标,绘制标准曲线。回归方程为Y=2.0×107X-855.48 (r=0.9994)。结果表明进样量在0.050×10-3~0.500×10-3mg范围内与峰面积积分值呈良好线性关系。如图3所示。
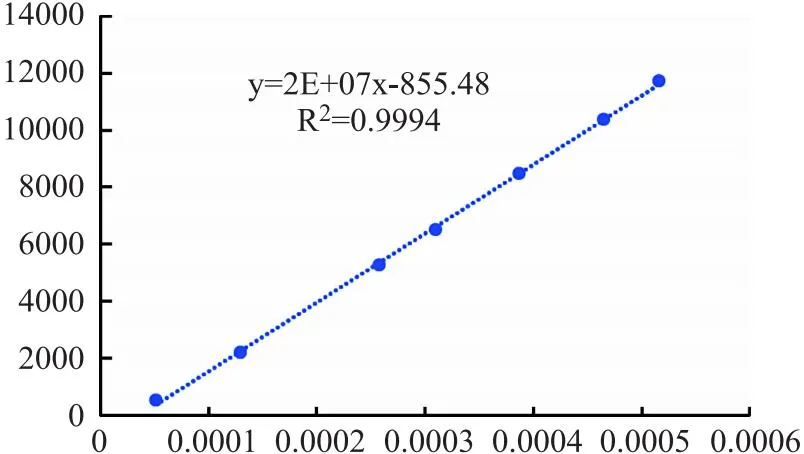
图3 线性关系图
2.5 精密度试验 精密吸取对照品溶液20 μL,连续进样6次,测定其峰面积。结果:对照品峰面积的RSD为1.6%(n=6),说明仪器精密度良好。
2.6 重复性试验 精密称定样品6份,每份5.0 g,分别按照“2.3.2”项下方法制备供试品溶液,按上述“2.4.3”项色谱条件测定其峰面积。结果6份供试液含量的RSD为1.67%(n=6),含量平均值为0.0444 μg/g,说明样品重复性良好。
2.7 稳定性 按照“2.3.2”项下方法制备供试品溶液,分别在0 h、2 h、4 h、6 h、8 h、10 h、12 h进行测定其峰面积。结果表明供试品的峰面积的RSD为1.22%,说明供试品溶液在12 h内稳定性良好。
2.8 加样回收率实验 精密称定已测得含量的样品6份,每份2.5 g,分别精密加入一定体积的对照品溶液,再根据供试品制备的方法制备,按“2.4.3”项的色谱条件进行测定。结果表明6份的平均回收率为98.95%,RSD为2.29%,回收率良好。结果见表3。
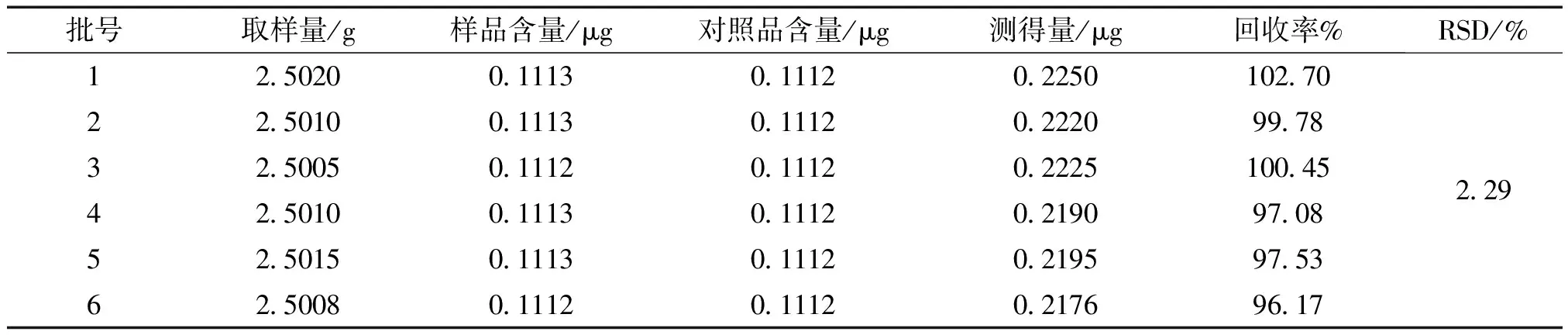
表3 回收率试验结果 (n=6)
2.9 样品含量测定 按照上述“2.3.2”供试品制备方法和“2.4.3”色谱条件下测定贵州不同地区南瓜蒂的含量。结果见表4。
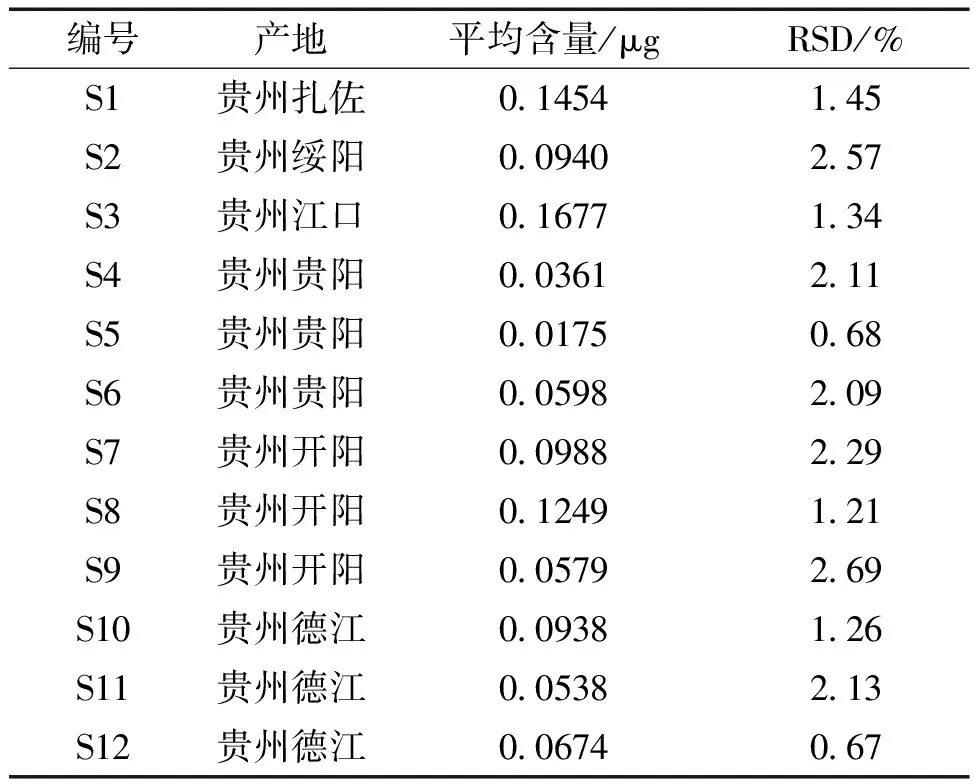
表4 样品测定结果
采用HPLC-ELSD法测定了来自于贵州省12批南瓜蒂药材中豆甾醇的含量。结果显示贵州南瓜蒂中均含有豆甾醇,但是含量差别较大。
3 讨论
3.1 指标性成分的选择 文献报道南瓜蒂中安胎的主要成分是葫芦素B[9],所以本文首先对贵州不同地区南瓜蒂的葫芦素B进行研究,但是通过TLC和HPLC检测,并未从贵州南瓜蒂中检测到葫芦素B。与此同时,报道南瓜蒂中也含有β-谷甾醇[10],同样通过TLC和HPLC-ELSD测定,也未从上述12批次贵州南瓜蒂中检测到β-谷甾醇。因此最终选择豆甾醇作为检测对象。
3.2 薄层色谱法 分别考察了豆甾醇不同的展开剂系统,如氯仿-甲醇、石油醚-乙酸乙酯、二氯甲烷-乙酸乙酯,最后确定二氯甲烷-乙酸乙酯为最佳展开系统,并对不同的比例(4∶1,8∶1,20∶1)进行了筛选,结果表明比例在20∶1时,Rf值适中。
3.3 高效液相色谱法 豆甾醇结构中不含共轭系统,在紫外下不显示荧光,故在TLC检测时采用5%磷钼酸显色。ELSD是萜类、皂苷类等化合物较为适宜的检测器[11],因此本试验选用ELSD器对其进行测定,方法简便,结果准确、可靠、重复性好,可作为本品质量控制方法之一。
综上,本研究增加南瓜蒂药材质量标准中水分、灰分检查,采用TLC定性分析豆甾醇,并首次采用HPLC-ELSD法测定贵州南瓜蒂中豆甾醇含量,完善南瓜蒂药材质量控标准,所建立的检查限度合理,含量测定方法专属性较强,精密度较高,重复性较好,为提升南瓜蒂药材质量标准提供参考。

