紫花牡荆素对脂多糖诱导的BEAS-2B细胞损伤和NF-κB-Keap1-Nrf2/ARE通路的影响
卢丽君 田辉 郑洋 胡汉姣 (武汉市中医医院肺系病科,武汉 430014)
常见的慢性气道炎症性疾病主要包括慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)和哮喘,发病率、病死率和致残率均较高,给社会造成了巨大的经济负担[1-2]。COPD多发于40岁以上人群(发病率约为10%)[3]。哮喘是世界第二大致残致死疾病,专家预测2025年我国哮喘患者将达到4亿[4]。慢性气道炎症性疾病的病因复杂,多种细胞因子、炎症细胞如白细胞介素、肿瘤坏死因子和干扰素等相互作用影响参与COPD和哮喘的发生和发展,促进气道炎症反应和气道损伤[5-7]。随着支气管扩张剂、抗氧化剂、磷酸二酯酶抑制剂和糖皮质激素等药物的使用,病死率和住院率略有下降,但往往会产生许多副作用,且对肺功能的衰退没有效果,因此继续寻找更加安全有效的药物具有重要的意义[8-10]。NF-κB和Keap1-Nrf2/ARE信号通路参与调节机体的炎症反应和氧化应激。近来多项研究发现NF-κB-Keap1-Nrf2/ARE信号通路相关蛋白在肺部疾病中具有重要的调节作用。异甘草素能够上调Nrf2和NF-κB的表达,抑制COPD小鼠肺部的炎症和氧化应激[11];补肺健脾益肾方能够下调NF-κB的表达,降低COPD大鼠肺组织中炎症因子的含量[12]。综上,NF-κB-Keap1-Nrf2/ARE信号通路在缓解COPD导致的氧化应激和炎症过程中有重要作用。紫花牡荆素(casticin,CAS)是中药蔓荆子的主要成分,许多研究显示,CAS具有抗炎和调节氧化应激的作用[13-14]。但CAS是否通过调节NF-κB-Keap1-Nrf2/ARE信号通路,进而缓解COPD导致的炎症还未阐明。本研究以BEAS-2B细胞为研究对象,构建细胞炎症模型,探讨CAS缓解COPD诱导的炎症反应的机制。
1 材料与方法
1.1 材料
1.1.1 细胞与试剂 人正常肺上皮细胞BEAS-2B源于中国科学院上海细胞库。气管上皮细胞培养基(Lonza;货号:CC3170);PBS、0.25%胰蛋白酶、十二烷基硫酸铵、TEMED、过硫酸铵、Tween-20、RIPA(强)组织细胞快速裂解液、BCA蛋白浓度测定试剂盒(Solarbio;货号分别为:P1010、T1350、S8010、T8090、A1030-1、T8220-100、R0010、PC0020);脂多糖(来源于大肠杆菌055:B5)、紫花牡荆素(阿拉丁;货号:L118716、V117963);ML385(Selleck;货号:S8790);人IL-1β、TNF-α、IL-6、IFN-γ ELISA试剂盒(Bioswamp;货号分别为:HM10206、HN10001、HM10205、HM10115);兔抗NF-κB p65、Keap1、Nrf2、GAPDH、Lamin B1、羊抗兔蛋白二抗(Bioswamp;货号分别为:PAB37352、PAB30175、PAB30615、PAB36269、PAB43971、SAB43714);兔抗p-NF-κB p65(Abcam;货号:ab76302);Annexin V-FITC/PI凋亡检测试剂盒(BD;货号:556547);蛋白质(Marker)(Helix;货号:P12103);PVDF转移膜、化学发光试剂(Millipore;货号为:IPVH00010、WBKLS0500)。
1.1.2 仪器 超净工作台(苏州智净;型号:SW-CJ-1D);生物安全柜(Spantech;型号:BSC-1300IIB2);CO2恒温培养箱、移液器(Thermo;型号分别为:311、F3);倒置荧光显微镜(Lecia;型号:DMIL LED);流式细胞仪(艾森;型号:NovoCyte);电泳仪(Bio-Rad;型号:mini protean 3 cell);酶标仪(雷勃;型号:MK3);干式恒温器(杭州爽盛;型号:K30);全自动化学发光分析仪(上海天能;型号:Tanon-5200)。
1.2 方法
1.2.1 细胞培养及传代 将BEAS-2B人正常肺上皮细胞培养于BEGM Bullet Ki(t气管上皮细胞培养基套装)中在37 ℃、5%CO2条件培养,按1∶2比例传代培养,取对数生长期细胞进行实验。
1.2.2 细胞损伤模型的构建 将细胞分为对照组和模型组,对照组换正常培养基,模型组换含有1 μg/ml脂多糖的培养基,置于37 ℃、5%CO2培养箱中继续培养24 h,收集细胞进行后续检测。
1.2.3 ELISA检测炎症因子浓度,筛选最佳作用浓度和时间 利用不同浓度(0.5、1、2、5、10 μmol/L)的CAS分别预处理1 h、2 h和4 h,然后脂多糖干预BEAS-2B细胞损伤24 h。按照ELISA试剂盒说明书检测各组细胞上清炎症因子IL-1β、TNF-α、IL-6、IFN-γ浓度,得出抑制炎症的最佳作用浓度A和时间B。
1.2.4 流式细胞术检测细胞凋亡 将对照组细胞分为6组:正常组、模型组、Casticin(A)组、ML385(20 μmol/L)组、Casticin(A)+ML385(20 μmol/L)组、地塞米松(0.2 mol/L)组。正常组正常培养细胞不做任何处理,模型组按照1.2.2的方法构建模型,其他组分别用对应浓度的药物预处理B小时,然后进行造模。收集各组细胞,取1×106个培养基重悬的细胞,400 g、4 ℃ 离心5 min,弃上清;加入1 ml预冷PBS,轻轻吹打混匀细胞,400 g、4 ℃ 离心5 min,弃上清;将细胞重悬于200 μl PBS;加入10 μl Annexin VFITC和 10 μl PI,轻轻混匀,4 ℃避光孵育30 min;加入300 μl PBS,随即进行流式细胞术检测,使用Novo-Express分析软件进行分析。
1.2.5 ELISA检测各组细胞IL-1β、TNF-α、IL-6、IFN-γ的浓度 按照ELISA试剂盒说明书检测各组细胞上清炎症因子IL-1β、TNF-α、IL-6、IFN-γ含量。
1.2.6 Western blot 检测CAS对细胞NF-κB-Keap1-Nrf2/ARE通路的影响 将细胞取出后吸去培养液,适量预冷的PBS洗涤2次,吸去PBS,按照1×106个细胞加入含有蛋白酶和磷酸酶抑制剂的裂解液200 μl,4 ℃充分裂解细胞,将细胞刮入1.5 ml EP管中,在4 ℃、12 000 g离心10 min,取上清,进行蛋白质定量。将各组样品于12%SDS-PAGE电泳,电转至PVDF膜。5%脱脂奶粉室温封闭4 ℃过夜。分别加入兔抗NF-κB p65(1∶1 000)、p-NF-κB p65(1∶1 000)、Keap1(1∶1 000)、Nrf2(1∶1 000)、GAPDH(1∶1 000)、Lamin B1(1∶1 000)室温孵育1 h。洗膜3次,孵育山羊抗兔二抗(1∶10 000)室温1 h。洗膜3次后,将膜放置在暗室中,根据用量取ECL发光液A和B等量混匀,加在膜的正面与之充分接触。然后将膜置于全自动化学发光分析仪中检测,通过TANON GIS软件读取相关条带灰度值。
1.3 统计学处理 使用SPSS25.0进行统计学分析,计量资料以±s表示,先进行正态性和方差齐性检验,若符合正态分布且方差齐性,则多组间比较使用单因素方差分析,组内两两比较采用SNK-q检验,若不符合则进行秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 筛选CAS的最佳作用浓度和时间 结果如图1所示,随着CAS浓度的升高,炎症因子的含量逐渐下降,CAS浓度为10 μmol/L时炎症因子的含量最低,因此选择10 μmol/L为CAS的最佳作用浓度;图中可以看出,当CAS的浓度为10 μmol/L时,随着处理时间的延长TNF-α的含量不断下降[4 h时含量为(143.14±5.23) pg/ml],而IFN-γ[(100.60±0.78) pg/ml、IL-6(60.82±2.24) pg/ml、IL-1β(131.56±2.85) pg/ml]都是在处理2 h时的含量最低,因此最佳处理时间为2 h。

图1 不同浓度CAS对细胞炎症因子的影响Fig.1 Effects of different concentrations of CAS on inflammatory factors
2.2 CAS对脂多糖诱导的BEAS-2B细胞凋亡率的影响 结果见图2。与正常组相比,模型组的细胞凋亡率[(35.79±1.38)%]显著升高(P<0.01);与模型组相比,Casticin组和地塞米松组细胞凋亡率[(20.43±0.19)%;(20.48±0.41)%]显著降低(均P<0.01);与ML385组相比,Casticin+ML385组的细胞凋亡率[(28.54±0.67)%]显著降低(均P<0.01)。

图2 CAS对脂多糖诱导的BEAS-2B细胞凋亡率的影响Fig.2 Effect of CAS on apoptosis rate of BEAS-2B cells induced by lipopolysaccharide
2.3 CAS对脂多糖诱导的BEAS-2B细胞炎症反应的影响 与正常组相比,模型组IL-1β[(508.02±4.52) pg/ml]、TNF-α[(525.26±1.79) pg/ml]、IL-6[(244.65±1.36) pg/ml]、IFN-γ[(417.63±5.22) pg/ml]的含量均显著升高(均P<0.01);与模型组相比,Casticin组和地塞米松组IL-1β[(341.48±5.00) pg/ml;(242.52±4.39) pg/ml]、TNF-α[(342.27±4.71) pg/ml;(217.95±2.55) pg/ml]、IL-6[(141.41±1.88) pg/ml;(91.54±1.01) pg/ml]、IFN-γ[(259.32±5.74) pg/ml;(190.52±3.44) pg/ml]含量均显著降低(均P<0.01);与ML385组相比,Casticin+ML385组IL-1β[(256.22±6.11) pg/ml]、TNF-α[(188.76±1.81) pg/ml]、IL-6[(111.15±2.02) pg/ml]、IFN-γ[(229.07±1.50) pg/ml]的含量均显著降低(均P<0.01)。见图3。
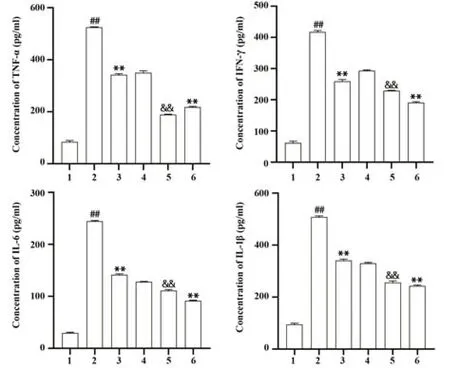
图3 CAS对脂多糖诱导的BEAS-2B细胞的炎症反应的影响Fig.3 Effect of CAS on inflammatory response of lipopolysaccharide- induced BEAS-2B cells
2.4 CAS对脂多糖诱导的BEAS-2B细胞NF-κBKeap1-Nrf2/ARE通路的影响 结果见图4。与正常组相比,模型组p-NF-κB p65(0.50±0.01)和Keap1(0.58±0.01)蛋白水平显著升高(P<0.01),细胞和细胞核中Nrf2(0.32±0.01;0.41±0.02)蛋白水平显著降低(P<0.01);与模型组相比,Casticin组p-NFκB p65(0.36±0.02)和Keap1(0.42±0.02)蛋白水平显著降低(P<0.01),细胞和细胞核中Nrf2(0.48±0.02;0.59±0.04)蛋白水平显著升高(P<0.01);与ML385组相比,Casticin+ML385组p-NF-κB p65(0.41±0.02)和Keap1(0.47±0.02)蛋白水平显著降低(P<0.01),细胞和细胞核中Nrf2(0.41±0.02;0.54±0.01)蛋白水平显著升高(P<0.01)。

图4 CAS对脂多糖诱导的BEAS-2B细胞NF-κB-Keap1-Nrf2/ARE 通路的影响Fig.4 Effects of CAS on NF-κB-KEAP1-NRF2/ARE pathway in lipopolysaccharide-induced BEAS-2B cells
3 讨论
慢性气道炎症性疾病的病死率较高,仅次于心脑血管疾病和恶性肿瘤,严重威胁人类的生命健康安全[15]。炎症机制是引起COPD和哮喘等慢性气道炎症性疾病的主要机制[16-17]。炎症反应介导的炎症可影响肺实质和气道,引起肺组织结构的变化,并使气道变得狭窄。炎症细胞如淋巴细胞、中性粒细胞和巨噬细胞等参与气道的慢性炎症过程,释放大量的炎症因子,这些炎症因子可以调节炎症细胞的功能,从而影响气道炎症反应[18]。研究表明,CAS的药理作用主要有抗肿瘤、抗炎、抗氧化和抗催乳素等,可以抑制炎症因子的释放从而发挥抗炎的作用[19]。诸多研究表明CAS在治疗肺疾病方面有着一定的作用。WANG等[20]发现CAS能抑制脂多糖诱导的小鼠急性肺损伤,LEE等[21]也发现CAS能改善吸烟导致的小鼠急性肺炎症状,但其机制尚不明确。因此,本研究以BEAS-2B细胞为研究对象,利用脂多糖构建细胞炎症模型,探究CAS治疗慢性气道炎症性疾病的可能机制。
细胞凋亡是一种非常严格的程序性细胞死亡,能够去除机体不需要的细胞或者异常细胞,有重要的生物学意义。研究发现细胞凋亡在COPD等的发病过程中具有重要的作用[22]。本研究发现CAS可以降低细胞凋亡率,提示CAS具有抑制细胞凋亡的作用。为进一步验证CAS对炎症反应的影响,本研究检测了CAS对脂多糖诱导的BEAS-2B细胞炎症反应的影响,结果显示CAS能够降低炎症因子IL-1β、TNF-α、IL-6和IFN-γ的含量,表明CAS能够缓解气道炎症反应。
NF-κB在细胞的炎症反应和免疫应答等过程中具有重要的作用。研究发现党参多糖能够下调NFκB mRNA表达,减轻COPD大鼠气道炎症反应[23]。核转录相关因子-2(Nrf2)广泛存在于多个器官和组织,在肺泡巨噬细胞和肺部上皮细胞中高表达。Nrf2信号通路核心分子包括Nrf2、Kelch样ECH相关蛋白-1(Keap1)和抗氧化反应元件(ARE)。Keap1-Nrf2-ARE信号通路是机体抗氧化应激的主要机制,在正常生理状态下,Nrf2被Keap1隔离在细胞质中,一旦发生氧化应激,Keap1就会释放Nrf2,使其进入细胞核与ARE结合,发挥抗氧化和抗炎的作用[24]。近年来发现多种中医药提取物和方剂能够通过调控Nrf2信号通路达到缓解COPD过程中炎症或者氧化应激的目的[25-27]。研究表明,Keap1不仅能调节Nrf2,还能调节NF-κB信号通路,两条通路间具有相互作用[28]。本研究也同样发现CAS能够缓解气道炎症反应,其机制与NF-κB-Keap1-Nrf2-ARE信号通路有关。为了进一步验证此结果,又利用ML385(Nrf2抑制剂)处理细胞,结果显示CAS仍能缓解抑制Nrf2所引起损伤,降低细胞凋亡率和炎症因子的含量,这表明CAS是通过调节Nrf2信号通路来发挥缓解气道炎症反应的作用。
综上所述,CAS可减轻气道炎症反应,其机制与CAS调控NF-κB-Keap1-Nrf2-ARE信号通路有关。

