多抗霉素对烟草靶斑病的防效及应用后其叶际微生物的变化规律
郭沫言 汪汉成 张艺 蔡刘体 王清 李文红 史彩华
摘要:为了评价多抗霉素对烟草靶斑病的田间防效及药剂施用后不同时期叶际微生物的变化规律,通过田间小区施用多抗霉素,并于施药后不同时期调查田间烟草靶斑病发病情况计算病情指数,于不同时期取样并通过Illumina HiSeq高通量测序技术分析多抗霉素对健康与感病烟叶叶际微生物群落结构及多样性。结果表明,多抗霉素处理3、9 d 的防效分别为89.80%、84.64%。施药后,感病组织亡革菌属的相对丰度显著降低,Symmetrospora的相对丰度呈提高趋势;健康与感病组织细菌中假单胞菌属、甲基杆菌属、鞘氨醇单胞菌属、金刚藻属的相对丰度均提高;施药后 18 d,健康与感病组织叶际真菌和细菌多样性及丰富度均提高。叶际微生物网络关系互作图显示,施药后亡革菌属与链格孢属呈负相关,且与其他真菌属大多也呈负相关;细菌属之间互作关系大多呈正相关,部分细菌属之间呈负相关。综上,多抗霉素能快速且稳定地防治烟草靶斑病的发生,能有效降低烟草靶斑病病原菌的相对丰度,同时对叶际其余菌属存在影响,随着时间的延长,防效较为稳定,证明多抗霉素能广泛用于烟草靶斑病的防治。
关键词:烟草靶斑病;多抗霉素;田间防效;叶际微生物;群落结构
中图分类号:S435.72 文献标志码:A
文章编号:1002-1302(2024)03-0138-09
烟草靶斑病(tobacco target spot)是由立枯絲核菌(Rhizoctonia solani)引起的真菌性病害,其有性世代为瓜亡革菌(Thanatephorus cucumeris)[1]。该病害可侵染烟草根部、茎基部和叶部,但以危害烟草叶片为主,病害流行时造成烟草大幅减产,经济受损严重。该病害最早于1948年在巴西发现,2006年在我国辽宁发现并报道,随后陆续在我国各烟草主产区暴发[2-3]。烟草靶斑病病菌在温度适中、相对湿度较高和叶片长时间湿润的条件下可大量繁殖,病害发生严重时烟叶坏死穿孔,导致烟叶无法正常采收,造成巨大的经济损失[4]。
化学药剂防控是防治烟草靶斑病的主要手段。目前,已登记的防控烟草靶斑病的药剂主要为8%井岗霉素水剂[5],已经开展过相关研究的药剂有嘧菌酯、嘧肽菌净、噻氟酰胺和多抗霉素[6-9]。其中,多抗霉素是一种用现代生物工程技术生产的肽嘧啶核苷类农用抗生素,主要作用于病菌细胞壁几丁质的生物合成,导致芽管和菌丝局部膨大、破裂、内含物溢出,病原菌不能正常发育乃至死亡[10-12],同时多抗霉素还能有效抑制病原菌产孢,具有内吸性、治疗作用及高度的靶标生物选择性,属于广谱性抗生素类杀菌剂[13]。多抗霉素常用来防治西瓜炭疽病、白菜霜霉病、番茄灰霉病和黄瓜白粉病等蔬菜水果以及农作物上的病害,同时也能有效防治烟草赤星病[14-19],但对于同样在烟草上发生严重的烟草靶斑病防控效果研究较少。
植物叶际微生物之间关联紧密,研究其与病害的关系是防治植物病害的重要途径[20-21]。烟草病害发生在不同时期,其叶际微生物的多样性和丰富度都会发生显著的变化。研究表明,烟草赤星病发生在不同部位烟叶的微生物结构存在差异,时空分布格局中下部叶片叶际微生物的多样性和丰富度较低,上部叶片较高[22-23]。而随烟草靶斑病发病程度增加,健康烟叶与感病烟叶的叶际真菌物种多样性显著降低,叶际细菌的物种多样性上升[24]。病害的发生与其叶际微生物的变化趋势紧密相关,药剂防控通过对病原菌的作用达到防治效果,但广谱性杀菌剂作用靶标为叶际多种致病菌[25]。田间病害的发生通常为多种病原菌共同作用的结果,在烟草靶斑病发生期,其叶际优势真菌有亡革菌属、Stagonosporopsis、链格孢属、亚隔孢壳属真菌,叶际优势细菌有假单胞菌属、泛菌属、肠杆菌属细菌;Didymella segeticola引起的烟草病害叶际优势真菌属含有链格孢属和Boeremia等致病菌;感染烟草野火病的烟叶叶际优势细菌属含有假单胞菌属、鞘氨醇单胞菌属和泛菌属等有益菌属;感染烟草赤星病的烟叶叶际同时存在链格孢属、茎点霉属和镰刀菌属等致病菌以及泛菌属、假单胞菌属和鞘氨醇单胞菌属等有益细菌[26-30]。
研究药剂对叶际微生物的影响有利于揭示植物病害的发生机制以及药剂的防控效果。因此,本研究通过田间施用多抗霉素,调查其对烟草靶斑病的田间防效,并对田间采集样品的叶际微生物进行分析,探索总结在施药后不同时期叶际优势菌属的物种组成以及丰富度的变化趋势,为烟草靶斑病的药剂防控提供参考依据。
1 材料与方法
1.1 供试药剂
10%多抗霉素可湿性粉剂(WP),青岛瀚生生物科技股份有限公司生产。
1.2 试验方法
本试验于2020年8月中旬在贵州省毕节市黔西县高坡开展,试验品种为云烟87。随机选取烟株长势一致的烟田并划分小区,每个小区20株烟株,3次重复。于烟叶底部叶片零星出现病斑时开始用药,参照药剂说明,多抗霉素用量为1.5 kg/hm2,兑水量为900 L/hm2,采用多功能喷雾施肥器喷洒药剂,使其均匀喷施于叶片表面。不同小区之间设立保护行,避免相互干扰。在施药前(0 d)随机选择相同部位、相同成熟度的叶片,随机选取并标记8个病斑,于施药后0、1、3、9 d,采用“十”字交叉法对标记病斑进行测量,计算多抗霉素处理对烟草靶斑病病斑扩展的抑制率[31]。各小区随机选择8株烟株,分别于施药后0、1、3、9 d调查统计其病情指数,计算多抗霉素对烟草靶斑病的田间防效;参照烟草靶斑病病害分级标准[32]调查病害等级。
病情指数=∑(各级病叶数×相对级数值)/(调查总叶数×最高病级值)×100;
防效=[1-(处理区病情指数增长值/对照区病情指数增长值)]×100%;
病斑增长率=[第n次测量病斑直径/第(n-1)次测量病斑直径-1]×100%。
1.3 样品采集与处理
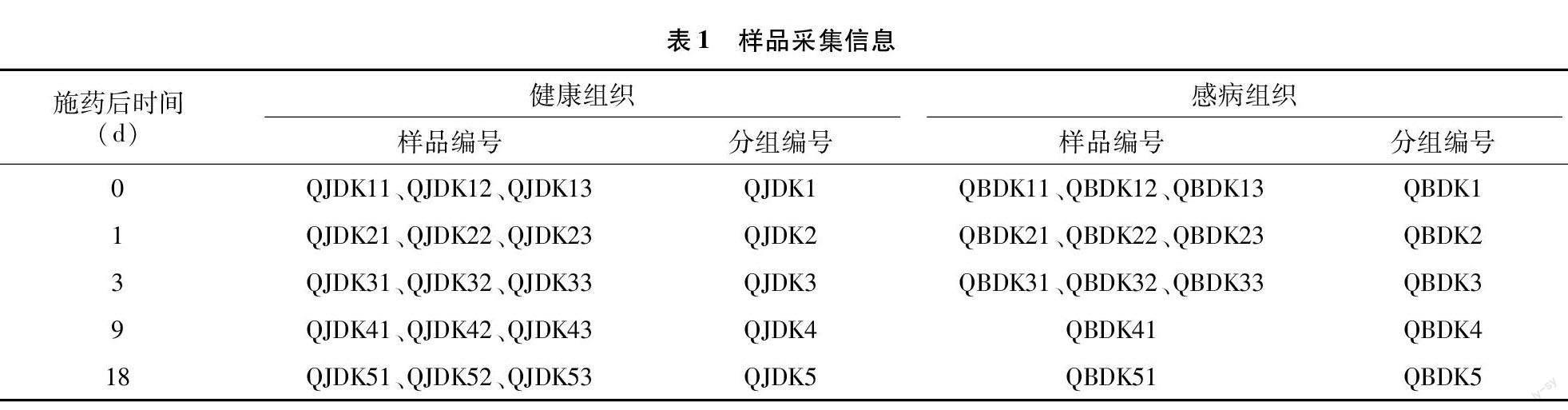
于施药后0、1、3、9、18 d随机选取施药烟苗健康与感病部位,用无菌剪刀对其进行剪取采集,分别装入50 mL无菌离心管中,每组3次重复,采集完成后迅速进行试验分析,剩余样品存放于-80 ℃冰箱中。样品采集信息详见表1,施药后9、18 d 由于病害晚期可供采集的样品有限,因此选取的样品为混合样品。
采用CTAB法分别提取各样本基因组DNA,使用无菌水稀释样本至1 ng/μL,使用特异性引物进行扩增,使用2%琼脂糖凝胶电泳检测PCR產物,使用德国QIAGEN公司提供的胶回收试剂盒对目的条带进行回收,使用 TruSeq DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,文库合格后使用NovaSeq 6000进行上机测序。
根据Barcode序列和PCR扩增引物序列拆分出各样本数据,过滤低质量和短长度后的序列,截去特异性引物序列后对每个样本进行拼接,得到原始数据。原始序列通过USEARCH扩增子分析软件与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列[33],得到最终的有效数据(effective tags)。
将所有序列聚类成为操作单元(OTU)进行物种注释,使用Qiime软件version 1.9.1分析其样本复杂度,主要包括α多样性(α diversity)、菌群丰度(community richness)、菌群多样性(community diversity)、测序深度(sequencing depth)和系统发育多样性(phylogenetic diversity)、环境关联因子、网络互作以及功能注释以上分析均在北京诺和致源科技股份有限公司完成。
1.4 数据分析
使用Excel 2022对调查数据进行统计分析处理,计算多抗霉素对烟草靶斑病的田间防效。运用DPS v9.01数据处理系统对测序样品的α多样性指数和菌群丰度进行差异显著性分析。采用Adobe Photoshop CS5对相关图片进行处理。
2 结果与分析
2.1 多抗霉素对烟草靶斑病的田间防效
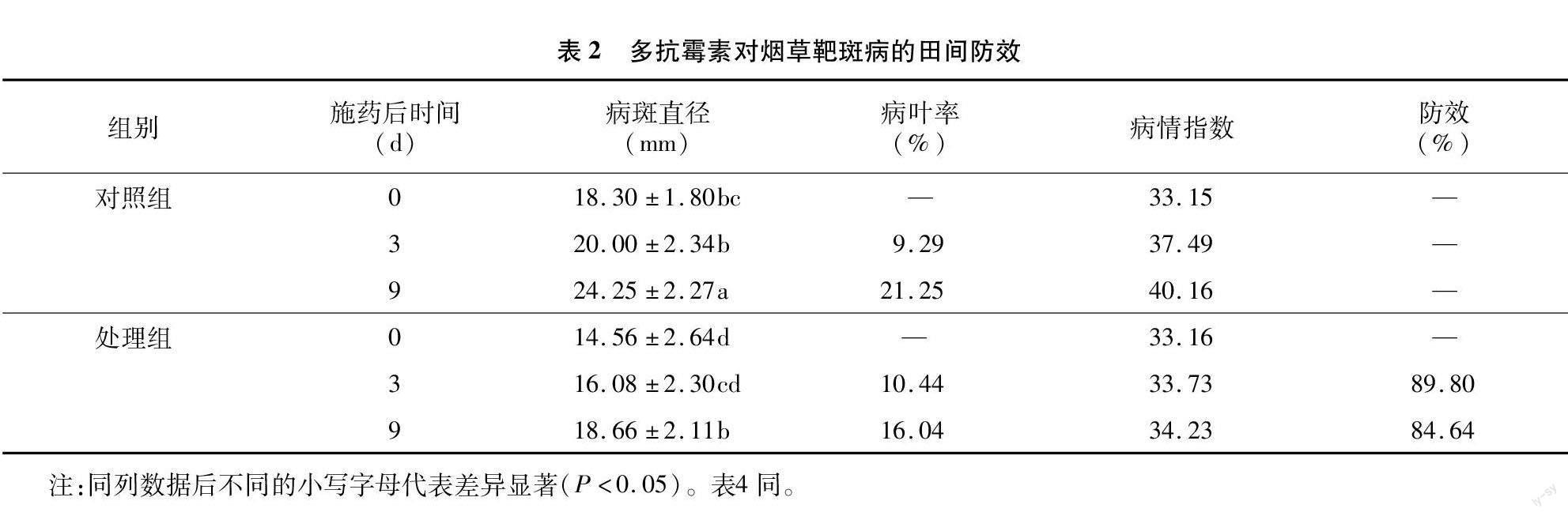
由表2可知,多抗霉素对烟草靶斑病具有良好的防效。施药后,烟草病斑直径增长率降低,病情指数增长变缓,烟草靶斑病的发生得到显著控制。施药后 3 d,对照组的病情指数达到37.49,处理组病情指数达到33.73,多抗霉素对烟草靶斑病田间防效达到89.80%;施药后9 d,对照组的病情指数为40.16,处理组病情指数为34.23,多抗霉素对烟草靶斑病田间防效达到84.64%。
2.2 多抗霉素防治烟草靶斑病不同时期烟叶叶际微生物组成
2.2.1 健康与感病组织叶际微生物测序深度
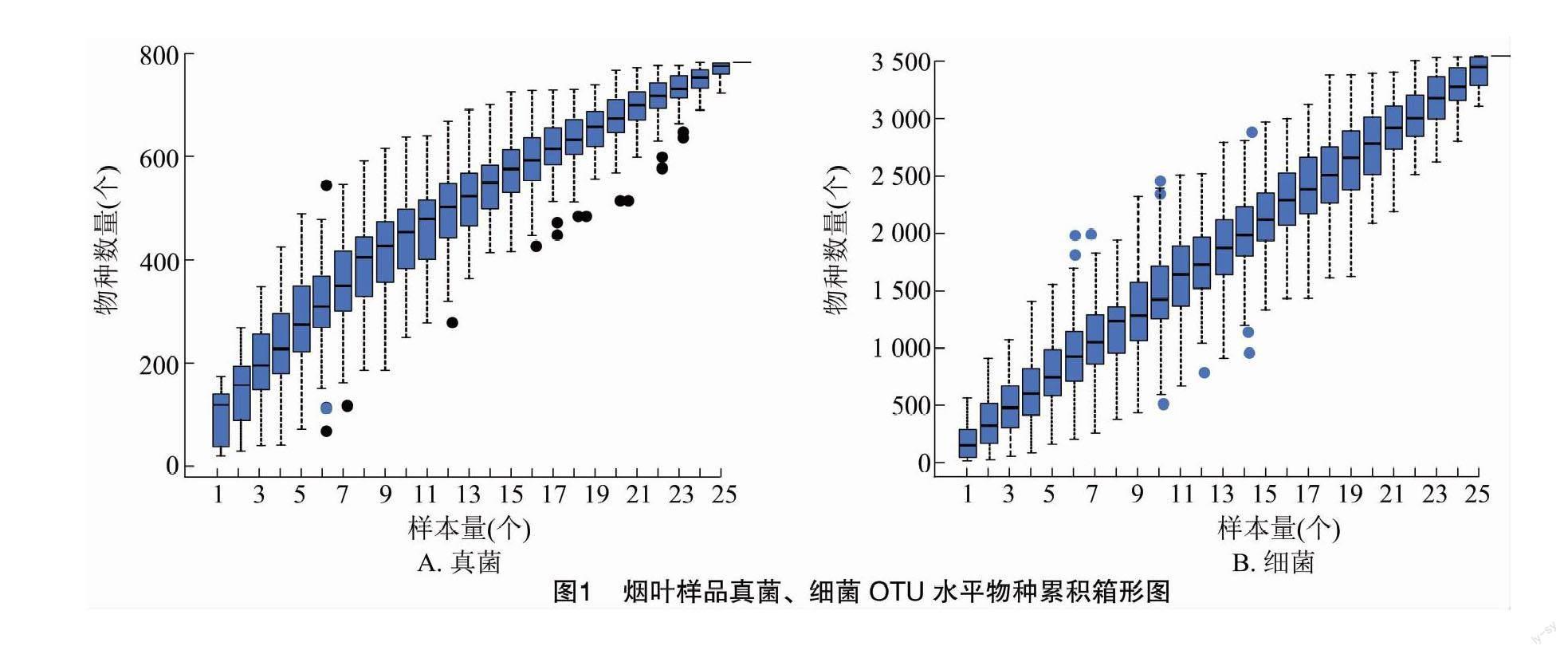
从样本中随机抽取一定测序量的数据,统计每组OTU数量,以样本量与OTU总数构建曲线,可直接反映测序数据量的合理性,间接反映样本中物种的丰富程度。当曲线趋向平坦时,说明测序样本量渐进合理,可以进行下一步分析。本次测序共25个样本量,越接近25个时,真菌的物种数量越接近800个,细菌的物种数量越接近3 500个,曲线逐渐趋于平缓,表明测序深度已经足够,可以进行数据分析(图1)。
2.2.2 健康与感病组织叶际微生物OTU结构
如图2所示,在叶际真菌群落中,健康组织中真菌共有OTU为28个,感病组织真菌共有OTU为10个,感病组织OTU数量低于健康组织OTU数量。多抗霉素处理后1、3、9、18 d,健康组织与感病组织OTU数量呈现“先增加后减少又增加”的趋势。药剂处理后18 d,健康组织OTU数量达到峰值,为159个;药剂处理3 d后,感病组织OTU数量达到峰值,为74个。细菌群落中,健康组织细菌共有OTU为26个,感病组织细菌共有OTU为24个,健康组织OTU数量均高于感病组织OTU数量。多抗霉素处理1、3、9、18 d后,健康与感病组织OTU数量呈现“先增加后减少又增加”的趋势。健康组织OTU数量在施药后18 d达到峰值,为1 106个,在施药前OTU数量最少,为27个;感病组织OTU数量在施药后1 d达到峰值,为348个,在施药前OTU数量最少,为46个。
2.2.3 健康与感病组织叶际微生物多样性
多抗霉素处理后不同时间,烟叶叶际真菌与细菌的相对丰度均存在明显变化(表3、图3)。在真菌门水平,其叶际优势菌门为担子菌门(Basidiomycota)、子囊菌门(Ascomycota)和毛霉门(Mucoromycota)。药剂处理后,健康组织与感病组织担子菌门的相对丰度均提高,子囊菌门的相对丰度降低。在真菌属水平,优势菌属包括亡革菌属(Thanatephorus)、Symmetrospora、毛霉属(Mucor)、小不整球壳属(Plectosphaerella)、尾孢属(Cercospora)、汉纳酵母属(Hannaella)、链格孢属(Alternaria)、红酵母属(Rhodotorula)、枝孢属(Cladosporium)和顶孢霉属(Acremonium)。随着施药时间的延长,健康组织各优势菌属的数量增加。施药后1~3 d,健康组织与感病组织亡革菌属的相对丰度持续下降;施药后 18 d,健康组织中其相对丰度降低为0.24,感病组织中其相对丰度低于健康组织。施药后,健康组织与感病组织中Symmetrospora的相对丰度呈提高趋势;施药后18 d,健康组织与感病组织中其相对丰度达到最大值(0.09和0.82),且健康组织中其相对丰度显著低于感病组织;此时,健康组织中毛霉属的相对丰度也达到最大值(0.11)。
细菌优势菌门包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes),其中感病组织中变形菌门的相对丰度显著高于健康组织。多抗霉素处理后1、3 d,变形菌门的相对丰度随时间增加而升高,并达到峰值;施药9 d后,其相对丰度有所下降;施药后18 d,其相对丰度增加,感病组织变形菌门和厚壁菌门的相对丰度显著高于健康组织。细菌属水平优势菌属包括假单胞菌属(Pseudomonas)、甲基杆菌属(Methylobacterium)、鞘氨醇单胞菌属(Sphingomonas)、金刚藻属(Aureimonas)、泛菌属(Pantoea)、根瘤菌科未知属(unidentified_Rhizobiaceae)、沙雷氏菌属(Serratia)、肠杆菌科未知属(unidentified_Enterobacteriaceae)、马赛菌属(Massilia)、微杆菌属(Microbacterium)。施药后18 d,假单胞菌属、甲基杆菌属、鞘氨醇单胞菌属、金刚藻属和泛菌属的相对丰度均有所提高,并达到最大值,同期感病组织中其相对丰度高于健康组织。
2.2.4 烟叶叶际微生物群落结构组成
由表4可知,健康组织与感病组织测序覆盖度均达到90%以上,表明本测序结果涵盖了绝大部分叶际微生物,可以真实、合理地反映叶际真菌和细菌的多样性和丰富度。真菌α多样性指数表明,施药前,健康组织(QJDK1)叶际真菌多样性指数(香农指数和辛普森指数)和丰富度指数(Chao1指数和ACE指数)均高于感病组织(QBDK1),但组间无显著性差异。施药后1 d,健康组织(QJDK2)多樣性指数达到最高值;施药后3 d,感病组织(QBDK3)多样性指数和丰富度指数在组内达到最高值,健康组织(QJDK3)的多样性指数有所下降;施药后9 d,健康组织(QJDK4)多样性指数有所上升;施药后18 d,健康组织(QJDK5)多样性指数趋于平缓。
细菌α多样性指数表明,施药前健康组织(QJDK1)与感病组织(QBDK1)叶际细菌多样性指数和丰富度指数均最低,且感病组织多样性指数与丰富度指数高于健康组织,但组间无显著性差异。采用多抗霉素进行处理后,叶际细菌多样性指数与丰富度指数开始提高,健康组织与感病组织的多样性指数与丰富度指数均在施药后18 d明显增加,且与其余不同施药时间存在显著差异。
2.2.5 健康与感病组织叶际微生物的互作关系
选取叶际优势真菌与细菌属水平top50并对其进行相关性分析,结果(图4)表明,健康组织叶际真菌属间关联性大于感病组织,其绝大部分真菌属之间呈正相关。亡革菌属与其他菌属之间大多呈现负相关,其中健康组织中亡革菌属与茎点霉属(Phoma)、链格孢属和枝孢属之间均呈负相关;感病组织中亡革菌属与Sampaiozyma、汉纳酵母属、Papiliotrema、Vishniacozyma、Boeremia、枝孢属和链格孢属之间均呈负相关。
健康组织细菌属之间相关性大于感病组织,多数细菌属之间同样呈正相关,少数细菌属呈负相关。健康组织中甲基杆菌属与寡养单胞菌属(Stenotrophomonas)和阿克曼菌属(Akkermansia)、短波单胞菌属(Brevundimonas)与劳尔氏菌属、假单胞菌属与布劳特氏菌属(Blautia)、马赛菌属与鞘氨醇单胞菌属之间呈负相关,其余菌属均呈正相关;感病组织中假单胞菌属与金刚藻属、劳尔氏菌属与马赛菌属、甲基杆菌属与沙雷氏菌属之间呈负相关,其余菌属均呈正相关。
3 结论与讨论
本研究探索了多抗霉素对烟草靶斑病的田间防效,在施用多抗霉素后3、9 d,田间相对防效均达到80%以上,表明药剂作用迅速、病斑增长速率显著降低,病情指数得到有效控制,防治效果稳定。表明多抗霉素能快速且稳定地抑制烟草靶斑病的发生,可以广泛应用至田间防控技术上。
叶部病害的发生常伴随着多种病原菌的作用,叶际微生物复杂多样,相互之间关联紧密[34]。本研究发现,施用多抗霉素对烟草靶斑病进行防治后3 d,其烟草靶斑病病原菌立枯丝核菌的相对丰度达到最低值,表明多抗霉素能在短时间内达到较好防效。感烟草靶斑病烟叶的叶际优势真菌属为亡革菌属、Symmetrospora和毛霉属等,优势细菌属为假单胞菌属、甲基杆菌属和鞘氨醇单孢菌属等,这一结果与前人对烟草靶斑病叶际微生物多样性的研究结果[35]基本相同,其叶际微生物之间存在动态平衡。烟草靶斑病叶际除存在亡革菌属外,还同时存在链格孢属、假单胞菌属、泛菌属等微生物。施用
多抗霉素对烟草靶斑病进行防控后1、3、9、18 d,其叶际优势真菌属亡革菌属的相对丰度基本呈先下降再上升的趋势,而Symmetrospora、毛霉属、小不整球壳属和链格孢属的相对丰度则略有增加;在优势细菌属中,假单胞菌属、泛菌属、鞘氨醇单孢菌属、金刚藻属和沙雷氏菌属的相对丰度基本呈现先上升再下降的趋势,甲基杆菌属的相对丰度则是持续变化,但总体呈上升趋势。韩永琴对辣椒根际微生物进行研究,结果同样显示,化学药剂的施用会导致根际微生物发生变化[36]。刘亭亭等在波尔多液对烟草赤星病叶际微生物物群落结构与代谢功能的影响研究中发现,施药后其叶际真菌群落的多样性显著增加[37];且波尔多液不仅作用于烟草赤星病病原菌链格孢属,同样作用于鞘脂单胞菌属、Kosakonia等有益菌群[36-37]。本研究结果同样显示,用多抗霉素防治烟草靶斑病时,不仅有效作用于立枯丝核菌,同样作用于尾孢属、枝孢属、甲基杆菌属等叶际真菌和细菌,影响微生物菌群变化。
本研究结果显示,在烟叶健康组织与感病组织中,亡革菌属与链格孢属、枝孢属之间均呈负相关。Sun等的研究结果显示,施用嘧菌酯防治烟草靶斑病后,其叶际微生物发生变化,亡革菌属与镰刀菌属、小不整球壳属之间呈负相关,其关联性表现无共性,可能是由于不同菌属之间存在竞争或共生关系,药施后导致某些菌群的相对丰度下降,增长速率得到显著控制,非靶标菌群相对丰度则上升[38]。不同菌属之间同样存在对于环境中营养物质与生长空间的竞争关系,导致施用化学药剂进行病害防治时,可能刺激某些非靶标菌群的相对丰度提高,不同菌属之间增长趋势存在差异,而药剂的施用加大了菌属之间动态平衡的变化,而此种变化或许有利于植物代谢活动的增强,对病原菌的侵染抵抗力增强,进而影响药剂对于植物病害的防控效率[39]。目前,在施用化学药剂防控植物病害时,其叶际微生物的变化规律还需要进一步探索总结,了解其间微生态的变化规律有益于为病害防控以及化学药剂的施用提供参考依据。
参考文献:
[1]Bacharis C,Gouziotis A,Kalogeropoulou P,et al. Characterization of Rhizoctonia spp. isolates associated with damping-off disease in cotton and tobacco seedlings in greece[J]. Plant Disease,2010,94(11):1314-1322.
[2]Costa A S. Mancha aureolada erequeima do fumo causades por Corticium solani[J]. Biologicol,1948,14:113-114.
[3]吴元华,王左斌,刘志恒,等. 我国烟草新病害——靶斑病[J]. 中国烟草学报,2006(6):22,51.
[4]吴元华,赵艳琴,赵秀香,等. 烟草靶斑病原鉴定及生物学特性研究[J]. 沈阳农业大学学报,2012,43(5):521-527.
[5]李再明,杨学红,王庙昌,等. 9种防治烟草靶斑病的药剂筛选试验[J]. 云南农业科技,2022(2):13-15.
[6]孙美丽,汪汉成,郭沫言,等. 4种杀菌剂对烟草靶斑病菌的抑菌活性[J]. 贵州农业科学,2022,50(9):62-68.
[7]王左斌,吴元华,赵秀香,等. “嘧肽菌净”对烟草靶斑病的抑菌作用及田间药效试验[J]. 烟草科技,2007(9):61-64.
[8]周建全,张忠光,董 雪,等. 不同药剂对烟草靶斑病的抑菌作用及田间药效研究[J]. 安徽农业科学,2015,43(25):96-97,99.
[9]马 欣,寇宝石,李继博,等. 新农药8%井冈霉素可溶液剂对烟草靶斑病的防治效果[J]. 安徽农业科学,2022,50(11):133-134.
[10]吴家全,李军民. 多抗霉素研究现状与市场前景[J]. 农药科学与管理,2010,31(11):21-23.
[11]Hori M,Eguchi J,Kakiki K,et al. Studies on the mode of action of polyoxins. Ⅵ. Effect of polyoxin B on chitin synthesis in polyoxin-sensitive and resistant strains of Alternaria kikuchiana[J]. The Journal of antibiotics,1974,27(4):260-266.
[12]Nobuya O,Kazuo K,Tomomasa M. Studies on the mode of action of polyoxin D[J]. Agricultural and Biological Chemistry,2014,34(8):1224-1234.
[13]吳 祥,吉沐祥,郭玉人,等. 多抗霉素与丁子香酚混配对草莓灰霉病的防治效果[J]. 江苏农业科学,2017,45(22):94-97.
[14]康萍芝,杜玉宁,白小军,等. 不同化学杀菌剂与多抗霉素混配对压砂西瓜炭疽病的联合生物活性及田间防效[J]. 农药,2021,60(1):70-73.
[15]韩 磊,杨超然,樊 荣,等. 几种杀菌剂对白菜霜霉病的防治效果[J]. 农药,2019,58(12):915-917.
[16]张海宽,周 斌. 春雷霉素、多抗霉素防治番茄灰霉病田间药效试验[J]. 农药科学与管理,2010,31(5):48-49.
[17]陶树春,贾秀芬,李锦龙,等. 多抗霉素等6种生物农药对温室黄瓜白粉病的防治效果[J]. 农业科技与信息,2007(10):19.
[18]赵 纲,刘保安. 多抗霉素防治烟草赤星病的效果[J]. 烟草科技,1983(4):30-33.
[19]连 海,申昌优,钟善良,等. 赣州烟区烟草赤星病防治药剂筛选[J]. 安徽农业科学,2020,48(22):148-149,165.
[20]Wang R,Zhang H C,Sun L G,et al. Microbial community composition is related to soil biological and chemical properties and bacterial wilt outbreak[J]. Scientific Reports,2017,7:343.
[21]Yang H W,Li J,Xiao Y H,et al. An integrated insight into the relationship between soil microbial community and tobacco bacterial wilt disease[J]. Frontiers in Microbiology,2017,8:2179.
[22]Dai Y F,Wu X M,Wang H C,et al. Spatio-gemporal variation in the phyllospheric microbial biodiversity of Alternaria alternata-infected tobacco foliage[J]. Front Microbiol 2022,13:920109.
[23]刘亭亭,曾陨涛,汪汉成,等. 赤星病发生期不同成熟度烟叶叶际微生物代谢与群落结构[J]. 中国烟草科学,202 2(6):22-29.
[24]Sun M L,Shi C H,Huang Y,et al. Effect of disease severity on the structure and diversity of the phyllosphere microbial community in tobacco[J]. Frontiers in Microbiology,2023,4(13):1081576.
[25]刁春玲,刘 芳,宋宝安. 农用杀菌剂作用机理的研究进展[J]. 农药,2006(6):374-377.
[26]Huang Y,Wang H C,Cai L T,et al. Phyllospheric microbial composition and diversity of the tobacco leaves infected by Didymella segeticola[J]. Frontiers in Microbiology,2021,12:699699.
[27]向立刚,汪汉成,郑 苹,等. 一种未知真菌性叶斑病发病烟叶真菌群落分析[J]. 中国烟草科学,202 2(1):40-46.
[28]刘天波,滕 凯,周向平,等. 拮抗菌群对烟草野火病的防治效果及叶际微生物群落多样性的影响[J]. 微生物学通报,202 8(8):2643-2652.
[29]劉 畅,汪汉成,谢红炼,等. 感赤星病烟叶的真菌群落结构分析[J]. 贵州农业科学,2019,47(7):54-59.
[30]刘 畅,汪汉成,谢红炼,等. 感染赤星病烟草叶际细菌的多样性分析[J]. 烟草科技,2020,53(2):8-14.
[31]谭舒心. 蜘蛛兰褐斑病及其病原菌鉴定与病害的药剂控制试验[D]. 重庆:西南大学,2009.
[32]刘斯泓,纪明山. 防治烟草靶斑病的复配药剂配方筛选及田间药效试验[J]. 江苏农业科学,2014,42(6):140-143.
[33]Haas B J,Gevers D,Earl A M,et al. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J]. Genome Res 2011,21(3):494-504.
[34]刁春玲,刘 芳,宋宝安. 农用杀菌剂作用机理的研究进展[J]. 农药,2006(6):374-377.
[35]孙美丽,史彩华,肖本青,等. 烟草靶斑病叶际微生物群落结构与多样性分析[J]. 烟草科技,2023,56(4):1-9.
[36]韩永琴. 多黏类菌剂和化学药剂对辣椒疫病的防效及对根际微生物的影响[D]. 长沙:湖南农业大学,2019.
[37]刘亭亭,汪汉成,孙美丽,等. 波尔多液对烟草叶际微生物群落结构与代谢功能的影响[J]. 农药学学报,2022,24(6):1446-1455.
[38]Sun M L,Wang H C,Shi C H,et al. Effect of azoxystrobin on tobacco leaf microbial composition and diversity[J]. Frontiers in Plant Science,2023,13:1101039.
[39]Zeng Y T,Xiong T,Bai Z Q,et al. Establishment of the sensitivity baseline of Diaporthe citri population to azoxystrobin (in Chinese)[J]. Plant Protection,2022,48(4):138-142.

