C反应蛋白联合血小板淋巴细胞比值预测动静脉内瘘失功的价值
王涛,陈欢,何朝霞,程悦,魏萌,任亚伟,龙洁
(1.西部战区总医院肾脏风湿免疫科,四川 成都 611730;2.西安市红会医院肾脏内科,陕西 西安 710000)
全球慢性肾脏病(chronic kidney disease,CKD)的患病率约为13.4%[1],有研究[2]显示,我国成年人CKD患病率已从2012年的10.8%[3]升高至2022年的13.1%。随着终末期肾脏病(end-stage renal disease,ESRD)患者的增加及血液净化治疗技术水平的提升,我国的维持性血液透析(maintenance hemodialysis,MHD)患者数量迅速增加[4]。动静脉内瘘(arteriovenous fistula,AVF)是改善肾脏病预后组织推荐的首选透析血管通路[5]。若出现AVF失功,将严重影响患者的生存质量并加重医疗负担,所以早期预测AVF失功风险,及时预防性处理至关重要。AVF失功与很多因素相关,如年龄、肥胖、合并症、钙磷代谢紊乱、炎症反应等[6-8]。目前临床评估AVF失功有物理检查、彩色多普勒超声及通路血流量监测等方法[9],但发现异常时,MHD患者多已出现AVF狭窄或失功。有研究[10-11]通过建立不同的临床预测模型来评估AVF的预后,但均有一定的局限性,尚未用于临床实践。因此,目前尚无早期预测AVF失功的确切有效手段。
MHD患者的慢性炎症状态与AVF失功及高死亡率密切相关[12]。越来越多的研究[13-14]表明,C反应蛋白(c-reactive protein,CRP)不仅是炎症的生物学标志物,且与动脉粥样硬化和静脉血栓形成密切相关;此外还可作为AVF失功的预测因子。血小板淋巴细胞比值(platelet-lymphocyte ratio,PLR)是简单实用的指标,可反映机体的慢性炎症状态,为AVF失功提供了额外的临床信息[14]。目前国外研究CRP、PLR与慢性炎症的关系及单独评估AVF的价值较多,而国内相关研究较少。本研究旨在探讨CRP联合PLR预测AVF失功的价值。
1 资料与方法
1.1 一般资料
选取2020年1月至2022年11月西部战区总医院收治的113例AVF功能障碍行手术治疗的MHD患者为失功组;同期121例正常透析的患者为对照组。本研究经西部战区总医院医学伦理委员会批准,患者及家属均签署知情同意书。纳入标准:(1)AVF失功需要满足以下3条中的1条[9]:①体格检查发现触诊未能触及震颤,听诊血管杂音较弱或无;②透析时的实际血流量<200 mL/min;③超声检查发现可能存在血管内膜增生增厚或血栓形成等。(2)前臂查体可轻易触诊震颤。(3)至少满足血流量>300 mL/min的4 h血液透析治疗。排除标准:(1)既往有重复AVF功能障碍介入治疗史;(2)实验室数据不充分;(3)其他:中心静脉狭窄或血栓形成、任何血液病、易栓症、感染、恶性肿瘤、血管炎、近期大出血史、饮酒史等;(4)年龄<18岁的未成年患者,或>80岁的超高龄患者。
1.2 方法
收集失功组及对照组的人口学信息(性别、年龄、身高、体质量指数)及临床特征(是否合并高血压、糖尿病、冠心病、是否吸烟);采集对照组AVF正常使用1个月内和失功组术前1天的实验室检查指标(血红蛋白、红细胞压积、白细胞计数、中性粒细胞计数、淋巴细胞计数、血小板计数、CRP、高密度脂蛋白、低密度脂蛋白)。PLR=血小板计数/淋巴细胞计数。根据ROC曲线得到最佳临界值PLR为180、CRP为8.18 mg/L,将患者按PLR <90、90~180、181~270、>270分为4组,危险度各计1、2、3、4分;按CRP <4.09、4.09~8.18、8.19~12.27、>12.27(mg/L)分为4组,危险度各计1、2、3、4分,每个患者计算出对应的危险度积分,绘制危险度积分与AVF失功的ROC曲线为PLR联合CRP预测AVF失功的ROC曲线。
1.3 观察指标
(1)患者人口学信息及临床特征;(2)患者的实验室检查指标;(3)影响AVF失功的因素;(4)CRP、PLR、CRP+PLR对AVF失功的预测效能。
1.4 统计学分析
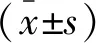
2 结果
2.1 两组患者人口学信息及临床特征比较
两组患者年龄、是否合并糖尿病比较,差异有统计学意义(P<0.05)。其余一般资料比较,差异无统计学意义(P>0.05)。见表1。
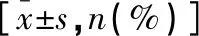
表1 两组患者人口学信息及临床特征比较
2.2 两组患者实验室检查指标比较
两组患者淋巴细胞计数、PLR、CRP差异有统计学意义(P<0.05);其余指标差异无统计学差异(P>0.05)。见表2。
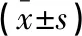
表2 两组患者实验室检查指标比较
2.3 影响AVF失功的因素
因淋巴细胞计数与PLR密切相关,未纳入分析。回归分析结果显示,合并糖尿病、高CRP、高PLR是导致AVF失功的独立危险因素(P<0.05)。见表3。
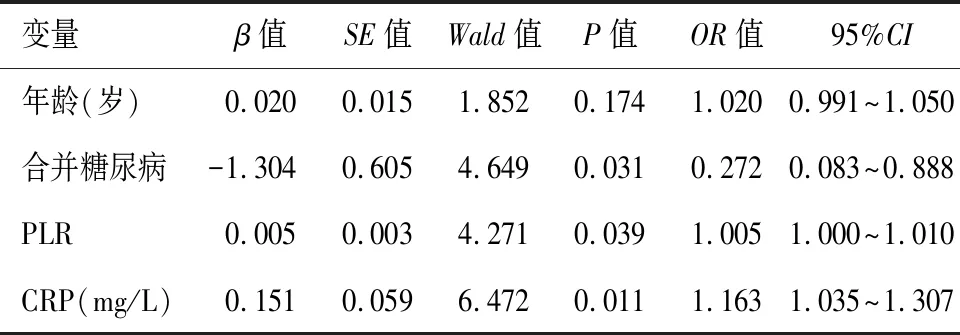
表3 影响AVF失功的因素
2.4 CRP、PLR及CRP+PLR对AVF失功的预测效能
ROC曲线分析结果显示,CRP、PLR对AVF失功均有预测价值,联合预测曲线下面积(AUC)为0.703,预测价值更高(P<0.05)。见表4、图1及图2。
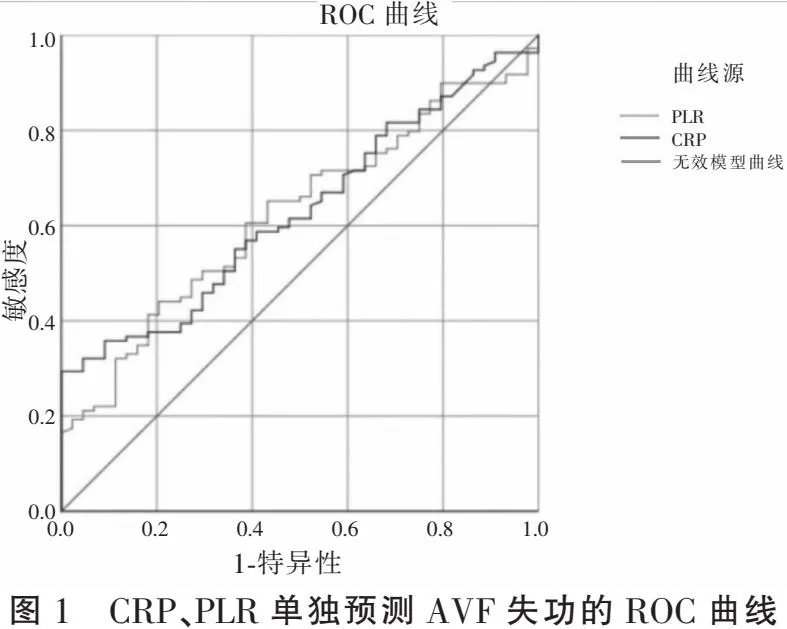

表4 CRP、PLR及CRP+PLR对AVF失功的预测效能
3 讨论
目前已明确年龄和糖尿病是血管病变的传统危险因素,研究[15]表明,年龄>60岁、合并糖尿病等是血管通路感染和功能障碍的独立危险因素。随着年龄的增加,血管逐渐老化,合并症(例如周围血管病变、高血压、糖尿病等)的发生率也逐渐增高,进而增加AVF失功的风险;此外,还有研究[16]显示,糖尿病患者的AVF 24个月通畅率明显小于非糖尿病患者。但并没有指南建议年龄大于多少是AVF的手术禁忌,因为经过严格的术前评估,年龄在AVF的成熟、通畅率、并发症或干预措施方面的差异可以最小化。
CRP是高度保守蛋白,由5个相同的原蛋白组成,排列成五聚体结构,称为五聚体CRP[17]。在某些因素刺激下CRP的五聚体结构松弛,例如酸性环境、高温、尿素或与错误折叠的蛋白质结合等[18]。五聚体CRP可解离为单体CRP,其具有高度促炎特性,通过直接激活血小板和触发经典补体途径,在动脉粥样硬化和静脉血栓行成的过程中发挥着显著的生物学效应[19]。而MHD患者长期处于代谢性酸中毒、高尿素氮状态,使体内CRP出现解离,放大体内的炎症反应,进一步促进动脉粥样硬化和静脉血栓过程,这可能是高CRP的患者AVF失功风险更高的原因。本研究结果显示,CRP对AVF失功有一定的预测价值(AUC=0.623,P<0.05),如患者出现CRP升高,特别是>8.18 mg/L时需引起重视,与Stirbu等[20]的结论类似。
炎症介质的释放可能促进血小板计数增加[21],反复的针刺使AVF的血管壁受损,血管内高浓度的血小板则附着在受损的血管壁上,导致血小板依赖性血栓形成[22]。此外血小板通过与内皮细胞接触并诱导细胞因子分泌,在促血栓形成和促炎症事件中发挥重要作用[23],而较低的淋巴细胞数量也与炎症的发病机制相关[24]。研究[25-26]显示,PLR在多种疾病状态下可用于评估机体的炎症状态的,因此我们认为PLR也可作为AVF失功的炎症标记物。一项来自罗马尼亚的单中心回顾性研究[27]显示PLR是AVF成熟失败、早期血栓形成和成熟后功能障碍的独立预测因子。本研究结果显示,高PLR的患者出现AVF失功的风险更高(P<0.05),且对AVF失功有一定的预测价值(AUC=0.629,P<0.05);CRP联合PLR时预测价值更高(AUC= 0.703,P<0.05)。CRP与PLR是临床中容易获得的检验指标,也是可以动态复查的炎症标志物,两者联合使用增加了早期识别AVF失功风险的机会。当患者出现CRP、PLR同时升高时,AVF失功的风险大大增加,建议通过适量运动、膳食补充(如膳食纤维、益生菌、深海鱼油)等降低机体炎症级别,并适当增加复查频率,借以早发现、早诊断、早处理。
综上,CRP、PLR水平升高的患者AVF失功风险增大,是AVF失功的独立危险因素;CRP、PLR均可用于AVF失功的预测,且联合两者使用时预测效能更高,为早期识别AVF功能障碍提供线索,具有很好的实用性和经济性。

