NLR、PCT、IL-6、CRP、SAA 联合检测对不同病原菌血流感染的诊断价值
李艳红 李珍宇 梁世炫 殷爱顺 阳颖
危重症患者并发血流感染(blood stream infection,BSI)将增加患者死亡率,相关数据[1]调查显示,全球BSI 死亡率达12.89%。BSI 各主要致病菌死亡率不同[2],均会对患者生命健康造成影响,因此诊断不同病原菌BSI 具有重要意义。传统降钙素原(procalcitonin,PCT)、C-反应蛋白(C-reactionprotein,CRP)、白介素-6(Interleukin-6,IL-6)检测已被广泛应用于BSI 辅助诊断,虽具有一定诊断价值但易存在漏诊、误诊情况。中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、淀粉样蛋白A(serum amyloid A,SAA)是近年来的研究热点,前者为诊断脓毒症、感染及炎症的敏感指标[3],后者可作为反映机体炎症及感染情况的指标[4]。相关研究[5]表明,采用单项指标对BSI 进辅助诊断时易受取值范围的影响,单一指标敏感度与特异度均未达理想水平,导致诊断价值不高。本研究将探究NLR、PCT、IL-6、CRP、SAA 联合检测对不同病原菌血流感染的诊断价值,具体如下。
1 资料与方法
1.1 一般资料
选取2021 年5 月至2023 年5 月于东莞市清溪医院收治的200 例血流感染患者。纳入标准:①患者年满18 周岁;②血培养阳性,且为单一菌株感染;③临床资料满足研究需求。排除标准:①合并有自身免疫性疾病者;②合并有血液肿瘤性疾病者;③长期使用免疫抑制剂类或激素类药物者;④合并血流感染以外的其他部位感染者。200 例患者中男117 例、女83 例;年龄平均(53.56±14.66)岁,高血压31 例、糖尿病22 例、慢性肾功能不全7 例、冠心病15 例。研究经本院伦理委员会审核通过。患者对研究知情并签署同意书。
1.2 方法
1.2.1 设备与器械
法国生物梅里埃BacT/ALERT 3D 全自动细菌/分枝杆菌培养监测系统、VITEK2-compact 全自动微生物分析系统、赛默飞世尔Thermo KS II 级生物安全柜、日本三洋CO2温箱、诺唯赞QD-S1200 全自动量子点荧光免疫分析仪、迈瑞6700 全自动血细胞分析仪、i-Readers 干式免疫分析仪。
1.2.2 样本采集
所有研究对象血标本采集时间为使用抗生素前。血培养病原菌采集根据标准严格进行无菌操作,采集患者厌氧血培养瓶与需氧血培养瓶各8~10 mL 血量;PCT、IL-6、SAA 使用干燥管采集2~3 mL 血量;CRP、NLR 使用含EDTA-K2 抗凝剂管采集2~3 mL 血量。血培养与NLR、PCT、IL-6、CRP 采集血样间隔时间≤12 h。
1.2.3 检测方法
血培养病原菌检测及病原菌分型检测严格参照WS/T503-2017《临床微生物实验室血培养操作规范》[6]操作并根据不同病原菌类型进行分组。
NLR、PCT、IL-6、CRP、SAA 水平检测:采用免疫层析法(i-Readers 干式免疫分析仪)检测PCT、CRP;采用量子点荧光免疫法(诺唯赞QD-S1200 全自动量子点荧光免疫分析仪)IL6、SAA。采用迈瑞6700 全自动血细胞分析仪检测淋巴细胞与中性粒细胞,NLR 为淋巴细胞、中性粒细胞数值之比,检测试剂、仪器操作严格按照说明书进行。
1.3 统计学方法
采用SPSS 28.0 统计软件进行数据统计与分析,计量资料采用()描述,两组间比较采用t检验,多组间比较采用方差分析。采用受试者工作特征(ROC)曲线分析上述指标及联合对于不同病原菌BSI的诊断价值。以P<0.05表示差异有统计学意义。
2 结果
2.1 200 例患者的病原菌检测结果分析
200 例阳性患者中革兰阳性菌92 例(46.00%),革兰阴性菌101 例(50.50%),真菌7 例(3.50%)。
2.2 不同菌属的血流感染患者NLR、PCT、IL-6、CRP、SAA 水平比较
200 例患者中92 例革兰阳性菌感染、101 例革兰阴性菌感染患者、7 例真菌感染分别纳入革兰阳性菌组、革兰阴性菌组、真菌组;三组NLR 比较差异无统计学意义(P>0.05)。PCT、IL-6、CRP、SAA 水平比较差异有统计学意义(P<0.05)。真菌组的PCT、IL-6、CRP、SAA 水平低于革兰阳性菌组与革兰阴性菌组;革兰阴性菌组的PCT、IL-6、CRP 水平高于革兰阳性菌组,SAA 水平低于革兰阳性菌组,差异均有统计学意义(P<0.05)。见表1。
表1 三组NLR、PCT、IL-6、CRP、SAA 水平比较()Table 1 Comparison of NLR,PCT,IL-6,CRP and SAA levels among the three groups()

表1 三组NLR、PCT、IL-6、CRP、SAA 水平比较()Table 1 Comparison of NLR,PCT,IL-6,CRP and SAA levels among the three groups()
注:与革兰阳性菌组比较,aP<0.05;与革兰阴性菌组比较,bP<0.05。
2.3 NLR、PCT、IL-6、CRP、SAA 及联合对于不同病原菌BSI 的诊断效能
2.3.1 NLR、PCT、IL-6、CRP、SAA 及联合对于革兰阳性菌BSI 的诊断效能
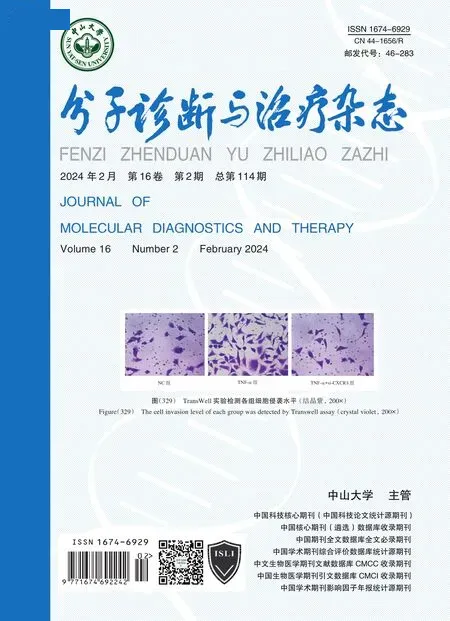
NLR、PCT、IL-6、CRP、SAA 对革兰阳性菌BSI进行诊断时,以SAA 的曲线下面积值(AUC)值最高,为0.997,敏感度、特异度分别为0.978、1.000,联合后的AUC 值为0.998,与单一SAA 诊断的AUC 比较差异无统计学意义(Z=0.715、P=0.475),见表2、图1。
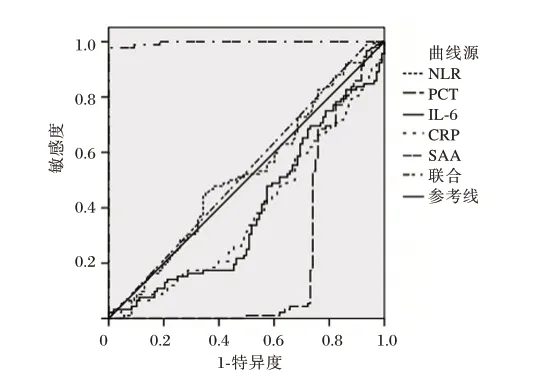
图1 NLR、PCT、IL-6、CRP、SAA 及联合诊断革兰阳性菌BSI 的ROC 曲线Figure 1 ROC curves of NLR,PCT,IL-6,CRP,SAA,and their combination for diagnosing early BSI caused by Gram-positive bacteria

表2 NLR、PCT、IL-6、CRP、SAA 及联合对于革兰阳性菌BSI 的诊断效能Table 2 Diagnostic performance of NLR,PCT,IL-6,CRP,SAA,and their combination for early BSI caused by Gram-positive bacteria
2.3.2 NLR、PCT、2.4.3 IL-6、CRP、SAA 及联合对革兰阴性菌BSI 的诊断效能
NLR、PCT、IL-6、CRP、SAA 对革兰阴性菌BSI进行诊断时,以SAA 的AUC 值最高,为0.927,敏感度、特异度分别为1.000、0.909,联合后的AUC值为0.969,与SAA 的AUC 比较差异无统计学意义(Z=1.981、P=0.147)。见表3、图2。
图2 NLR、PCT、IL-6、CRP、SAA 及联合诊断革兰阴性菌BSI 的ROC 曲线Figure 2 ROC curves of NLR,PCT,IL-6,CRP,SAA,and their combination for diagnosing early BSI caused by Gram-negative bacteria
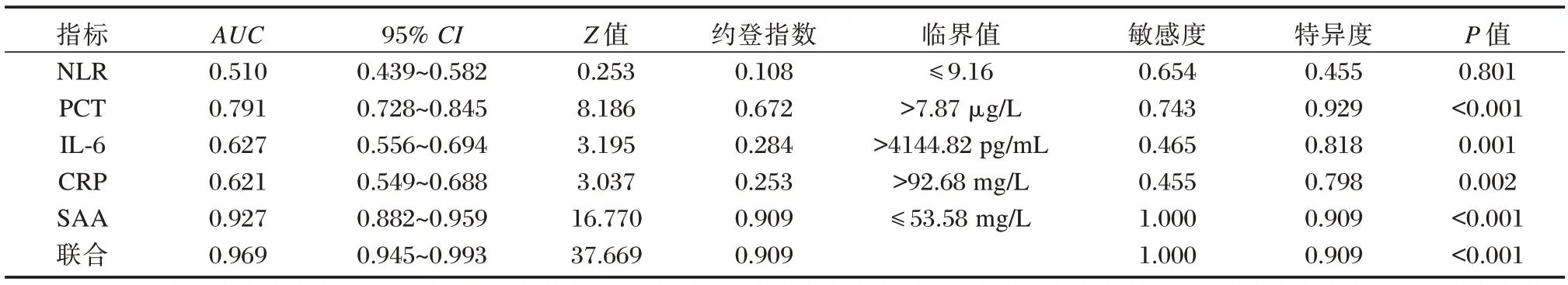
表3 NLR、PCT、IL-6、CRP、SAA 及联合对革兰阴性菌BSI 的诊断效能Table 3 Diagnostic performance of NLR,PCT,IL-6,CRP,SAA,and their combination for early BSI caused by Gram-negative bacteria
2.3.3 NLR、PCT、IL-6、CRP、SAA 及联合对真菌BSI 的诊断效能
NLR、PCT、IL-6、CRP、SAA 对真菌BSI 进行诊断时,以SAA 的AUC 值最高,为0.991,敏感度、特异度分别为1.000、0.974,联合后的AUC 值为1.000,与SAA 单一诊断的AUC 差异无统计学意义(Z=1.408、P=0.159)。见表4、图3。

图3 NLR、PCT、IL-6、CRP、SAA 及联合诊断真菌BSI 的ROC 曲线Figure 3 ROC curves of NLR,PCT,IL-6,CRP,SAA,and their combination for diagnosing early BSI caused by fungi
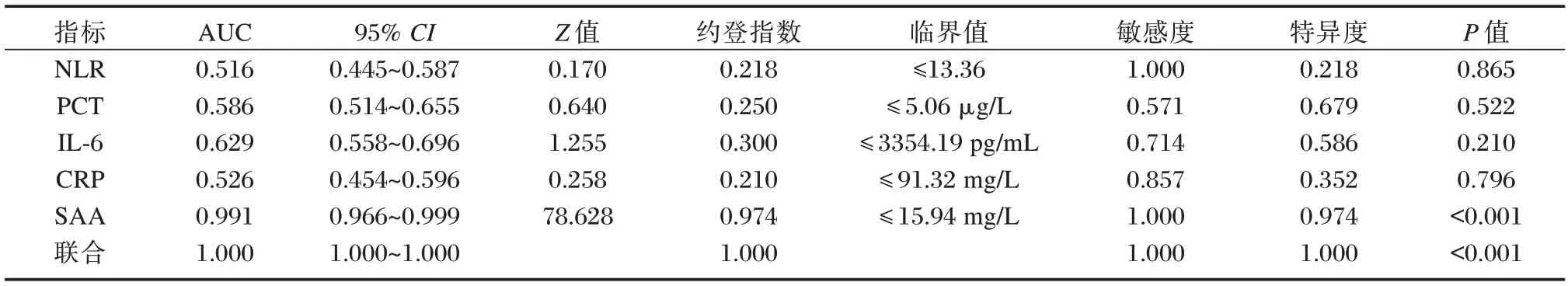
表4 NLR、PCT、IL-6、CRP、SAA 及联合对真菌BSI 的诊断效能Table 4 Diagnostic performance of NLR,PCT,IL-6,CRP,SAA,and their combination for early BSI caused by fungi
3 讨论
血培养检出病原菌仍为临床诊断BSI 的金标准[7],但由于抗菌药物的广泛使用,血培养结果假阴性高,导致病原菌检出率大幅降低[8]。目前未有单独一项炎症因子能快速识别BSI,为准确预判BSI,探究一套最优的联合检测方案对于提升临床诊断效率具有重要意义。
本文结果显示,PCT、IL-6、CRP、SAA 指标或可作为鉴别BSI 患者菌属的血清标志物,分析与不同病原菌产生的毒素不同相关。当细菌感染发生时,PCT、CRP 水平迅速升高,IL-6 水平可在2 h 内达到高峰[9-11]。相关研究[12-13]表明,NLR 在急性胰腺炎、结直肠癌等疾病中具备较高的预测价值。本研究中,革兰阳性菌组与真菌组的PCT 水平显著低于革兰阴性菌组,分析其原因可能为:革兰阴性菌细胞壁中的脂多糖可对炎症因子造成刺激,促进TmRNA 的表达及蛋白翻译,进而诱导大量炎症因子的产生[14]。革兰阳性菌与真菌虽可对IL-6、CRP 等细胞因子造成刺激,促进单核细胞、神经内分泌细胞、巨噬细胞产生PCT,但其作用效果弱于脂多糖,因此PCT 升高水平低于革兰阴性菌,感染革兰阴性菌患者的PCT 水平更高。革兰阴性菌产生的内毒素具备较强的炎症刺激作用,对机体造成的损伤更加严重[15]。但有研究表明,系统性炎症反应综合征、神经内分泌肿瘤等疾病同样可对机体造成刺激,产生细胞因子,进而导致PCT 水平升高,出现PCT 假阳性,因此临床应结合患者具体情况进行分析。正常情况SAA 在人体中的水平极低,但当机体被病原菌感染,产生炎症反应时SAA水平快速上升。本研究中,三组SAA 水平比较差异有统计学意义。本研究中,三组NLR 比较差异无统计学意义,与车辉娟等[16]的研究结果存在一定差异,后续将通过前瞻性大样本研究多结果做进一步分析。
本研究ROC 曲线分析结果提示单一SAA 即可有效诊断、鉴别革兰阳性菌BSI。进一步ROC 曲线分析显示,单一PCT、IL-6、CRP、SAA 均可发挥一定诊断效能,但单一应用时仍以SAA 效能最佳,以≤53.58 mg/L 为临界值,其诊断革兰阴性菌BSI的敏感度、特异度分别为1.000、0.909,提示单一SAA 同样可有效鉴别革兰阴性菌BSI。单一血清指标诊断时以SAA 的AUC 值最高,与联合诊断的AUC 值比较差异无统计学意义。由此可见,PCT、IL-6、CRP、SAA 均可用于诊断不同病原菌BSI,笔者认为,在临床实践可考虑SAA 的诊断鉴别优势,以减轻患者医疗负担,避免造成医疗资源浪费。
综上所述,不同病原菌BSI 患者PCT、IL-6、CRP、SAA 存在差异,上述指标均可作为诊断鉴别指标,其中SAA 的诊断鉴别效能相对最佳。