自建微流控-芯片法检测布鲁氏菌的性能验证及评价
董占柱 陈昊 孙欣 包春喜 李英智 牛艺卿 李翔 郝明媛 杜彦丹★
布鲁氏菌病(Brucellosis,(简称布病))是由细胞内寄生的布鲁氏菌(Brucella,(简称布氏菌))引起的一种人兽共患传染性疾病[1]。人感染布氏菌后,临床表现以发热、关节疼痛、乏力为主;动物感染布氏菌主要表现为流产、生殖器官病变和死胎[2-3]。目前布氏菌的主要检测方法包括血细菌分离培养鉴定(简称血培养)、血清学和分子生物学方法。血培养是布病诊断的“金标准”,但耗时长,检出率低,且存在一定的实验室获得性感染的风险[4-6]。虎红平板凝集试验(Rose-Bengal Plate Agglutination Test,RBPT))和血清试管凝集试验(Standard Tube Agglutination Test,SAT))是诊断布病的重要检测方法,但其受诸多干扰因素影响特异性不高、敏感性差,存在较大程度的假阳性概率[7-8]。荧光探针RT-PCR 存在着假阴性率较高的缺陷[9]。而微流控-芯片法(Microfluidic chip,MC)具有快速、高灵敏、高通量、低消耗,特异性好等特点[10],可弥补现有检测技术短板,该技术的临床应用将对布鲁氏菌病的诊治起到关键指导作用。
1 材料与方法
1.1 标本来源
阳性标本为内蒙古林业总医院检验科收集的经BACTEC FX 血培养仪鉴定为布氏菌阳性菌株,阴性标本为本院收集的无布氏菌疫苗接种史、RBPT 阴性及血培养布氏菌阴性健康体检者血清。用于敏感性及特异性验证的136 例血清标本收集于2021 年5 月至2022 年8 月就诊于内蒙古林业总医院、呼伦贝尔市人民医院、呼伦贝尔市传染病医院,长期生活于牧区且有发热、关节疼痛、乏力等临床症状患者。所有标本均冻存于-80℃冰箱。研究对象均鉴署临床研究知情同意书。本文已通过内蒙林业总医院伦理审查委员会审查。
1.2 仪器与试剂
核酸提取、扩增与芯片杂交采用北京博晖核酸芯片检测仪(BHF-VI),BACTEC FX 全自动细菌培养系统购自碧迪公司。布氏菌微流控-芯片检测试剂为本实验室自主构建并委托北京博晖集成为检测芯片试剂盒,企业参考品购自北京睿博兴科。
1.3 方法
自建部分内容详见李翔、董占柱等[10]发表的《微流控芯片技术在布鲁氏菌检测中的应用》。本文参照CNAS-GL039:2019《分子诊断检验程序性能验证指南》[11]、《实验室自建分子诊断项目基本要求专家共识》[12]、《布鲁菌病诊疗专家共识》[13]相关要求仅对自建微流控-芯片法检测布鲁氏菌的性能部分进行探讨。用于验证的临床标本及企业参考品等均按照自建试剂盒步骤进行操作:①将前期处理好的标本,手动使用移液器取100 μL 加入微流控-芯片加样孔,关闭仪器舱门。②运行检测程序:布氏菌DNA 核酸提取、PCR 扩增、反向斑点杂交、CCD 扫描分析实验结果、结果判定。
1.3.1 符合率验证
选取本院微生物室-80℃冻存的布氏菌血培养阳性菌株20 例进行复苏、传代,挑取单个克隆菌落,使用PBS 稀释液制成0.5 MCF 菌悬液,取100 μL菌悬液以阴性血清为基质梯度稀释至约1.50×103CFU/mL 作为待验证的阳性标本;选取本院收集的健康体检者血清20 例为待验证的阴性标本,每例标本重复检测3 次,与“金标准”血培养进行比较,计算检测结果阳性符合率、阴性符合率和总符合率;评价标准:总符合率>90%。
1.3.2 重复性验证
选取浓度分别是1.50×108CFU/mL、500 CFU/mL 的布氏菌阳性标本。每天检测1 个分析批,每分析标本检测1 次,连续检测20 天,两名检测人员应用两台核酸芯片检测仪、两个批次试剂交叉检测方式进行;评价标准:布氏菌阳性标本检出率>90%。
1.3.3 检出限验证
将包含自建试剂所检测布氏菌核酸序列的企业参考品(浓度1.00×105copies/mL)用无RNA 酶的DEPC 水梯度稀释100 倍至自建试剂盒检出限浓度1 000 copies/mL,批内重复检测20 次;评价标准:布氏菌企业参考品阳性检出率≥95%。
1.3.4 交叉反应验证
选取与布氏菌血清有交叉凝集现象的菌株及病原体:EB 病毒核酸(浓度1.00×106copies/mL),人巨细胞病毒核酸(浓度1.00×105copies/mL);肺炎链球菌标准菌株、大肠杆菌标准菌株、金黄色葡萄球菌标准菌株、肺炎克雷伯菌标准菌株、快长分枝杆菌标准菌株用PBS 稀释液制成0.5MCF 菌悬液,取100 μL菌悬液以阴性血清为基质梯度稀释至1.50×105CFU/mL,以此浓度为待验证的标本,各标本批内重复检测3 次;评价标准:布氏菌检测结果应为阴性。
1.3.5 抗干扰能力验证
结合血液标本常见内源性干扰物质及临床用药干扰情况,制成混有30%血液、0.9 mg/mL 黏蛋白、0.3 mg/mL 多西环素、3 mg/mL 链霉素、1.2 mg/mL 复方新诺明、2.25 mg/mL 环丙沙星、6 mg/mL头孢曲松、4.5 mg/L 妥布霉素、15 mg/L 庆大霉素、30 mg/L 利福平干扰物质的弱阳性(浓度500 CFU/mL)布氏菌悬液,对照组加入等量体积的生理盐水。各标本分析批内重复检测3 次,评价标准:弱阳性布氏菌标本检测结果仍为弱阳性。
1.3.6 临床敏感性及特异性验证
用微流控-芯片法对136 例血液标本进行检测,每例标本重复检测3 批次,结合临床诊断及已有文献报道数据,分析微流控-芯片法的敏感性验证及特异性可接受度。
1.4 统计学处理
采用Excel 2019 和jamovi 2.3.21 进行数据处理,计数资料采用n(%)表示。
2 结果
2.1 符合率验证
20 例阳性标本中微流控-芯片法3 次重复检测结果均阳性,20 例阴性标本3 次重复检测均阴性。阳性符合率100%,阴性符合100%,总符合率100%,满足评价标准,验证通过。见表1。
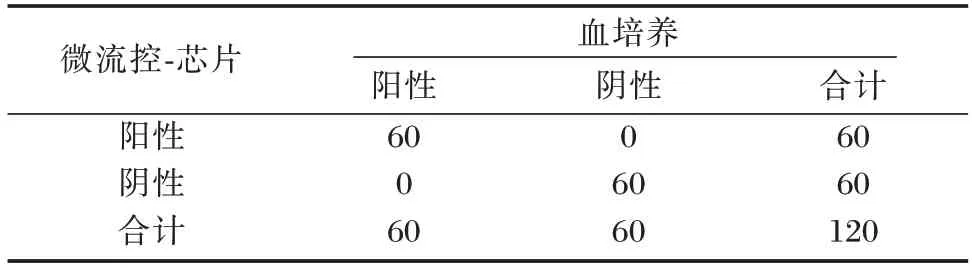
表1 符合率实验结果Table 1 Coincidence rate test results
注:阳性符合率=60/(60+0)×100%=100%;阴性符合率=60/(60+0)×100%=100%;总符合率=(60+60)/(60+0+0+60)×100%=100%
2.2 重复性验证
高、低浓度两例阳性标本20 批次重复检测结果均阳性,检出率100%,满足评价标准,验证通过。
2.3 检出限验证
1 000 copies/mL 企业参考品20 次重复检测结果均阳性,检出率100%,满足评价标准,验证通过。
2.4 交叉反应验证
用于交叉反应验证的各病原体3 次重复检测结果布氏菌核酸均阴性,与布氏菌无交反应,满足评价标准,验证通过。见表2。

表2 交叉反应实验结果Table 2 Cross-reaction test results
2.5 抗干扰能力验证
混有相应浓度干扰物质的布氏菌弱阳性标本3 次重复检测结果均阳性,满足评价标准,验证通过。见表3。

表3 抗干扰实验结果Table 3 Anti-interference ability test results
2.6 敏感性及特异性验证
结合患者临床表现及实验室检查(SAT 滴度≥1∶100++),136 例血清标本中临床诊断为布病89例;SAT 滴度<1∶100++,不排除布病47 例。89 例诊断为布病的标本微流控-芯片法3 次重复检测结果检出80 例布氏菌核酸阳性,9 例阴性。47 例SAT滴度<1∶100++的标本微流控-芯片法3 次重复检测共检出布氏菌核酸阳性2 例,阴性45 例。检测敏感性与特异性分别为89.88%和95.74%,能够满足辅助临床诊断的需求。
3 讨论
由于感染布氏菌1~2 周左右机体开始产生抗体或者抗体处于低水平,布病血清学方法在窗口期检测的阳性率不高[14],不能区分慢性和急性布病患者,而微流控-芯片核酸检测在布病早期的诊断中受窗口期期影响较小,机体感染布氏菌初期即可进行核酸检测,对于布病的及时检出、及时治疗及疫情防控具有重要意义。47 例SAT 滴度<1∶100++标本微流控-芯片法3 次重复检测中第1次检出1 例阳性;第2、3 次重复检测结果一致均检出2 例阳性且涵盖第1 次的阳性标本结果,标本中布氏菌载量处于检出限浓度附近或是标本检测前离心不彻底可能是导致该结果出现的主要原因,SAT 阴性标本中微流控-芯片法能够检出布氏菌DNA,表明其敏感性优于SAT,这与Elena Navarro等[15]人报道的分子检测技术在布氏菌感染诊断中的敏感性高于SAT 较为一致。血培养适合于布氏菌病的分离和鉴定,但该方法的敏感性较低,依赖于布氏菌的种类、疾病的阶段、培养基的类型等[16]。荧光探针RT-PCR 经过多年的发展已被用于布病原体检测和临床辅助诊断中,但用于诊断布病的商业核酸扩增检测产品仍然有限[17],而且已发表的评估商业和自制分子检测不同性能的比较研究仍然很少。
综上所述,本实验室自建微流控-芯片法在布氏菌感染检测中的符合率、重复性、检出限、抗干扰能力、交叉反应指标均满足指南及专家共识要求,敏感性及特异性与于艳妮等[18]人报道的分子检测技术在布氏菌感染诊断中的敏感性和特异性分别为95.7%和92.2%接近,推荐用于临床标本的检测。