DBU/碘化锂双催化体系催化三亚甲基碳酸酯开环均聚合
王艳 肖慧萍 马叶群


摘要:以1,8-二氮杂二环[5.4.0]十一碳-7-烯(DBU)/碘化锂(LiI)为双催化剂,苯甲醇(BnOH)协同催化单体三亚甲基碳酸酯(TMC)开环均聚合,得到产物聚三亚甲基碳酸酯(PTMC).反应的最优条件为:二氯甲烷为溶剂,[TMC]=1.0 mol·L-1, [TMC]/[DBU]/[LiI]/[BnOH]=200∶1∶1∶1,25 ℃下反应45 min,所得PTMC的产率为97.7 %,数均分子量为20.4 kg·mol-1,分子量分布为1.19.DSC热分析结果表明,PTMC没有熔融峰和结晶峰,说明PTMC为一种无定形聚合物.利用1HNMR和IR对PTMC结构进行端基分析,并推测聚合机理为 “单体-活化” 机理.
关键词:DBU;碘化锂;聚三亚甲基碳酸酯;开环聚合
中图分类号:O 632.1文献标志码:A文章编号:1001-988Ⅹ(2024)02-0071-06
Ring-opening polymerization of trimethylene carbonate catalyzed by DBU/lithium iodide dual catalytic system
WANG Yan XIAO Hui-ping ,MA Ye-qun3
Abstract:The ring-opening homopolymerization of trimethylene carbonate(TMC)catalyzed by 1,8-diazabicyclo [5.4.0] undec-7-ene(DBU)/lithium iodide (LiI) is systematically studied in coordination with benzyl alcohol(BnOH).The polytrimethylene carbonate(PTMC) is obtained.The optimum condition of the polymerization reaction was as follows: [TMC]=1.0 mol·L-1, [TMC]/[DBU]/[LiI]/[BnOH]=200∶1∶1∶1, T=25 ℃,t=45 min,and dichloromethane as solvent.The yield of PTMC can reach 97.7%.The number average molecular weight of the polymer is 20.4 kg·mol-1 and the molecular weight polydispersity is 1.19.The DSC measurement of PTMC displays no melting peak and no crystalline peak and it further shows that PTMC is an amorphous polymer.The structure of PTMC is confirmed by
1HNMR and IR techniques,and the polymerization mechanism is inferred via a “monomer-activated” process.
Key words:DBU;lithium iodide;polytrimethylene carbonate;ring-opening polymerization
生物可降解高分子材料在醫用缝合线、人造皮肤、生物可降解假体、药物输送应用和神经导引等医学领域有广泛的应用[1].脂肪族聚碳酸酯是一类重要的生物降解材料,因其具有高度的生物相容性、生物降解性、低毒性和优异的力学性能备受关注[2-5].聚三亚甲基碳酸酯(PTMC)是脂肪族聚碳酸酯中的一员,其玻璃化转变温度(-17 ℃)低于人体的生理温度,可使PTMC在体内保持良好的弹韧性,展现出PTMC在生物医学上更大的潜在应用空间.因此,人们将研究聚焦在PTMC的催化合成上,通过调控PTMC的组分、结构及分子量的大小,进而得到应用范围广、性能优异的功能性聚碳酸酯材料[6-12].
PTMC的制备通常采用金属催化剂,如Sn(Oct)2,Al(O-i-Pr)3[13]对单体三亚甲基碳酸酯(TMC)开环均聚合催化完成.这些金属催化剂能很好的控制聚合物的分子量和微观结构,但金属催化剂有一定的污染物残留,阻碍所得聚合物在医学上的应用.随着酶催化剂研发使用,合成PTMC的方法进一步多样化,由于酶催化反应时间较长而且产物PTMC分子量低(<104 g·mol-1),同样使PTMC的广泛应用受到局限[14-16].鉴于此,研究人员把具有高效、可控且催化产物分子量高的新型催化剂的利用开发作为主要研究方向.Hedrick等[17]利用有机催化剂DBU,在苯甲醇(BnOH)引发作用下进行TMC溶液均聚合,反应时间480 min,单体转化率大于99 %,产物聚合度为51,分子量分布为1.04.Robin等[18]研究1,5,7-三氮杂双环[4.4.0]癸-5-烯(TBD)在无醇的引发条件下,溶液开环聚合制备PTMC,分子量最高达34 000 g·mol-1,分子量分布为1.55,并对产物结构表征发现产物中有线性PTMC和环状PTMC同时存在.Zhu等[19]采用超强碱磷腈配体P4-叔丁基(t-BuP4)为有机催化剂,苯甲醇协同作用TMC开环聚合得到PTMC均聚物,数均分子量达5 500 g·mol-1,PDI为1.18;在PTMC反应物中加入第二种单体ε-己内酯(CL)/δ-戊内酯(VL)成功得到PTMC-b-PCL和PTMC-b-PVL嵌段共聚物.
文中结合有机催化剂及金属催化剂各自优点,将DBU/LiI二者结合,形成具有较高活性的双催化体系,能有效催化TMC发生开环聚合反应.实验以TMC作为单体,BnOH作为引发剂,协同催化TMC开环均聚合,通过对聚合条件的优化和筛选合成出PTMC,并通过GPC,NMR,DSC和IR等测试方法对PTMC进行了表征和分析,推测了可能的聚合机理.
1 实验部分
1.1 试剂与仪器
DBU,分析纯,Alfa Aesar公司;无水LiI,99.999 %,Sigma-Aldrich公司;甲苯、四氢呋喃(THF)、二氯甲烷(CH2Cl2)、苯甲醇(BnOH)、乙酸乙酯和甲醇等均为分析纯,天津光复精细化工研究所.甲苯、THF:加入钠条过夜处理,然后在钠条存在的条件下加热回流,加入少量的二苯甲酮,待溶液变蓝后常压蒸馏.BnOH:用氢化钙(CaH2)回流除水48 h.CH2Cl2:将适量CaH2加入CH2Cl2中回流除水.
Bruker AV-600 MHz超导核磁共振仪,德国Bruker公司;PL-GPC 220高温凝胶色谱仪,美国Waters公司;Varian660 IR型红外光谱仪,美国Varian公司;DSC Q200 F3差示扫描量热仪,德国Netzsch公司.
1.2 催化剂的纯化
将20 mL的DBU和适量CaH2加入100 mL的两口瓶中,氩气保护下搅拌除水48 h,之后减压蒸馏,蒸出的DBU收集在预先烘烤过的安瓿瓶中,氩气氛围密封保存备用.
1.3 TMC的纯化
湿度处于30%以下时,在1000 mL的烧杯中加入约300 g TMC和300 mL乙酸乙酯,将其置于40 ℃水浴中溶解,待完全溶解后,趁热过滤.将过滤完的溶液倒入干净烧杯中,放入冰箱,冷却析出,待完全析出后,用抽滤装置抽滤,抽滤完成后,将TMC放在滤纸上吸干,再放入干净烧杯中,并置于真空干燥箱中,37 ℃下烘24 h.烘干后收集在预先烘烤过的两口瓶中,氩气氛围密封保存备用.
1.4 PTMC的合成
将无水的LiI,TMC(用CH2Cl2配制成4 mol·L-1的溶液),CH2Cl2和BnOH,依次加入到充满氩气的20 mL聚合瓶(预先烘烤)中,加入定量的DBU,于25 ℃的水浴中振荡.利用核磁测试跟蹤,得到每一特定时间点的转化率.反应一定时间后,用甲醇终止反应,得到的聚合产物于甲醇中浸泡12 h,过滤,40 ℃真空干燥至恒重.
1.5 PTMC的表征
高温凝胶色谱仪(GPC)以THF为流动相,流速1 mL·min-1,聚苯乙烯作为标样,测定聚合物的数均相对分子量(Mn)及其相对分子量分布(PDI).傅立叶红外光谱仪(IR)将样品与溴化钾混合压片,在400~4 000 cm-1 测试扫描,测定聚合物各基团的特征吸收峰.超导核磁共振仪(NMR)以氘代氯仿为溶剂,四甲基硅烷作内标,测定聚合物的1HNMR和13CNMR.差示扫描量热仪(DSC)在氮气气氛下对聚合物进行热性能测试,测定聚合物的玻璃化转变温度和熔融温度.
2 结果与讨论
2.1 条件优化
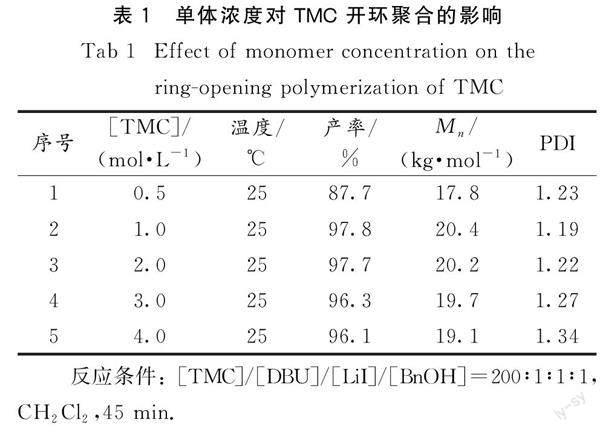
2.1.1 单体浓度对聚合反应的影响
表1为单体浓度对TMC 开环聚合反应的影响.从表中可以看出,TMC的浓度从0.5增加到1.0 mol·L-1时,TMC的转化率和Mn都有所增加.这是因为随单体浓度增加,单位体积中的单体数量增多,反应效率增加.当TMC的浓度从1.0增加到4.0 mol·L-1时,反应速率太快,活性种被包裹,单体不能有效地和活性中心接触,使得PTMC的Mn降低,且PDI变宽.由上可见,当[TMC]=1.0 mol·L-1时为聚合反应最适宜的单体浓度.
2.1.2 LiI及DBU的用量和溶剂对聚合反应的影响
LiI及DBU的用量和溶剂对聚合反应的影响见表2.首先,将聚合反应在甲苯中进行(序号7),发现TMC在甲苯中不溶解,出现明显的分层,之后将溶剂由甲苯换为THF,反应进行24 h后,转化率仅为7.98% (序号6).随后又以CH2Cl2为溶剂,反应45 min后收率高达97.7%,Mn=20.4 kg·mol-1,且PDI较窄为1.19(序号2).从表2还可看出,LiI与DBU的用量对聚合结果影响显著.当不使用LiI时,单独DBU在反应18 h后,转化率仅为5.43% (序号 1);当不使用DBU时,单独LiI也不能发生聚合反应(序号4).当[LiI]/[DBU]=1∶1时,得到的PTMC收率97.7%,Mn可达20.4 kg·mol-1,PDI =1.19.
2.1.3 催化剂用量对TMC聚合反应的影响
催化剂用量对TMC聚合反应的影响见表3.当[TMC]/[C]的比值等于200时,PTMC的Mn较高且PDI较窄,继续增大[TMC]/[C]的比值(序号 5),单位体积内催化剂的活性种减少,导致聚合速率降低,不易形成聚合物长链且Mn减小.而当[TMC]/[C]<200时(序号 1~3),反应45 min后,PDI明显变宽.这是因为单位体积内催化剂的活性种增加,从而导致聚合速率变快,副反应增多.由此可见,催化剂用量对聚合反应有较大的影响.
2.1.4 引发剂用量对TMC聚合反应的影响
引发剂用量对TMC开环聚合的影响如表4所示,当单体与引发剂的摩尔比([TMC]/[I])<200时(序号 1-3),PTMC的Mn随[M]/[I]比值的增加而增大.当[TMC]/[I]=200时(序号 4),Mn较高且PDI较窄.而当[TMC]/[I]> 200时(序号 5),反应45 min后,单体的转化率仅为79.2 %.这是因为在聚合反应中引发剂的用量影响着活性中心的数量,随[TMC]/[I]比值增大,引发剂的用量减少,造成活性中心的数量减少,聚合速率减慢.因此选择引发剂用量为200时为最优条件.
2.1.5 聚合时间和温度对TMC聚合反应的影响
表5反映了聚合时间和温度对TMC的影响.当温度为25 ℃时,PTMC的Mn达20.4 kg·mol-1,分子量分布1.19 (序号 3).随着反应温度继续升高(序号 4),TMC的转化率和聚合物的Mn逐渐升高,但是分子量分布变宽,这可能是由于升高温度发生了热降解和酯交换反应等副反应.从表中还可以观察到,聚合反应为45 min时,分子量分布为最窄;如果继续延长反应时间(序号 7-8),单体转化已完全,副反应占主导地位,从而使得PDI逐渐变宽.
2.2 PTMC的表征
2.2.1 PTMC的GPC分析 图1为DBU/LiI/BnOH催化体系在最优条件下制备的PTMC的GPC谱,测得Mn=20.4 kg·mol-1,PDI =1.19.图中PTMC的GPC峰形具有良好的对称性,但在Mn较低的部分略微拖尾,说明聚合体系中仍有酯交换副反应的发生.
2.2.2 PTMC的DSC表征
图2为最优条件下制备的PTMC的DSC曲线.曲线a和c分别为样品的第一次和第二次加热扫描曲线,曲线上无明显熔融峰,说明聚合物PTMC是一种无定形聚合物.曲线b为样品的降温曲线,将曲线b的低温侧外推基线与测试曲线的切线交点作为Ta,将曲线b的高温侧外推基线与测试曲线的切线交点作为Tb,Ta和Tb的平均温度Tc则为聚合物PTMC的玻璃化转变温度Tg,Tg约为-22 ℃,也就是说聚合物PTMC常温下是橡胶态.
2.2.3 PTMC的IR表征
图3为PTMC的红外光谱.可以看出,1 750 cm-1处有一尖锐峰,此峰为酯羰基C=O的伸缩振动峰;1 015 cm-1处为酯基的—O—C—O—伸缩振动峰;1 172 cm-1处为酯基的—C—O—C—伸缩振动峰;2 923和2 963 cm-1处的峰为亚甲基—CH2—的伸缩振动峰;1 627,1 473和1 408 cm-1峰证明苯环的存在,即开环聚合反应由苯甲醇引发,3 130 cm-1处为苯环中Ar-H伸缩振动峰;3 000~3 500 cm-1范围存在的宽峰为羟基—OH峰,表明PTMC的链端为羟基.
2.2.4 PTMC的1HNMR和13CNMR表征
PTMC的1HNMR谱图见图4.δ=7.36(a峰)处的峰为苄醇苯环上的氢;δ=7.25处的吸收峰为氘代试剂吸收峰;δ=5.13(b峰)处的单峰為Ph—CH2—O—上的氢吸收峰;δ=4.21(c峰)处为与氧原子相连的亚甲基氢质子峰(—CH2O—);δ=3.72(g峰)处为与羟基相连的亚甲基氢质子峰;δ=2.05(d峰)处为与两个亚甲基相连的亚甲基氢质子峰(—CH2CH2CH2—);δ=2.62(e峰)处为(—CH2CH2OH)上的氢质子吸收峰;δ=1.89(f峰)处为(—CH2CH2OH—)上的氢质子吸收峰.
PTMC的13CNMR谱图见图5.在δ=76(CDCl3峰)处有一吸收峰,为溶剂峰;在δ=155(a峰)处有一个吸收峰,为C=O碳吸收峰;在δ=64(b峰)处有1个吸收峰,为与氧相连的亚甲基碳峰.在δ=27处有一个吸收峰(c峰)为亚甲基碳吸收峰(—CH2CH2CH2—).因此由NMR氢谱和碳谱解析可以看出,在BnOH存在下,DBU/LiI双催化体系催化TMC 开环聚合生成了PTMC.
2.3 DBU/LiI催化TMC的聚合机理
根据PTMC聚合物结构表征,推断其聚合机理见图6.首先,LiI与TMC羰基氧配位使得羰基活化.同时,DBU通过氢键作用活化苯甲醇的羟基.活化的苯甲醇氧负离子亲核进攻羰基碳正离子,使得TMC开环生成聚合前聚体.DBU活化聚合前聚体端羟基,生成聚合活性种,活性种继续进攻被LiI活化的单体,进而继续进行链增长反应,直至完成TMC的开环聚合.
3 结论
研究了DBU/LiI双催化体系协同引发剂BnOH催化TMC开环聚合的反应特征,讨论了温度、溶剂、催化剂、引发剂、时间、单体浓度等反应条件对TMC聚合反应的影响,最终确定反应的最优条件为:25 ℃,[TMC]=1.0 mol·L-1,[TMC]/[DBU]/[LiI]/[BnOH]=200∶1∶1∶1,45 min,所得PTMC的Mn=20.4 kg·mol-1,PDI=1.19.13CNMR,1HNMR和IR分析结果表明,在引发剂存在下只得到一种端基明确的PTMC.DSC测试结果分析表明PTMC没有熔融峰和结晶峰,说明该聚合物是一种无定形的聚合物.通过NMR表征推测DBU/LiI催化TMC聚合机理为双催化机理.
参考文献:
[1]XU J W,FENG E,SONG J.Renaissance of aliphatic polycarbonates:new techniques and biomedical applications[J].J Appl Polym Sci,2014,131(5):39822.
[2]DOBRZYЙSKI P,KASPERCZYK J,BERO M.Application of calcium acetylacetonate to the polymerization of glycolide and copolymerization of glycolide with ε-caprolactone and l-lactide[J].Macromolecules,1999,32(14):4735.
[3]KREISER-SAUNDERS I,KRICHELDORF H R.Polylactones,39.Zn lactate-catalyzed copolymerization of L-lactide with glycolide or ε-caprolactone[J].Macromol Chem Phys,1998,199(6):1081.
[4]袁建超,宋开阔,骆雯博.主-被动靶向细胞内还原引发释放的聚合物胶束抗癌药物[J].西北师范大学学报(自然科学版),2016,52(6):78.
[5]LIN H,STEYERL A,SATIJA S K,et al.Solvent penetration into ordered thin films of diblock copolymers[J].Macromolecules,2002,28(5):1470.
[6]KISTER G,CASSANAS G,BERGOUNHON M,et al.Structural characterization and hydrolytic degradation of solid copolymers of d,L-lactide-co-ε-caprolactone by Raman spectroscopy[J].Polymer,2000,41(3):925.
[7]KADOKAWA J I,NAKAMURA Y,SASAKI Y,et al.Chemoenzymatic synthesis of amylose-grafted polyacetylenes[J].Polym Bull,2007,60(1):57.
[8]KENNEDY M K J.Degradable Polymers:Principles and Applications[M].1996.
[9]ZHU K J,HENDREN R W,JENSEN K,et al.Synthesis,properties,and biodegradation of poly(1,3-trimethylene carbonate)[J].Macromolecules,1991,24(8):1736.
[10]DAI Y,ZHANG X J.Recent development of functional aliphatic polycarbonates for the construction of amphiphilic polymers[J].Polym Chem,2017,8(48):7429.
[11]SURIANO F,COULEMBIER O,HEDRICK J L,et al.Functionalized cyclic carbonates:from synthesis and metal-free catalyzed ring-opening polymerization to applications[J].Polym Chem,2011,2(3):528.
[12]DAI Y,ZHANG X J.Cationic polycarbonates via ring-opening polymerization:design,synthesis,and applications[J].Polym Chem,2019,10(3):296.
[13]WANG X L,ZHUO R X,LIU L J,et al.Synthesis and characterization of aliphatic polycarbonates[J].J Polym Sci Part A,2002,40(1):70.
[14]NIKULIN M,SVEDAS V.Prospects of using biocatalysis for the synthesis and modification of polymers[J].Molecules,2021,26(9):2750.
[15]MATSUMURA S,TSUKADA K,TOSHIMA K.Enzyme-catalyzed ring-opening polymerization of 1,3-dioxan-2-one to poly(trimethylene carbonate)[J].Macromolecules,1997,30(10):3122.
[16]AL-AZEMI T F,BISHT K S.Novel functional polycarbonate by lipase-catalyzed ring-opening polymerization of 5-methyl-5-benzyloxycarbonyl-1,3-dioxan-2-one[J].Macromolecules,1999,32(20):6536.
[17]NEDERBERG F,LOHMEIJER B G G,LEIBFARTH F,et al.Organocatalytic ring opening polymerization of trimethylene carbonate[J].Biomacromolecules,2007,8(1):153.
[18]AZEMAR F,GIMELLO O,PINAUD J,et al.Insight into the alcohol-free ring-opening polymerization of TMC catalyzed by TBD[J].Polymers,2021,13(10):1589.
[19]ZHU J L,LUO X M,LI X.Ring-opening polymerization of trimethylene carbonate with organocatalyst[J].Polymer,2023,15(3):720.
(責任编辑 陆泉芳)

