枯草芽孢杆菌YQ-1降解玉米赤霉烯酮膜蛋白酶的提取及性质分析
周于群,唐语谦
(华南理工大学食品科学与工程学院,广东广州 510640)
玉米赤霉烯酮(Zearalenone,ZEN)是镰刀菌属(Fusariumsp.)(主要是禾谷镰刀菌)产生的真菌毒素之一[1]。ZEN 广泛存在于发霉的玉米、小麦、燕麦和其他作物以及饲料、农业和副产品中[2],是17-β雌激素的结构类似物,可以与人和动物中的17-β雌激素受体竞争性结合,引发一系列生殖毒性、遗传毒性、致癌毒性和免疫毒性[3]。ZEN通过食物链蓄积,通过农产品进入牲畜和人体内,带来严重的健康风险,也会造成巨大的经济损失[4]。如何降低ZEN 污染带来的风险和损失是当前研究的主要方向。
与传统的物理和化学脱毒方法(如热处理、漂洗和碱处理)相比,生物脱毒因其更高效、更安全、成本更低和无二次污染等特点而更受青睐[5,6]。生物脱毒是指使用微生物或酶作用于真菌毒素并将其转化为低毒性或无毒代谢物的过程。ZEN 脱毒酶主要包括:内酯水解酶[7]、羰基还原酶[8]、C14/16-OH 加和酶[9](葡萄糖基化、磷酸化等)。已知细胞定位的ZEN 降解酶多以胞外酶为主[10-12]。降解酶的挖掘途径分为两种,一是传统的蛋白提取,传统提取方法步骤繁琐,蛋白易在提取过程中失活,蛋白得率低;二是从已有数据库中挖掘酶,并通过重组表达等手段验证。现有的ZEN 降解酶序列多以此途径获得。目前在ZEN 降解的研究中,明确降解酶序列的并不多,而发现酶定位在细胞膜上的更是少见,定位在细胞膜上的ZEN 降解酶几乎未见报道。
本课题组前期筛选到一株可以高效降解ZEN 的枯草芽孢杆菌Bacillus subtilisYQ-1,12 h 内全细胞催化对ZEN(20 μg/mL)的降解率达98.36%,但该菌株仍缺乏相关降解酶的研究。经初步降解酶细胞定位研究发现ZEN 降解酶定位在细胞膜上,因此本实验根据降解酶的细胞定位,以ZEN 降解率为指标,提取YQ-1 膜上的降解酶,根据氨基酸序列分析降解酶的相关信息。
膜蛋白分为整合膜蛋白和外周膜蛋白。外周膜蛋白是通过离子键、氢键与膜脂分子的极性头部相结合的蛋白,这种结合较为松散,常用高盐(1 mol/L NaCl 或KCl)或变性剂(8 mol/L 尿素或6 mol/L 盐酸胍)提取[13]。整合膜蛋白会嵌入磷脂双分子层中,与脂肪酸链共价结合,这种结合更为紧密,需要有机溶剂或去垢剂破坏磷脂双分子层后,才能将其释放出来[14]。PDB(Protein Data Bank)数据库中成功解析结构的膜蛋白仅占数据库总蛋白的1%,膜蛋白的表达量极低,缺乏有效的纯化技术是膜蛋白结构和功能研究的瓶颈。
本论文为枯草芽孢杆菌降解ZEN 的机制研究奠定基础,也为提取枯草芽孢杆菌膜上活性蛋白酶提供参考。
1 材料与方法
1.1 实验材料
胰蛋白胨、葡萄糖、琼脂、无氨基酵母氮源(YNB)、生物素、酵母提取物、海藻酸钠、壳聚糖、柠檬酸三钠、无水柠檬酸、三羟甲基氨基甲烷(Tris),均购自生工生物工程(上海)股份有限公司;尿素、丁醇、Triton X-100、Triton X-114、十二烷基-β-D-麦芽糖苷(DDM)和辛基-β-葡萄糖苷(β-OG)购自Sigma-Merck 公司;甲醇(色谱级)、乙腈(色谱级),购自广州彼西络科技有限公司;玉米赤霉烯酮(99%),购自西格玛奥德里奇(上海)贸易有限公司。
1.2 仪器与设备
DF-1O1S 集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;FA2204B 电子天平,上海精密科学仪器有限公司;JW-3021HR 高速冷冻离心机,安徽嘉文仪器装备有限公司;HWS 型恒温恒湿箱,宁波东南仪器有限公司;QYC-200 全温空气摇床,上海福玛实验设备有限公司;Waters 515 高效液相色谱,沃特世科技(上海)有限公司。
1.3 实验方法
1.3.1 菌株及培养条件
枯草芽孢杆菌B.subtilisYQ-1 为本实验室保存,种子培养基(称取30 g/L 葡萄糖,6 g/L 酵母浸提物,6 g/L NH4Cl,0.4 g/L MgSO4·7H2O,1 g/L KH2PO4和1 g/L K2HPO4,)发酵培养基(46 g/L 葡萄糖,12 g/L酵母浸提物,3 g/L (NH4)2SO4,1 g/L K2HPO4,0.4 g/L MgSO4·7H2O 和1 g/L KH2PO4)。YQ-1 于发酵培养基条件下30 ℃、180 r/min 培养20~24 h,得到菌液。
1.3.2 ZEN降解酶的细胞定位
取100 mL 按2.1 方法培养得到的菌液,低速离心,8 000 r/min 离心10 min,收集上清液过0.22 μm滤膜即得胞外上清液;无菌水重悬菌体,共清洗两次,8 000 r/min 离心5 min,弃去上清液,加入10 mL无菌水重悬菌体,冰浴条件下超声破碎菌体细胞,破碎参数设置如下:超声功率为200 W,破碎总时间为5 min,工作2 s,停4 s。高速离心细胞破碎液10 000 r/min 离心5 min,收集上清液即得胞内组分。剩余的细胞碎片用10 mL 无菌水重悬,即得细胞膜组分。
将20 µL 5 mg/mL ZEN 分别加入4 980 µL 不同组分液体中,反应体系总体积为5 mL,其中ZEN 初始质量浓度为20 μg/mL,30 ℃摇床转速180 r/min 条件下反应。实验组分别为全细胞、胞外上清、细胞膜组分和胞内组分,测定反应2 h 后各组分的降解情况。
1.3.3 ZEN降解率的测定

图1 玉米赤霉烯酮(ZEN)标准曲线Fig.1 The standard curve of zearalenone
分别制备质量浓度为0、5、10、20 和40 µg/mL的ZEN 标准液,进样20 µL,重复测定三次取平均值。横坐标为ZEN 的质量浓度,纵坐标为峰面积,根据质量浓度与峰面积关系绘制得到ZEN 标准曲线。ZEN 标准曲线如图2 所示。标准曲线在ZEN 质量浓度范围为0.0~40.0 μg/mL 时线性关系良好,可供后续计算ZEN 的质量浓度(μg/mL)时使用。

图2 不同组分对ZEN 降解的测定Fig.2 Determination of the degradation of ZEN by different components
反应12 h 后,取0.5 mL 反应液加入等量甲醇停止反应后,8 000 r/min 离心5 min,取上清液过0.22 μm 微孔滤膜,使用HPLC 检测降解后体系中ZEN 含量。高效液相色谱检测ZEN 的条件为:Agilent ZORBAX SB-C18 的色谱柱(4.6 mm×150 mm,5 μm),使用Waters 紫外检测器,检测波长238 nm,流动相为乙腈:甲醇:水=46:8:46(V/V/V),柱温30 ℃,流量0.9 mL/min,进样量20 µL。以甲醇:水为1:1(V/V)的溶剂作为空白对照,采用下列公式计算ZEN 的降解率:
式中:
B——ZEN 降解率,%;
A1——反应体系中ZEN 的初始质量浓度,μg/mL;
A2——反应体系中ZEN 的终止质量浓度,μg/mL。
1.3.4 膜定位降解酶的初步提取
将1.3.2 方法制备得到的膜组分分为数组,分别缓慢添加不同的提取试剂,维持4 ℃条件搅拌提取过夜。不同提取试剂添加情况如表1。

表1 膜蛋白提取试剂添加量Table 1 Addition amount of membrane protein extraction reagent
得到的活性组分作为粗酶液,验证其ZEN 降解能力,反应体系同1.3.2,反应12 h 后,经HPLC检测ZEN 质量浓度,计算降解率。
1.3.5 酶活测定及蛋白质定量
酶反应混合物含有100 μL 稀释酶溶液、4 μL ZEN 标准储备溶液(5 mg/mL)和896 μL PBS 缓冲液(50 mmol/L,pH 值7.0)。将反应混合物在30 ℃下孵育30 min。孵育后,向反应体系中加入500 μL甲醇以终止反应。用高效液相色谱法检测ZEN 的残留浓度。酶活定义为:每mL 液体每分钟降解1 μg ZEN 为1 单位酶活(U)。
采用BCA 法对粗酶液中的蛋白质进行定量。
1.3.6 蛋白酶解及N-端测序
选择体积分数10%的预制胶,取20 μL 粗酶液样品与80 μL loading buffer 混匀,煮沸5 min,取10 μL 上样,电泳电压为120 V,电泳时长90 min。经染色脱色后,观察结果。
将胶条切成大小约1 mm3的小块置于1.5 mL 离心管中,加脱色液,匀速摇晃,重复多次脱色至透明;加乙腈脱水至胶粒变白,真空抽干,加入终浓度为10 mmol/L DTT 的工作液,37 ℃孵育1 h;随后加乙腈脱水至胶粒变白,真空抽干,加入终浓度为55 mmol/L IAM 的工作液,置于暗室孵育30 min;再次加入乙腈脱水至胶粒变白,真空抽干,再加入去离子水清洗,该步骤重复1 次;加入50 mmol/L 碳酸氢铵孵育10 min,之后再加入Trypsin 工作液,让酶液与胶粒充分接触,待酶液被胶粒完全吸收,37 ℃孵育过夜12 h;离心收集酶解上清液,置于新的离心管中。使用C18 脱盐柱对样本进行脱盐,体积分数100%乙腈活化脱盐柱,0.1%(V/V)甲酸平衡柱子,加载样本到柱子上,随后使用0.1%甲酸洗涤柱子,洗掉杂质,最后使用体积分数70%乙腈洗脱,收集流穿液,冻干。蛋白样品酶解的肽段在HPLC 中分离后再进入质谱进行离子化然后经过质谱质量分析器将离子碎片按质量数分开,经检测器得到谱图。将谱图拼接,得到肽段序列,在NCBI(https://www.ncbi.nlm.nih.gov/)上进行序列检索。
1.3.7 粗酶液降解ZEN的影响因素
将8 µL 5 mg/mL ZEN 分别加入1 992 µL 丁醇粗酶液中,反应体系总体积为2 mL,分别在不同温度(20、30、40、50 和60 ℃)和pH 值(3、4、5、6、7、8、9 和10)条件下反应,其中,pH 值2.0~5.0 为柠檬酸-柠檬酸钠缓冲液,pH 值6.0~7.0 为PBS 缓冲液,pH 值8.0~9.0 为Tris-HCl 缓冲液,pH 值10.0~12.0 为NaHCO3-NaOH 缓冲液。在金属离子反应中,在体系中加入200 µL 1 mol/L 金属离子母液(Ba2+、Cu2+、Ca2+、Mn2+、Na+、K+、Mg2+和EDTA),使离子终浓度为100 mmol/L,加入8 µL 5 mg/mL ZEN,加入粗酶液补齐体积至2 mL。反应12 h 后,取等体积甲醇终止反应,每组设三个平行,液相测定ZEN 降解率。
1.4 数据处理及分析
所有的实验均重复三次,取结果的平均值和标准差进行分析。采用Origin 2018 分析结果并作图。
2 结果与讨论
2.1 ZEN降解酶的细胞定位
枯草芽孢杆菌B.subtilisYQ-1 全细胞对ZEN 有显著的降解作用,其中全细胞在反应2 h 后对ZEN(20 μg/mL)的降解率达到71.23%。比较胞外上清、细胞膜组分和胞内蛋白的活性,发现反应2 h 后培养上清液对于ZEN 的降解率仅为17.15%,胞内组分降解率13.96%,膜组分降解率57.74%(见图2),这表明枯草芽孢杆菌YQ-1 中发挥催化作用的活性物质主要在细胞膜上。
已发现的ZEN 降解酶多是定位在胞外或细胞内。黑曲霉ZEN-S-FS10 以其分泌到胞外的蛋白降解ZEN,Sun 等[15]采用ÄKTA 蛋白纯化分离系统获得具有ZEN 降解活性的胞外蛋白FSZ,氨基酸序列分析表明其是一种新型降解酶(与已有的ZEN 降解酶序列比较,相似度<10%)。同样是胞外蛋白的ZEN 降解酶还有不动杆菌AcinetobacterSM04 的过氧化物蛋白Prx[16],玫瑰华枝曲霉Clonostachys roseaGRZ7 的内酯水解酶PR-ZHD[17]等。随着蛋白提取技术和方式的更新,膜蛋白的提取研究也日益增多,结合国内外文献来看,本文所报道的膜定位ZEN 降解酶尚是首例。
2.2 ZEN降解酶的提取
基于降解酶在膜上的定位,根据膜蛋白的种类选择四种不同的试剂(1 mol/L NaCl、8 mol/L 尿素、丁醇和Triton X-114)进行提取。其中1 mol/L NaCl、8 mol/L 尿素针对性溶解外周膜蛋白,丁醇和Triton X-114 针对性溶解整合膜蛋白。提取得到的粗酶液进行ZEN 降解活性验证(表2),并通过SDS-PAGE 观察结果(图3)。

表2 不同试剂提取所得粗酶液的ZEN降解活性Table 2 ZEN degradation activity of crude enzyme solutions extracted with different reagents
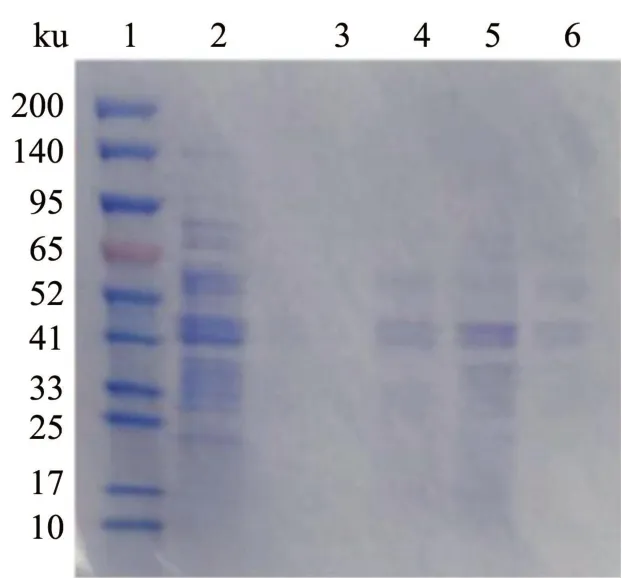
图3 不同试剂对YQ-1 膜上ZEN 降解酶的提取Fig.3 Extraction of ZEN-degrading enzymes on YQ-1 membranes by different reagents
结果如图3 所示,NaCl 和尿素对酶的溶解效果并不理想,提取蛋白量少且缺乏ZEN 降解活性。高盐环境通过破坏酶与膜之间的氢键和静电相互作用使得酶从膜上脱落,但这种作用同样会对酶本身的折叠产生影响,因此用高盐法提取降解酶时要考虑提供一个温和的缓冲环境,以保护降解酶的活性[18]。丁醇提取得到的粗酶液具有ZEN 降解活性,且SDS-PAGE 结果显示其蛋白含量较其它三组都高。丁醇具有亲水和亲脂的两亲性,对酶的结构和活性影响较小,是一类友好的膜降解酶提取试剂[18],由此可推测YQ-1 膜上ZEN 降解酶属于整合型膜蛋白。
整合膜蛋白与膜的结合更紧密,本实验尝试选用不同提取试剂,包括丁醇和4 组去垢剂(β-OG、DDM、Triton X-100 和Triton X-114),比较它们对降解酶活性的影响。不同试剂提取得到的粗酶液活性如图4 和表3 所示,反应12 h 后,丁醇组表现出了显著的降解活性,而其它四组粗酶液则没有ZEN降解活性。这可能是降解酶从膜中溶解出来时,丁醇的两亲性能较好的保持酶的空间结构,维持酶的活性,而另外4 组去垢剂提取的膜蛋白量与丁醇所提的相差不明显,但它们会在酶周围提供一个疏水环境,形成胶束(如图5 所示),可能会掩盖了酶表面的活性位点,而使得酶表现出了失活的性状[18]。不同去垢剂对不同酶活性的影响不同,在漆酶转化双酚A 的反应中,Triton X-100 的存在会促进双酚A 的转化,这是因为Triton X-100 的存在有利于漆酶的折叠和稳定,同时Triton X-100 与漆酶表面的结合也减轻了自由基和聚合产物引起的失活效应[19]。

表3 不同试剂对膜定位ZEN降解酶活性的影响Table 3 Effect of different reagents on the activity of membrane localized ZEN degrading enzymes


图4 丁醇和去垢剂提取所得膜蛋白粗酶液的ZEN 降解活性Fig.4 ZEN degradation activity of membrane protein crude enzyme solution obtained by butanol and detergent extraction
图5 去垢剂-膜蛋白-脂质胶束Fig.5 Detergent membrane protein lipid micelles
膜上的蛋白质在提取过程中易发生去折叠和聚集沉淀,这可能导致蛋白质天然结构的改变和蛋白质-蛋白质相互作用被破坏,影响酶的生物活性。不同的膜蛋白提取试剂会溶解出不同的蛋白。图6 的SDS-PAGE 图中可以看出蛋白条带集中在30~50 ku 范围,丁醇和四种去垢剂提取得到的条带接近。

图6 丁醇和去垢剂对YQ-1 膜降解蛋白的提取Fig.6 Extraction of YQ-1 membrane degradation protein by butanol and detergent
丁醇组粗酶液蛋白质量浓度为9.86 μg/mL,比酶活为0.044 U/mg 蛋白。自海桑内生菌Bionectria ochroleuca31535 中提取得到的ZEN 降解酶ZLHY-6的酶活为2.2 U/mL[20],与该降解酶相比,本实验提取所得的粗酶液酶活偏低。低酶活与酶的膜定位有关,膜蛋白丰度低,加上提取过程中不可避免的损耗,最终酶浓度低于其它提取所得的胞内外蛋白;此外,膜蛋白从膜上脱落后,酶的三维结构不像其锚定在膜上那么稳定[21],酶活性也会受到影响。刘庆瑞等[22]自链霉菌膜上提取膜蛋白ε-聚赖氨酸降解酶,测得粗酶液酶活为0.547 U/mg。综上所述,采用丁醇作为提取试剂可从枯草芽孢杆菌YQ-1 膜上将ZEN 降解酶溶出,所得粗酶液在49.3 μg 添加量下,30 ℃反应12 h 可以降解64.09% ZEN(20 μg/mL)。
2.3 ZEN降解酶的氨基酸序列分析
从图6 所得的SDS-PAGE 胶上回收箭头所指向的五条明显条带,随机酶解后N-端测序。Lane 1得到了12 条肽段,Lane 2 得到3 条肽段,Lane 3 和4 得到4 条肽段,Lane 5 得到1 条肽段。将这些肽段结果同NCBI 数据库中已有的蛋白进行比对,比对结果见表4。检索的结果显示,其中Lane 1 的肽段P12 与嗜酸芽孢杆菌的α/β水解酶序列有83.33%的相似性,与贝氏芽孢杆菌的α/β水解酶也具有66.67%的相似性[23](相似性结果比较见表5),后两者的α/β水解酶均具有羧酸酯酶结构域。具有ZEN降解能力的贝氏芽孢杆菌分泌的α/β水解酶与ZHD 101 的序列间具有23.15%的相似性。基于上述分析,推测Lane1 可能是α/β水解酶,催化ZEN 结构中大环内酯的酯键的裂解,形成开环的无毒二羟基苯基产物,实现快速降解ZEN。
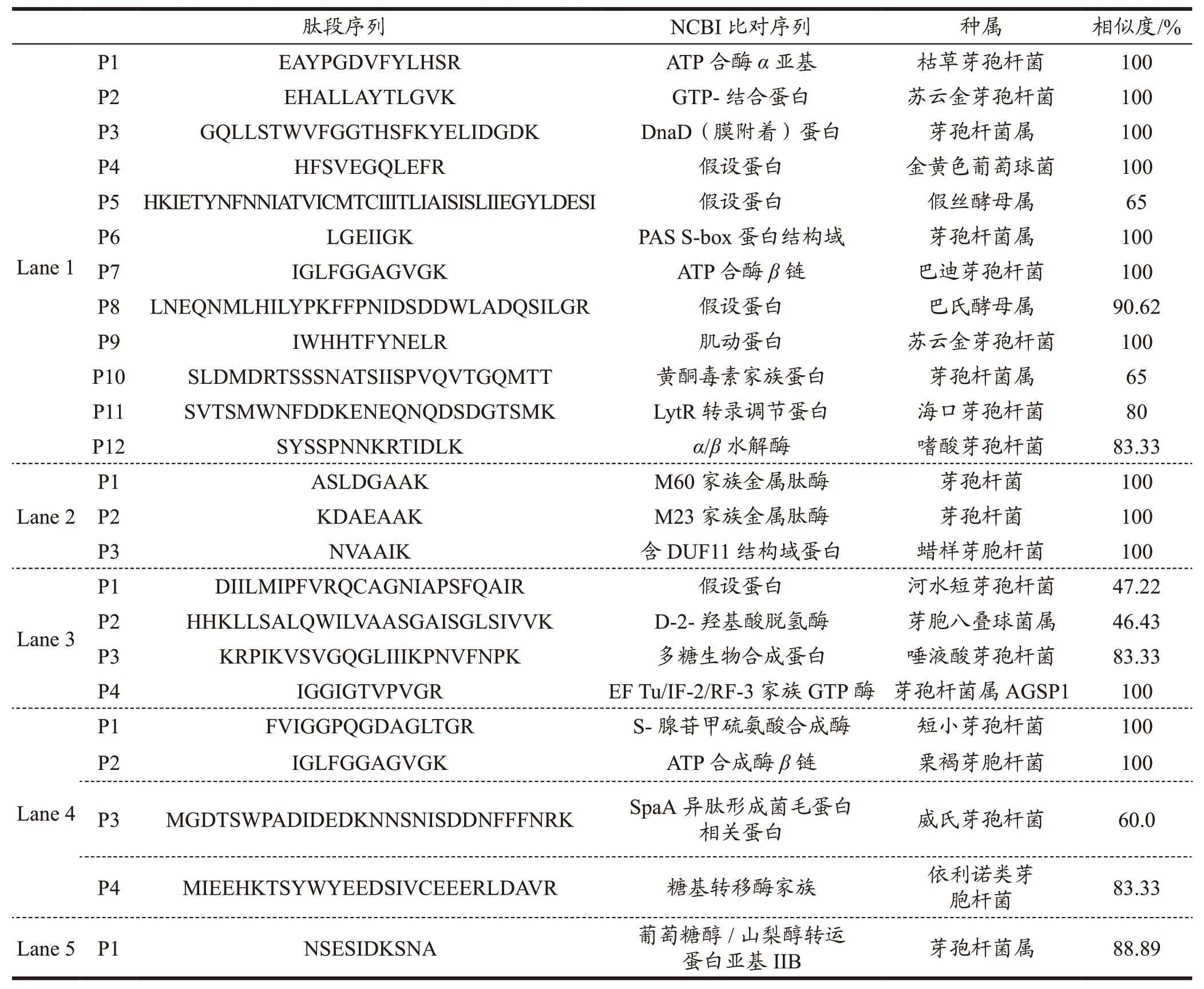
表4 不同肽段序列比对结果Table 4 Sequence comparison results of different peptides

表5 肽段与水解酶之间的序列相似性比较Table 5 Comparison of sequence similarity between peptides and hydrolases
2.4 影响粗酶液降解ZEN的因素
分别验证不同ZEN 初始浓度、温度、pH 值和金属离子条件下,丁醇组粗酶液对ZEN 的降解效果。在丁醇组粗酶液中,分别加入不同初始质量浓度(20 μg/mL 和40 μg/mL)的ZEN 进行反应。结果显示(图7a),反应12 h 后,初始质量浓度为20 μg/mL 的实验组降解率为64.09%,初始质量浓度40 μg/mL 的实验组降解率为86.50%,ZEN 质量浓度的增加有助于降解反应的发生。
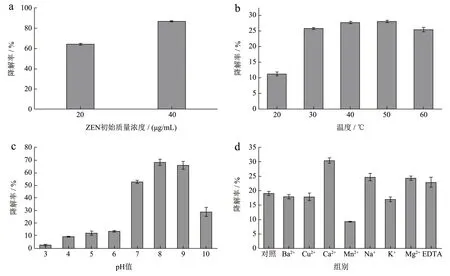
图7 不同ZEN 质量浓度(a)、温度(b)、pH 值(c)和金属离子(d)对粗酶液降解ZEN 的影响Fig.7 Effect of different ZEN mass concentrations (a), temperature (b), pH value (c) and metal ions (d)on the degradation of ZEN by crude enzyme solution
粗酶液的活性受温度影响(图7b),在20~40 ℃范围中,随着温度的升高,酶活逐渐增加,到40 ℃时相对酶活达到最大,为107.58%,温度上升到60 ℃后,酶活缓慢下降,但仍维持在90%以上,表明60 ℃高温对酶活性影响很小,这有利于扩大酶的应用范围。
同样的,不同pH 值下酶活性有显著差异(图7c),酸性条件下(pH 值3.0~6.0),酶的活性受到显著抑制(活性<30%),在pH 值7.0~9.0 的范围内保持较好的稳定性在pH 值8.0 时达到最佳(130.03%),这一点与大多数ZEN 降解酶一致[15-17,20]。而当pH 值达到10.0 时,酶活受强碱环境的影响显著下降,相对酶活降至54.12%。
在不同的金属离子溶液中(图7d),Na+(129.33%)、Ca2+(159.11%)、Mg2+(127.47%)和EDTA(119.97%)会促进酶活,Ca2+和Mg2+是脱羧酶的已知辅因子和活化剂,Mg2+和Ca2+的存在大大促进了ZEN 的降解,表明这两个离子在丁醇粗酶液对ZEN 的降解反应中发挥了作用[24]。Mn2+(48.69%)部分抑制酶活,Ba2+(93.56%)、Cu2+(93.54%)和K+(89.19%)对酶活影响不大。
综上所述,粗酶液在ZEN 降解反应中呈现如下特性:与20 μg/mL 相比,在40 μg/mL 质量浓度的ZEN 条件下,粗酶液降解率更高,粗酶液的最适反应温度为40 ℃,最适反应pH 值为8.0,Na+、Ca2+、Mg2+和EDTA 的存在对酶活有促进作用,Ba2+、Cu2+和K+对酶活影响较小,而Mn2+的存在会抑制酶活。
3 结论
本文根据枯草芽孢杆菌B.subtilisYQ-1 膜上的ZEN 降解酶定位,以ZEN 降解率为指标,提取YQ-1 细胞膜上的ZEN 降解酶蛋白。不同提取试剂比较结果发现,丁醇提取效果最佳,蛋白含量最高且粗酶液仍保持了ZEN 降解活性;其次是β-OG、DDM、Triton X-100 和Triton X-114,蛋白浓度和丁醇组相近,但酶活缺失;NaCl 和尿素的提取效果最差,蛋白含量低且无降解酶酶活。12 h 内丁醇组粗酶液对20 μg/mL ZEN 的降解率为64.09%,粗酶液蛋白含量为9.86 μg/mL,酶活为0.43 U。分析氨基酸序列,推测粗酶液中发挥ZEN 降解作用的是α/β水解酶,通过作用于ZEN 大环结构上的酯键,脱羧形成开环产物,实现ZEN 的有效脱毒。该降解酶的提取为枯草芽孢杆菌ZEN 降解酶挖掘奠定了实验基础,枯草芽孢杆菌及其ZEN 降解酶的性质分析为霉菌毒素的体外脱毒研究提供支撑。

