基于噬菌体展示技术醛固酮特异性抗体的筛选
王素娟,田晓平,赵巧辉,王天云
(1.郑州伊美诺生物技术有限公司,河南 郑州 450016;2.新乡医学院,河南 新乡 453003)
噬菌体展示技术是将编码外源蛋白或多肽的DNA片段插入能编码噬菌体衣壳蛋白的基因中,从而将蛋白或多肽展示在噬菌体表面的一种技术[1-4]。噬菌体展示技术不仅实现了表型与基因型相结合,也实现了蛋白的多样化展示与高通量筛选,从而在抗体药物研发、小分子多肽研究及分子诊断领域发挥着越来越重要的作用[5-7]。醛固酮(aldosterone,ALD)是一种在血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)和血浆中K+含量增加、Na+减少等生理刺激下由肾上腺皮质分泌的盐皮质激素[8-10]。研究发现,ALD在体内水平的升高可诱发原发性醛固酮增多症(primary aldosteronism,PA)、糖尿病、慢性肾脏病等多种代谢性相关疾病。目前,临床上常使用放射免疫法或化学发光免疫法来检测血清或血浆中肾素活性、AngⅡ和ALD水平[11-12],但检测过程中可出现假阳性率高的现象;特别是在肾素水平低至无法检测的情况下,ALD水平也会受到影响而低于正常水平[12-14]。因此,为更好地实现ALD在ALD相关代谢性相关疾病早期诊断中的灵敏度与准确性,寻找高亲和力、高竞争性的特异性ALD抗体十分重要。本研究利用噬菌体展示技术构建单链片段(single-chain variable fragment,ScFv)噬菌体文库,筛选高亲和力、高竞争性的兔ALD单抗,以期为后续ALD诊断试剂盒的研发提供原材料。
1 材料与方法
1.1 材料
1.1.1 实验动物、细胞株、菌种及载体质粒
5只健康清洁级新西兰大白兔,雌性,6周龄,购自北京大学医学部;人胚胎肾(HEK) 293细胞株购自美国Thermo Fisher公司,大肠杆菌TG1菌株购自湖南丰晖生物科技有限公司;噬菌粒载体pcomb3xss由本实验室保存;超级噬菌体(superPhage)购自美国Phageomics公司,并由本实验室制备和保存。
1.1.2 主要试剂与仪器
ALD、牛血清白蛋白(bovine serum albumin,BSA)、弗氏完全佐剂、弗氏不完全佐剂购自美国Sigma公司,TRIzol试剂购自瑞士Roche公司,限制性核酸内切酶SifI、KasI、BamHI购自美国Thermo公司,SuperScriptTMⅢ First-Strand Synthesis SuperMix、T4 DNA Ligase购自美国Invitrogen公司,PrimeSTAR®Max DNA polymerase购自日本TaKaRa公司,ALD-血蓝蛋白(keyhole limpet hemocyanin,KLH)由郑州伊美诺生物技术有限公司偶联合成并保存,引物均由生工生物工程(上海)股份有限公司合成;1 mm电击杯购自美国BIO-RAD公司,电转仪购自美国BIO-RAD公司,聚合酶链式反应(polymerase chain reaction,PCR)仪购自美国Thermo公司,超净工作台购自苏净集团苏州安泰空气技术有限公司;落地式离心机购自美国Thermo公司,酶标仪购自郑州安图生物工程股份有限公司。
1.2 动物免疫组织的获取
将抗原ALD-KLH稀释至 2 mg·L-1,采用背部多点注射方法对5只新西兰大白兔进行首次免疫,免疫剂量为每只1 mg;每隔2周进行1次免疫,且免疫剂量减少50%。从第3次免疫开始,每次免疫1周后采集大白兔耳缘静脉血,使用包被0.25 mg·L-1ALD-BSA抗原的化学发光板,采用间接法和免疫竞争法测定血清滴度;根据结果择优选取效价高、特异性好的大白兔;然后,采用放血处死法将其处死,摘取其脾脏和骨髓等组织保存在液氮中备用。
1.3 ScFv噬菌体文库的构建
1.3.1 RNA提取及反转录
从液氮中取出脾脏和骨髓,并在低温下研磨至粉末,采用TRIzol试剂一步法提取总RNA,用紫外分光光度计测定RNA浓度,并根据浓度取100 ng总RNA,用质量分数为2%琼脂糖凝胶鉴定RNA质量;按照SuperScriptTMⅢ First-Strand Synthesis SuperMix试剂盒说明书进行反转录,得到cDNA。
1.3.2 引物设计及目的片段扩增
设计连接轻链可变区(variable region of light chain,VL)和重链可变区(variable region of heavy chain,VH)的连接肽(linker)上下游引物:上游引物序列为5′-CCTTCTAGATCTCCTTGGTGGGGGTGGTGGCGGGCTCGTAGGATCTCCAGCTCGGTCCC-3′,下游引物序列为5′-AGGAGACCACCGCCACCGAGCCCGCCACCACCCCCACCCAGTCGGTGGAGGAG-3′;设计可引入酶切位点并能完成ScFv片段扩增的上下游引物:上游引物序列为5′-CTGCTGCTGGGCCCAGGCGGCC-3′,下游引物序列为5′-GAGGAGGAGGGCCGGCCTGGCC-3′。利用实验室保存的PCR上下游简并引物扩增其VL和VH片段。反转录产物为模板2.5 μL。反应条件为:95 ℃变性15 s,56 ℃变性15 s,72 ℃变性25 s,共30个循环;然后,核酸纯化回收目的片段,按摩尔比11进行合并。
1.3.3 单链ScFv制备
使用引物ScFv-1/linker-1、ScFv-2/linker-2分别扩增回收产物。反应条件为:95 ℃变性15 s,56 ℃变性15 s,72 ℃变性25 s,共20个循环;回收目的片段1。使用引物ScFv-1/ScFv-2进行VL与VH的相互搭桥拼接和扩增;反应条件为:95 ℃变性15 s,68 ℃变性 1 min 15 s,共10个循环,回收目的片段2。将目的片段2与噬菌粒载体Pcomb3xss分别使用限制性内切酶SifI酶切,连接后电转化至大肠杆菌TG1菌株(图1);然后,用2xYT培养液进行梯度倍比稀释,并涂布含氨苄抗性的平板,37 ℃培养过夜;计数单克隆菌落并计算库容。剩余培养后的菌液加入体积分数80%的甘油冻存至-80 ℃冰箱,作为初级抗体库。随机挑取氨苄抗性平板上的10个单克隆进行PCR鉴定并测序,用IMGT软件进行序列分析。
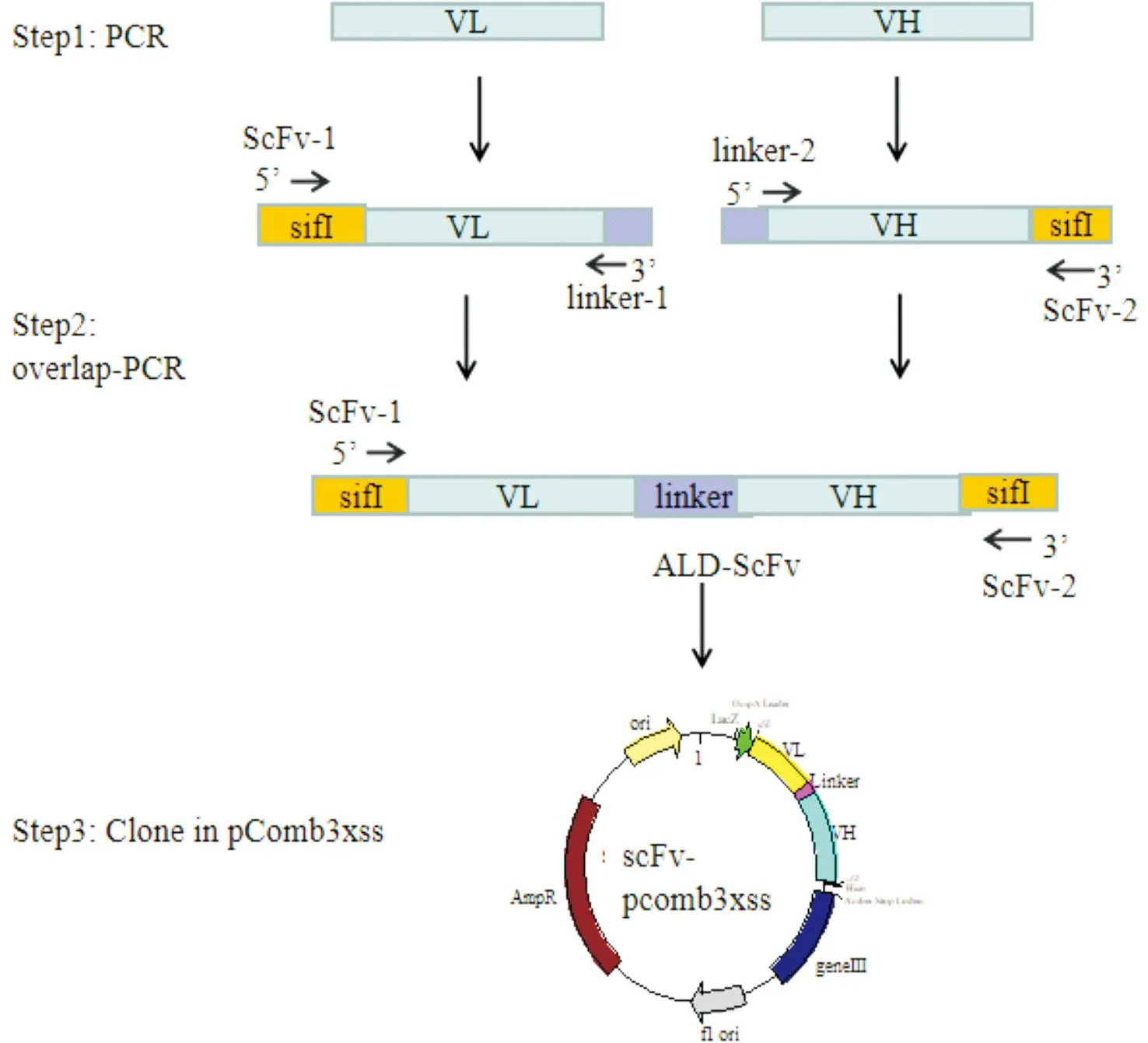
图1 ALD噬菌体文库构建示意图
1.4 噬菌体文库淘选
使用辅助噬菌体superPhage侵染初级抗体库,37 ℃侵染0.5 h后,30 ℃过夜震荡培养后;次日,5 000 r·min-1离心收集上清,获得重组噬菌体抗体。将抗原ALD-BSA稀释至20 mg·L-1,包被至免疫管中,4 ℃过夜孵育;将噬菌体抗体上清使用20 g·L-1脱脂奶粉封闭后加入免疫管中,室温孵育2 h,用的Gly-HCl(pH=2.5)进行洗脱,加入Tris-HCl(pH=7.4)中和洗脱液至pH=7.0后,再加入宿主菌TG1(OD600=0.5),振荡培养1 h;然后,加入superPhage侵染30 min,再振荡培养1 h,5 000 r·min-1离心,然后用2xYT-A+K+轻悬细胞沉淀,30 ℃过夜培养。采用同样方法筛选,逐轮降低抗原包被浓度,筛选至少3轮。自2轮淘洗开始,利用ALD-BSA抗原与噬菌体文库特异结合的原理,对洗脱下来的噬菌体应用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)进行多克隆滴度测定,并将培养后的菌液梯度稀释后涂布平板上,计数单克隆,计算出库量及产出比(投入量/产出量),鉴定噬菌体文库质量;挑取6个克隆进行序列测定,使用IMGT软件分析监控淘洗序列多样性。
1.5 噬菌体单克隆的制备及检测
1.5.1 噬菌体单克隆的制备
挑取出库平板上200个单克隆菌株,接种于含氨苄抗生素的2xYT培养基中,37 ℃、250 r·min-1震荡过夜培养;次日,按120比例对接菌液于含氨苄抗生素的2xYT培养基中,3 h后加入superPhage侵染30 min,再振荡培养1 h,更换2xYT-A+K+培养基,16 ℃、250 r·min-1过夜震荡培养。
1.5.2 噬菌体单克隆检测
将检测抗原ALD-KLH稀释至0.1 mg·L-1,然后包被在化学发光板上,4 ℃孵育过夜,用含吐温-20的磷酸盐缓冲液洗涤2遍后,BSA 37 ℃封闭 2 h;洗涤后加入制备好的单克隆噬菌体,37 ℃孵育0.5 h;洗涤后加入二抗M13-HRP,37 ℃孵育0.5 h;洗涤后加入显色试剂,使用酶标仪检测450 nm处吸光度值。
1.6 构建真核表达载体HEK-293细胞表达
将筛选得到的克隆序列插入至pCMV3表达载体,提取质粒后使用瞬时转染方法进行HEK293细胞转染;1周后,收取上清,应用亲和层析纯化及十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳鉴定其纯度及表达量。
2 结果
2.1 5只大白兔免疫血清效价
5只大白兔在第5次免疫后,间接法检测其血清效价结果显示,4#、5#大白兔血清在稀释32 000倍后,吸光度值仍>10 000。免疫竞争法检测结果显示,5#大白兔血浆样本低值与高值的比值为21,优于其他大白兔。结果见图2。因此,选取5#大白兔进行噬菌体文库构建。
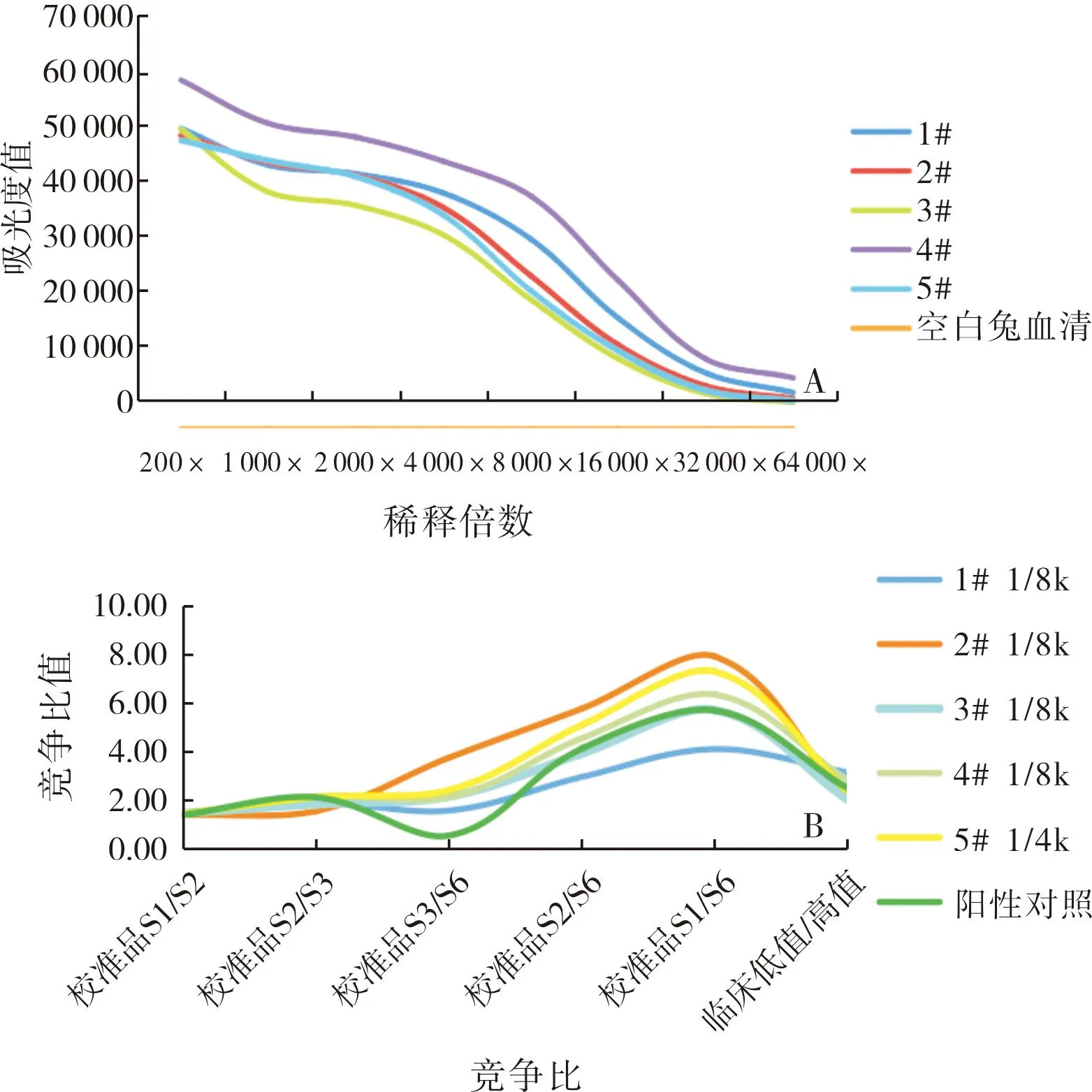
A:间接法;B:免疫竞争法。
2.2 ALD噬菌体文库构建与多样性鉴定结果
常规PCR扩增出VL及VH基因片段,大小350 bp左右;经搭桥拼接成ScFv(VL+VH)后,琼脂凝胶电泳分析可看到750 bp左右大小条带(图3),与最初设计的片段大小一致。ScFv经酶切连接电转至大肠杆菌TG1中,构建一个库容为4.73×108cfu·mL-1的噬菌体文库;挑取10个克隆分析结果显示,10条序列均不相同。
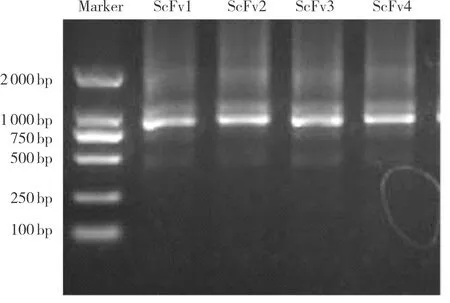
图3 ALD噬菌体文库ScFv拼接后琼脂凝胶电泳条带
2.3 ALD噬菌体文库淘洗及多克隆检测结果
噬菌体文库3轮筛选结果显示,出库量和产出比逐轮升高(表1)。每轮测序6个单克隆,经IMGT分析显示,3轮淘洗6条序列均不相同。
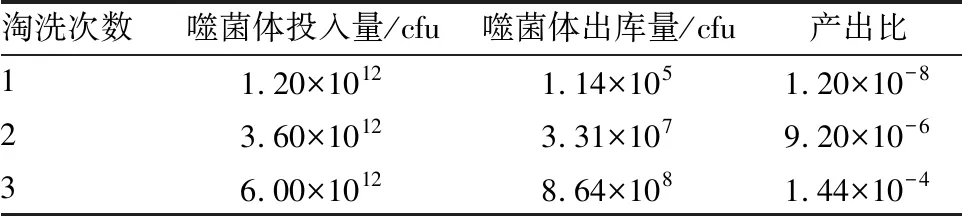
表1 噬菌体文库3轮筛选出库量和产出比
2.4 ALD噬菌体文库多克隆检测结果
富集淘洗过程中,每轮使用化学发光免疫法对ALD噬菌体进行检测,结果显示,淘洗3轮后,噬菌体文库在校准品和临床样本的检测中竞争梯度均较好,达到2倍梯度,结果见图4和图5。
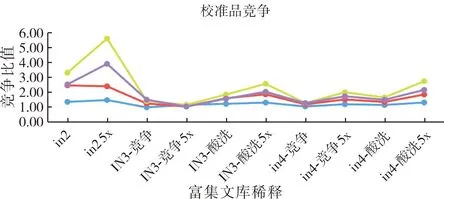
图4 噬菌体文库校准品竞争检测结果
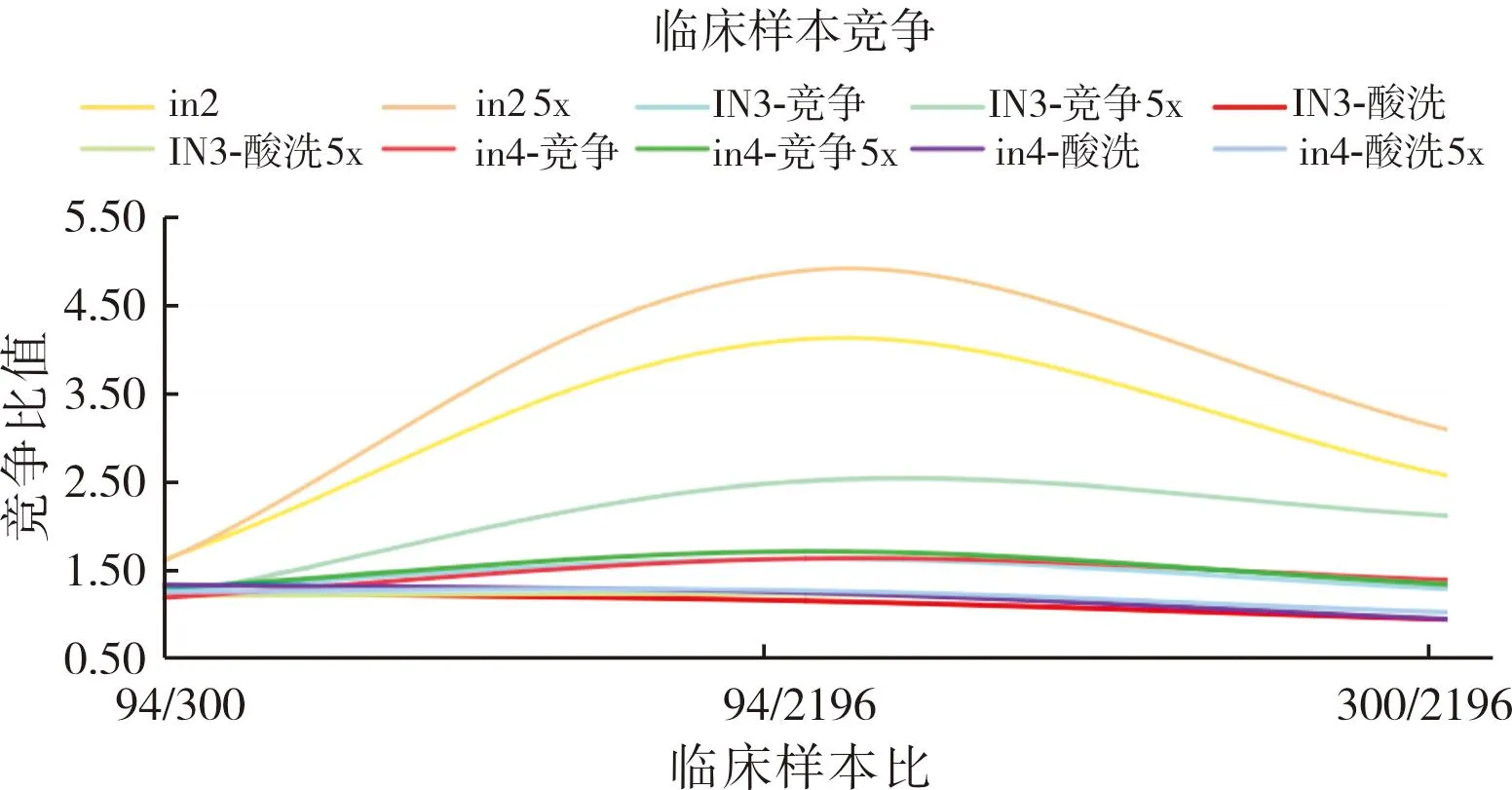
图5 噬菌体文库临床样本竞争检测结果
2.5 ALD单克隆噬菌体检测结果
3轮淘洗出库平皿挑取300个单克隆,制备单克隆噬菌体,并使用化学发光免疫法进行ELISA检测;结果显示,300个克隆中阳性率达100%(图6),校准品竞争检测阳性克隆42个(图7),筛出率14%;42个阳性克隆进一步进行临床样本竞争检测,筛出16株单克隆符合要求(图8);将16株进行复测,2次检测结果一致(图9)。AD185、AD277抗体在校准品及临床样本竞争中均表现出比阳性对照高出2倍的竞争优势。
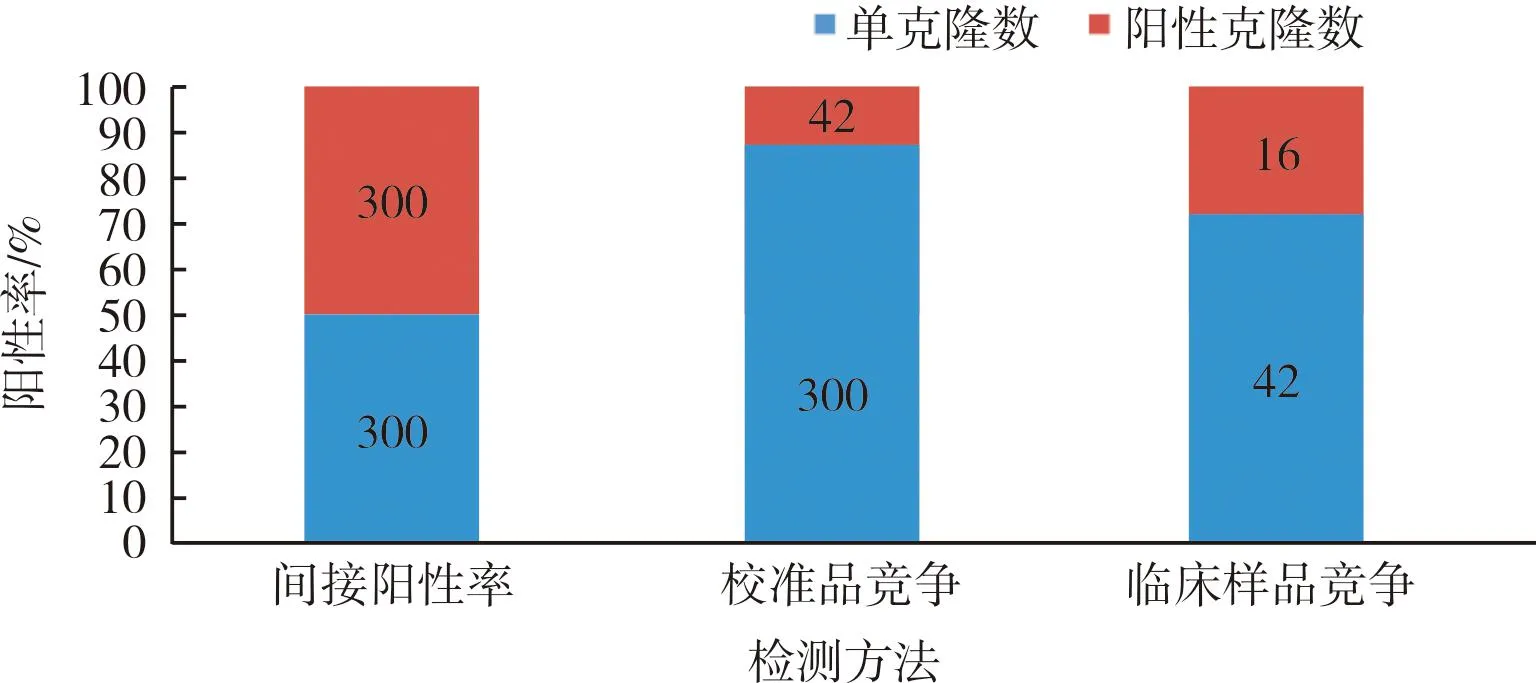
图6 噬菌体单克隆检测初筛
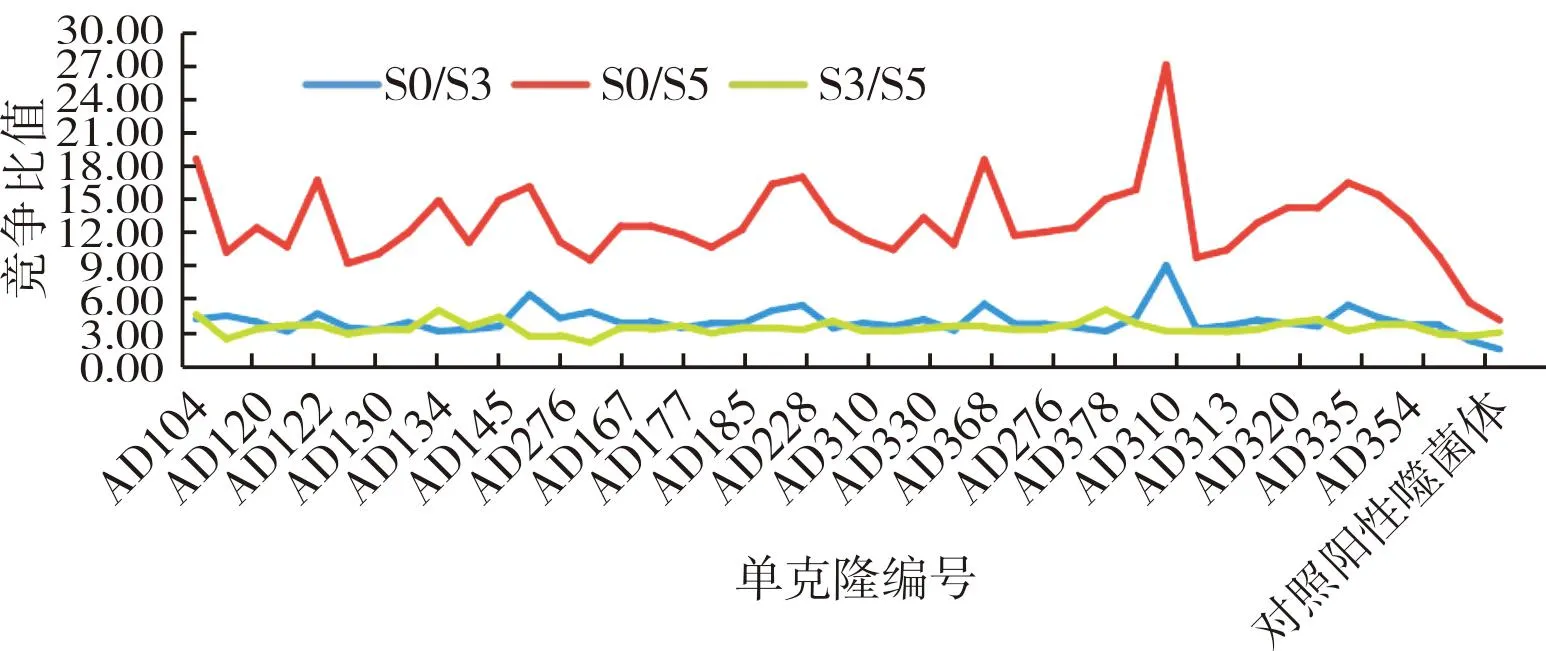
图7 噬菌体单克隆校准品竞争检测
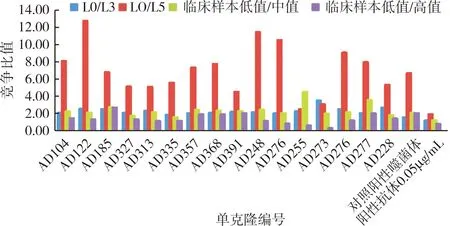
图8 噬菌体单克隆竞争检测
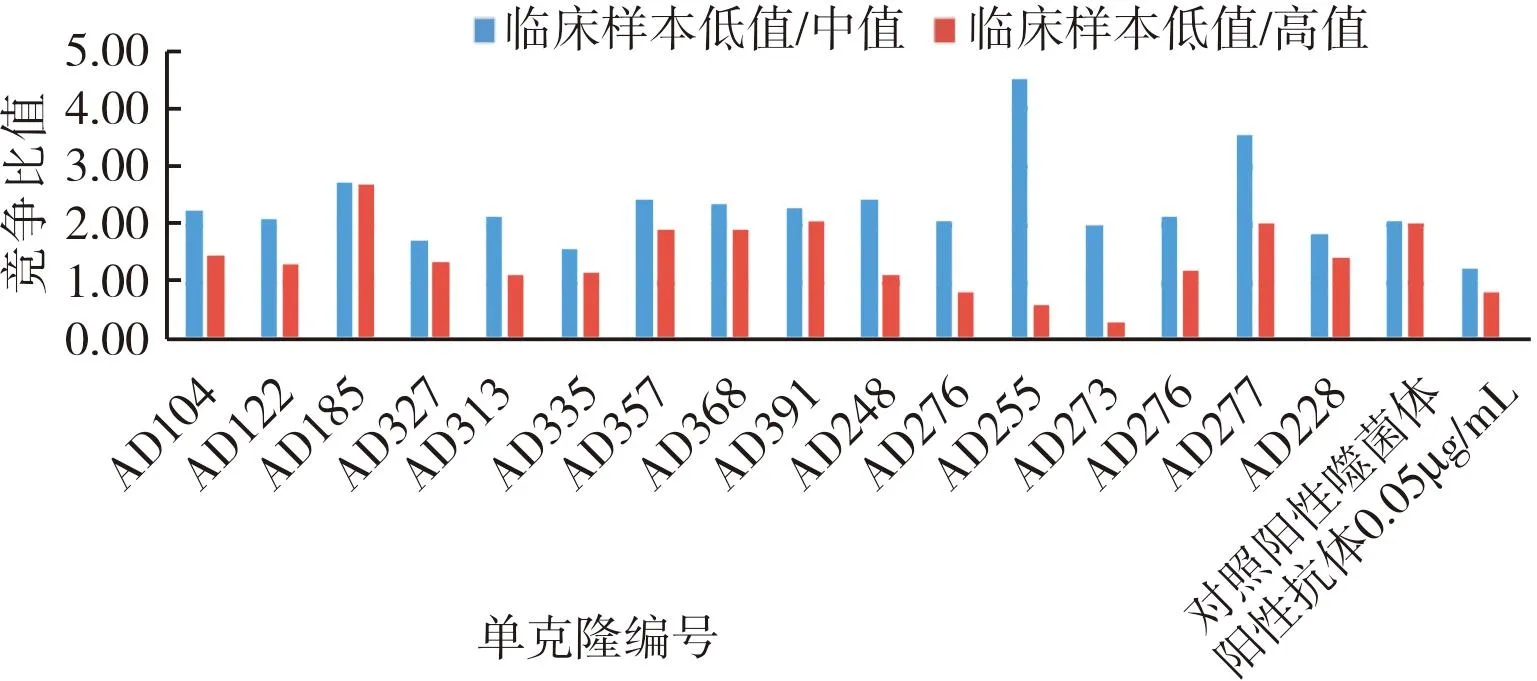
图9 噬菌体单克隆临床样本竞争复测
2.6 HEK-293细胞真核表达载体表达及纯化鉴定
将高竞争性的6株抗体经过瞬时转染,纯化后进行10% SDS-PAGE还原胶电泳,结果显示,在重链50 000及轻链25 000位置均有条带,结果见图10。
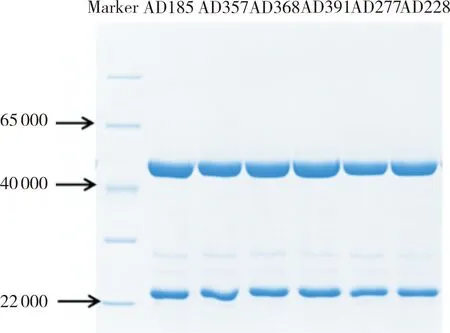
图10 高竞争性的6株抗体SDS-PAGE电泳条带
3 讨论
ALD是盐皮质激素中一种重要的类固醇激素,研究表明,其除了调节体内钠钾平衡,还与继发性高血压的典型代表PA有关[15-17]。PA是由于肾上腺皮质增生或肿瘤分泌过多ALD而引起潴钠排钾,血容量上升,导致血压升高同时肾素活性被抑制的一种疾病;而ALD分泌过多则会导致心血管疾病、肾功能损害、胰岛素抵抗等[18-19]。研究表明,ALD的合成主要受肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)、钾离子的调节,同时也受促肾上腺皮质激素调控,而RAAS通常在血管内容量耗尽或肾动脉灌注减少的情况下被激活,通过促进远端肾小管和集合管中钠和水的再吸收,使血管内容量增加[20-21]。ALD过度激活肾盐皮质激素受体可导致血管内容量扩张,最终导致高血压伴或不伴低血钾的风险[22-24]。国内外研究发现,ALD水平异常不仅诱发高血压,还容易导致心血管疾病、慢性肾病、糖尿病、肥胖等疾病的产生[18,25-26]。因此,机体内ALD水平的准确检测对预防高血压、糖尿病、动脉粥样硬化等代谢性慢性疾病至关重要。
ALD检测方法从最初的纸层析生化反应比色法到放射免疫技术,再发展到2008年利用质谱法开发的金标准,但质谱法难度高、价格昂贵,因此,化学发光免疫法便应运而生[17,27]。目前,意大利DiaSorin公司在2012年底推出的ALD检测试剂盒是唯一通过CDFA认证的全自动化学发光平台的进口试剂盒,但其成本昂贵;因此,急需研发一款灵敏度高、特异性好的试剂盒以改变现状。本研究通过将抗原ALD-KLH 背部注射5只新西兰大白兔进行首次免疫,取脾脏和骨髓等组织,使用常规PCR扩增出VL及VH基因片段,大小350 bp左右,经搭桥拼接成ScFv(VL+VH)后,琼脂凝胶电泳分析可看到 750 bp左右大小条带,与最初设计的片段大小一致。ScFv经酶切连接电转至大肠杆菌TG1中,构建一个库容为4.73×108cfu·mL-1的噬菌体文库;挑取10个克隆,分析结果显示,10条序列均不相同,说明该文库多样性较好,达到继续筛选标准。对噬菌体文库进行3轮筛选结果显示,出库量和产出比逐轮升高,说明噬菌体文库得到了富集。然后,每轮测序6个单克隆,经IMGT分析后,均为不同的抗体序列,说明文库保持了较高的序列多样性。经3轮淘洗出库平皿挑取300个单克隆,制备单克隆噬菌体,ELISA结果显示,300个克隆中阳性率达100%,校准品竞争检测阳性克隆42个,筛出率14%,42个阳性克隆进一步进行临床样本竞争检测,筛出16株单克隆符合要求,将16株进行复测,2次检测结果一致;送测序列经IMGT软件分析,优选6条抗体序列进行构建表达;将高竞争性的6株抗体经过瞬时转染,纯化后进行10% SDS-PAGE还原胶电泳,结果显示,在重链50 000及轻链25 000位置均有条带,表明已成功筛选构建出高竞争性且表达量较好的抗体。
4 结论
通过噬菌体展示技术可成功筛选出ALD抗体,这为小分子抗体的发现提供了一种参考方法。筛选出的AD185、AD277抗体在校准品及临床样本竞争中,均表现出比阳性对照高出2倍的竞争优势,为ALD检测试剂盒原材料的开发提供了可能性,对ALD检测灵敏度的提高有重要意义。

