响应面法优化魔芋葡甘聚糖的纯化工艺
包芮宁,吴卫国,廖卢艳,王 燕
(湖南农业大学食品科学技术学院,湖南长沙 410128)
魔芋是一种多年生草本植物,主要生长在位于亚洲东南部亚热带的山区或丘陵地带[1],在我国广泛种植于陕西、甘肃以及云、贵、川等地,是我国重要的经济作物[2-3]。魔芋中含有不溶性淀粉、纤维素、蛋白质以及脂类[4],其主要食用部位是球状块茎。魔芋葡甘聚糖(Konjac Glucommannan,KGM)作为球状块茎中占比最多的成分,含量可达到50%以上[5-6],KGM 含量也常用作评价魔芋粉质量优劣的关键指标[7]。
KGM 由葡萄糖和甘露糖结合构成[8-9],可作为天然的食品防腐剂用于防止食品变质以及虫害[10],也能够预防多种慢性疾病,包括降低血糖、胆固醇、甘油三酯和血压水平[11]等,还能通过调节新陈代谢、改善胃肠道环境、增加有益菌、增强饱腹感以达到减肥的目的[12-13],现已被应用于临床医药等领域[14-15]。此外KGM 还具有水溶性好、胶凝性极佳、生物可降解性强等诸多优良特性[16-17],许多文献也报道过其在食品包装膜方面的进展[18-20],已被引入许多国家用作食品添加剂和膳食补充剂,在食品、医药、化工[21-24]等领域均具有很好的应用价值,因此提高KGM 含量的研究对研发和应用具有重要意义。
目前KGM 的纯化方法大致包括乙醇沉淀法、生物酶法、Pb(AC)2法等,但存在引入重金属离子、KGM 得率较低、操作复杂且效率低下等问题,限制其应用于食品产业加工[25-26]。由于KGM 具有易溶于水而不溶于有机溶剂的特点[27],本研究采用超声波辅助乙醇沉淀法进行纯化[28],运用响应面试验设计出魔芋粉中KGM 的最优纯化条件,测定得率,并通过傅立叶红外光谱仪(FT-IR)和X 射线衍射仪(XRD)对其优化前后的结构进行表征,以期为KGM 的进一步开发和利用提供理论基础和思路借鉴。
1 材料与方法
1.1 材料与仪器
魔芋粉 湖南省好味屋食品有限公司;硫酸、氢氧化钠、无水乙醇、溴化钾 均为分析纯,国药集团化学试剂有限公司;葡萄糖标准溶液 中国氪道试剂公司;DNS 显色液 中国飞净生物科技有限公司。
1510-02624 全波长高速酶标仪 赛默飞世尔科技中国有限公司;101-2AB 型电热鼓风干燥箱 天津市泰斯特仪器有限公司;S-LC 电热恒温水浴锅北京市永光明医疗仪器有限公司;BS224S 电子天平
赛多利斯科学仪器北京有限公司;KH-250DE 型数控超声波清洗器 昆山禾创超声仪器有限公司;LD5-2A 离心机 北京雷勃尔离心机有限公司;IRAffinity-1 傅立叶红外光谱仪、XRD-6000 型X 射线衍射仪 日本岛津公司。
1.2 实验方法
1.2.1 葡萄糖标准曲线的制作 分别移取0、0.4、0.8、1.2、1.6、2.0 mL 的1 mg/mL 葡萄糖标准溶液于6 个25 mL 具塞试管中并用蒸馏水补至2 mL,加入1.5 mL DNS,100 ℃水解5 min,冷却后定容。移取样液于酶标板,在540 nm 处测其吸光值,绘制标准曲线。标准曲线方程为Y=0.3589X+0.0006(R2=0.9945),可见葡萄糖含量在0~1.0 mg/mL 范围内有良好的线性关系。
1.2.2 魔芋粉中KGM 含量的测定 魔芋粉的纯化[26]:称取1 g 魔芋粉加入乙醇溶液,搅拌均匀后在一定的超声温度、功率和时间下进行纯化,过滤后称取0.1900~0.2000 g 滤渣加入蒸馏水,溶胀3 h 后于离心机转速4000 r/min 下离心20 min,上清液即为提取液。
KGM 含量的测定参照NY/T 494-2010 魔芋粉标准附录A[29]。根据公式(1)计算其含量。
魔芋粉中KGM含量(以干基计,%)=
式中:ε为KGM 水解前后葡萄糖和甘露糖残基的分子量之比,ε=0.9;T 为KGM 水解液的葡萄糖含量,单位为毫克(mg);T0为KGM 提取液的葡萄糖含量,单位为毫克(mg);m 为魔芋粉样品质量,单位为克(g);w 为样品含水量,%。1.2.3 魔芋粉中KGM 得率的测定 根据公式(2)计算KGM 得率[30]。
式中:KGM 质量与魔芋粉质量,单位均为毫克(mg)。
1.2.4 单因素实验
1.2.4.1 料液比对KGM 含量的影响 准确称量魔芋粉每份1.0 g,将乙醇浓度、超声温度、超声时间以及超声功率分别设定为80%、50 ℃、45 min、200 W,料液比分别调为1:40、1:60、1:80、1:100、1:120(g/mL),在该条件下进行实验,考察料液比对其含量的影响。
1.2.4.2 乙醇浓度对KGM 含量的影响 准确称量魔芋粉每份1.0 g,将料液比、超声温度、超声时间以及超声功率分别设定为1:100(g/mL)、50 ℃、45 min、200 W,乙醇浓度分别为50%、60%、70%、80%、90%,在该条件下进行实验,考察乙醇浓度对其含量的影响。
1.2.4.3 超声温度对KGM 含量的影响 准确称量魔芋粉每份1.0 g,将乙醇浓度、料液比、超声时间以及超声功率分别设定为70%、1:100(g/mL)、45 min、200 W,超声温度在30、40、50、60、70 ℃下进行实验,考察超声温度对其含量的影响。
1.2.4.4 超声功率对KGM 含量的影响 准确称量魔芋粉每份1.0 g,将乙醇浓度、料液比、超声温度以及超声时间分别设定为70%、1:100(g/mL)、50 ℃、45 min,超声功率分别为125、150、175、200、225 W,在该条件下进行实验,考察超声功率对其含量的影响。
1.2.4.5 超声时间对KGM 含量的影响 准确称量魔芋粉每份1.0 g,将乙醇浓度、料液比、超声温度以及超声功率分别设定为70%、1:100(g/mL)、50 ℃、175 W,超声时间分别为15、30、45、60、75 min,在该条件下进行实验,考察超声功率对其含量的影响。
1.2.5 响应面试验设计 基于单因素实验结果,排除对含量影响不显著(P>0.05)的因素,选择料液比、乙醇浓度和超声时间的相关水平进行Box-Behnken 试验设计以确定最优条件,具体试验水平参照表1。
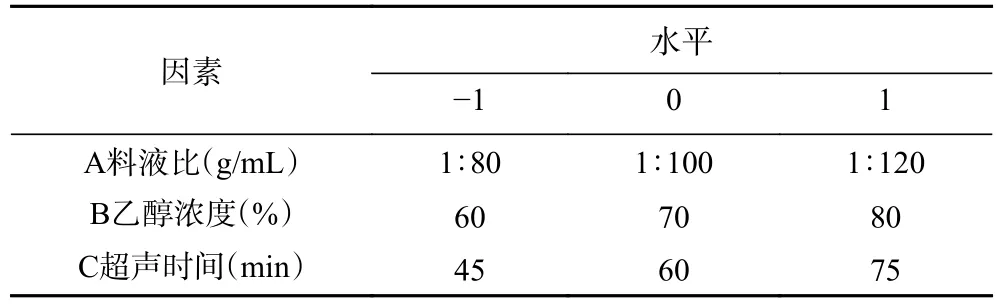
表1 响应面试验因素水平设计Table 1 Factor level design of response surface test
1.3 结构表征
1.3.1 FT-IR 测定 将样品与溴化钾烘干,按质量比1:50 混合研磨,压片后放入红外光谱仪,在波数范围4000~500 cm-1,分辨率4 cm-1下测定[31]。
1.3.2 XRD 测定 将样品置于载玻片压片,放入X 射线衍射仪测试。测试条件:室温,管压40 kV,电流40 mA,2θ扫描范围4°~40°,速率2°/min 条件下进行[32]。
1.4 数据处理
每组实验进行三次平行,结果用平均值表示。运用IBS SPSS Statistics 26 进行单因素显著性分析,Origin2022 软件进行图形绘制,Design-Expert 13.0进行响应面试验结果分析。
2 结果与分析
2.1 单因素实验结果分析
2.1.1 料液比对KGM 含量的影响 如图1 所示,料液比较少时,魔芋粉中大分子物质难以解聚溶出,KGM 的含量因此较低[33]。随着料液比的增大,乙醇量相对增多,KGM 含量逐渐升高。当料液比为1:100(g/mL)时,KGM 含量达到最大值77.88%后逐渐下降。因为其在乙醇量相对较多的情况下发生过度溶胀,包埋大量水分[34],过多水溶剂的存在导致部分KGM 溶解于水中,含量在此情况下开始下降。通过统计学分析,料液比对KGM 含量的影响有显著差异(P<0.05),其中料液比为1:100(g/mL)时极显著,选取料液比1:80、1:100、1:120(g/mL)进行响应面试验。
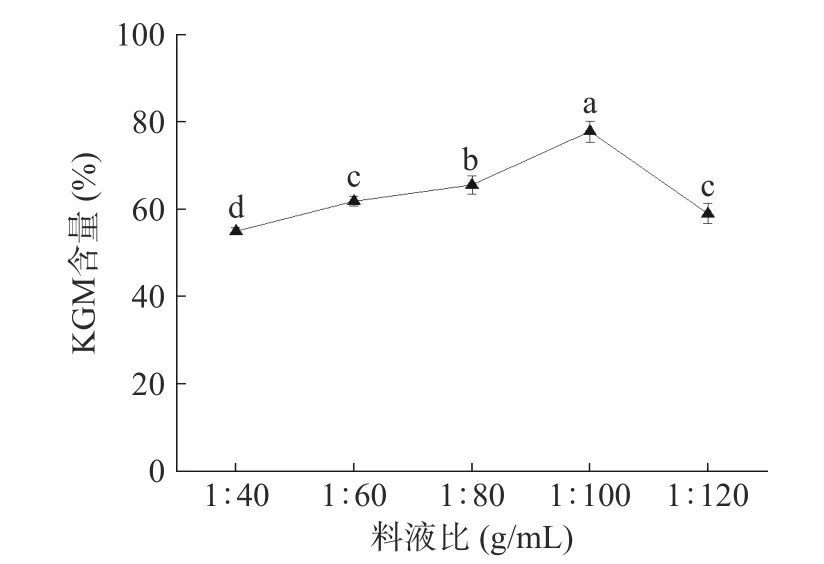
图1 料液比对KGM 含量的影响Fig.1 Effect of material-liquid ratio on the content of KGM
2.1.2 乙醇浓度对KGM 含量的影响 如图2 所示,魔芋粉加入乙醇溶液后,其中的KGM、蛋白质、淀粉等物质溶于水,在乙醇浓度较低的条件下,KGM所受到的沉淀作用较小,而且其中一部分可能会溶解到水溶剂中流失,导致含量较低[30]。而随着乙醇浓度增长至70%时,KGM 含量达到了最大值为83.41%。乙醇浓度继续增大,抑制KGM 分子的伸展,不能有效地将其包裹、结合的杂质释放,导致含量降低[35]。通过统计学分析,乙醇浓度对KGM 含量的影响有显著差异(P<0.05),其中乙醇浓度70%时极显著,选取乙醇浓度60%、70%、80%进行响应面试验。

图2 乙醇浓度对KGM 含量的影响Fig.2 Effect of ethanol concentration on the content of KGM
2.1.3 超声温度对KGM 含量的影响 图3 所示,当超声温度为50 ℃时,含量达到最大值81.24%。这是由于温度较低时,魔芋粉中大分子物质结合较为紧密,升温使得分子从魔芋粉中扩散的速率提高[33],超声温度继续升高,可能会导致KGM 分子结构遭到破坏,含量有所下降。通过统计学分析,超声温度对KGM 含量的影响没有显著差异(P>0.05)。因此,后续实验中超声温度固定为50 ℃。
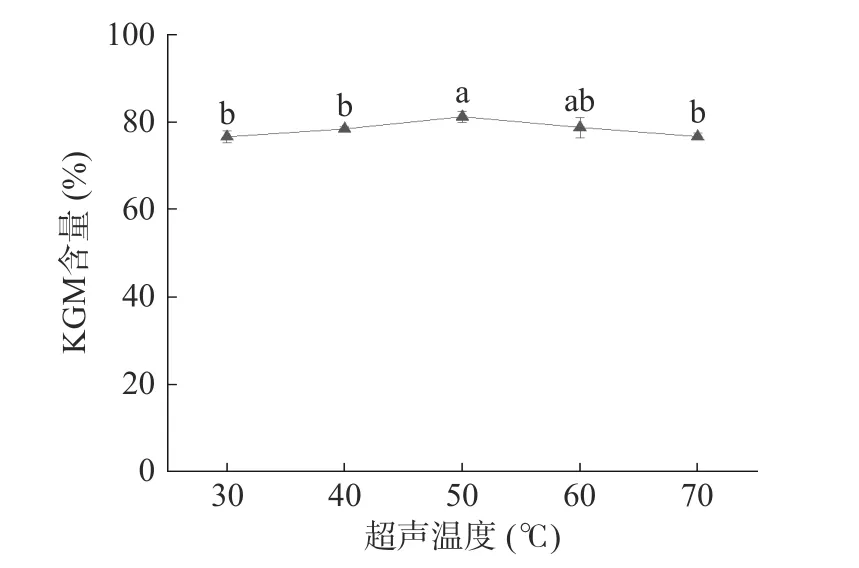
图3 超声温度对KGM 含量的影响Fig.3 Effect of ultrasonic temperature on the content of KGM
2.1.4 超声功率对KGM 含量的影响 如图4 所示,功率过小影响了超声波对魔芋粉的破坏作用,未能完全打开分子链,使杂质不能有效溶出,因此KGM 含量较低。随着超声功率达175 W,含量达到了最大值82.26%。随着功率继续增大,在空化作用下多糖分子结构遭到破坏,细胞壁破碎加剧,导致KGM 含量逐渐减少[5,31]。通过统计学分析,超声功率对KGM 含量的影响没有显著差异(P>0.05)。因此,后续实验中超声功率固定为175 W。
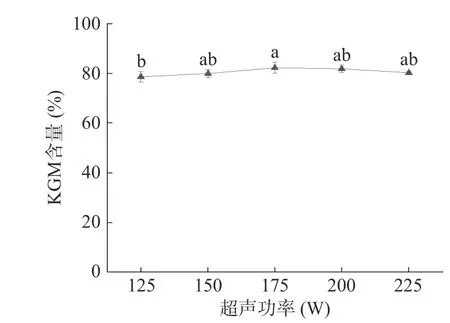
图4 超声功率对KGM 含量的影响Fig.4 Effect of ultrasonic power on the content of KGM
2.1.5 超声时间对KGM 含量的影响 由图5 可知,随超声时间达到60 min,KGM 含量逐渐升高至88.75%,随后下降。因为在超声时间较短的条件下,KGM 与其他分子物质结合紧密,分子链未能完全打开,杂质也未能完全释放。而长时间的超声作用又使KGM 的结构不稳定,空化作用导致分子链遭到破坏[5,31],KGM 含量因此下降。通过统计学分析,超声时间对KGM 含量的影响有显著差异(P<0.05),其中超声时间为60 min 时极显著,选取超声时间45、60、75 min 进行响应面试验。
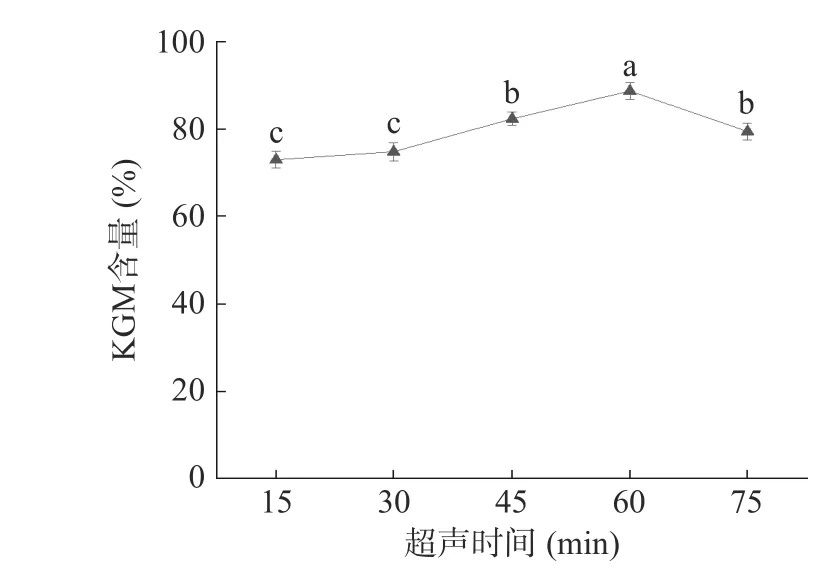
图5 超声时间对KGM 含量的影响Fig.5 Effect of ultrasonic time on the content of KGM
2.2 响应面试验结果分析
参考Box-Behnken 原理,优化试验设计结果如表2 所示。

表2 响应面试验设计及结果Table 2 Response surface experimental design and results
根据表2 中的数据对试验结果回归拟合,得到模型对应的回归方程为:Y=88.22-1.8A+6.41B-2.21C-0.22AB+1.98AC-0.48BC-13.19A2-13.59B2-6.77C2,对二次回归方程进行方差分析,结果见表3。
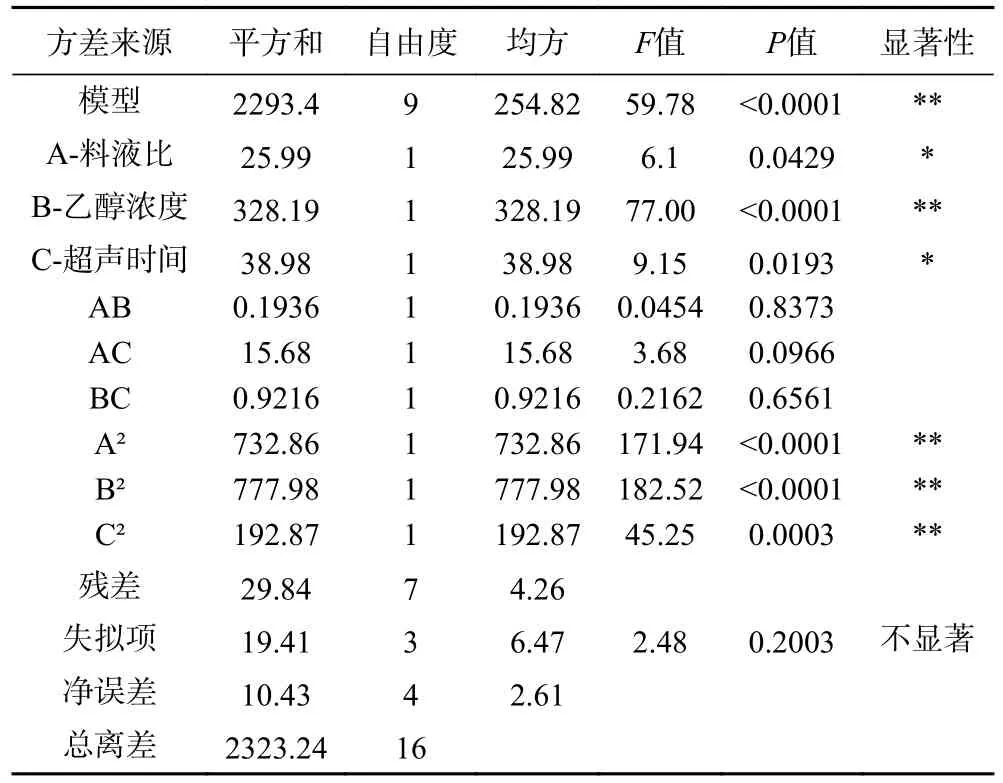
表3 回归模型的方差分析Table 3 Analysis of variance in regression model
由表3 结果分析可知,失拟项不显著(P=0.2003),且本试验所采用的回归模型是极显著水平(P<0.01),因此该模型可取。R2adj=0.9872,意味着该模型可信度较高。一次项B 差异极显著(P<0.01),A、C 差异显著(P<0.05),二次项A2,B2,C2对含量的影响极显著(P<0.01);各试验条件下三个因素影响KGM 含量的程度大小为:乙醇浓度>超声时间>料液比。
根据回归方程,做出响应面交互效应图,如图6~图8 所示。
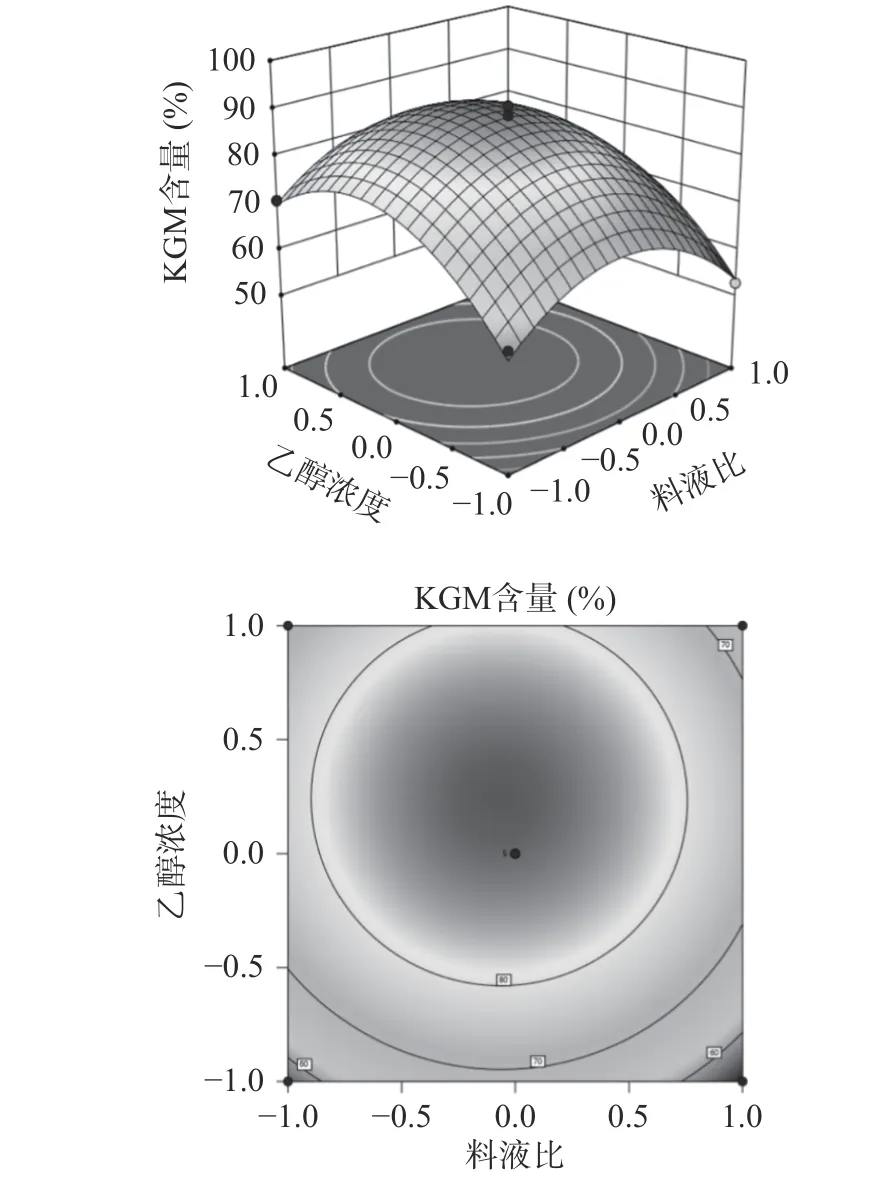
图6 料液比、乙醇浓度交互项对KGM 含量的影响Fig.6 Influence of material-liquid ratio and ethanol concentration interaction on the content of KGM
图6 响应面图可以看出,乙醇浓度比料液比的坡度稍陡峭,结合等高线图,乙醇浓度轴向的等高线较密集,表明与料液比相比,乙醇浓度的影响稍显著。较椭圆形的等高线图和陡峭的响应面图,说明了料液比和乙醇浓度具有交互效应。在不改变超声时间、超声温度和超声功率的条件下,随料液比的增加和乙醇浓度的升高,KGM 含量会先升高达到峰值后再减小。
图7 响应面图可以看出,超声时间比料液比的坡度更为陡峭,结合等高线图,超声时间轴向的等高线更加密集,表明超声时间对KGM 含量的影响更为显著。椭圆形的等高线图和陡峭的响应面图,说明了料液比和超声时间的交互作用较强。在不改变乙醇浓度、超声温度和超声功率的条件下,随料液比的增加和超声时间的延长,KGM 含量会先升高达到峰值后再减小。
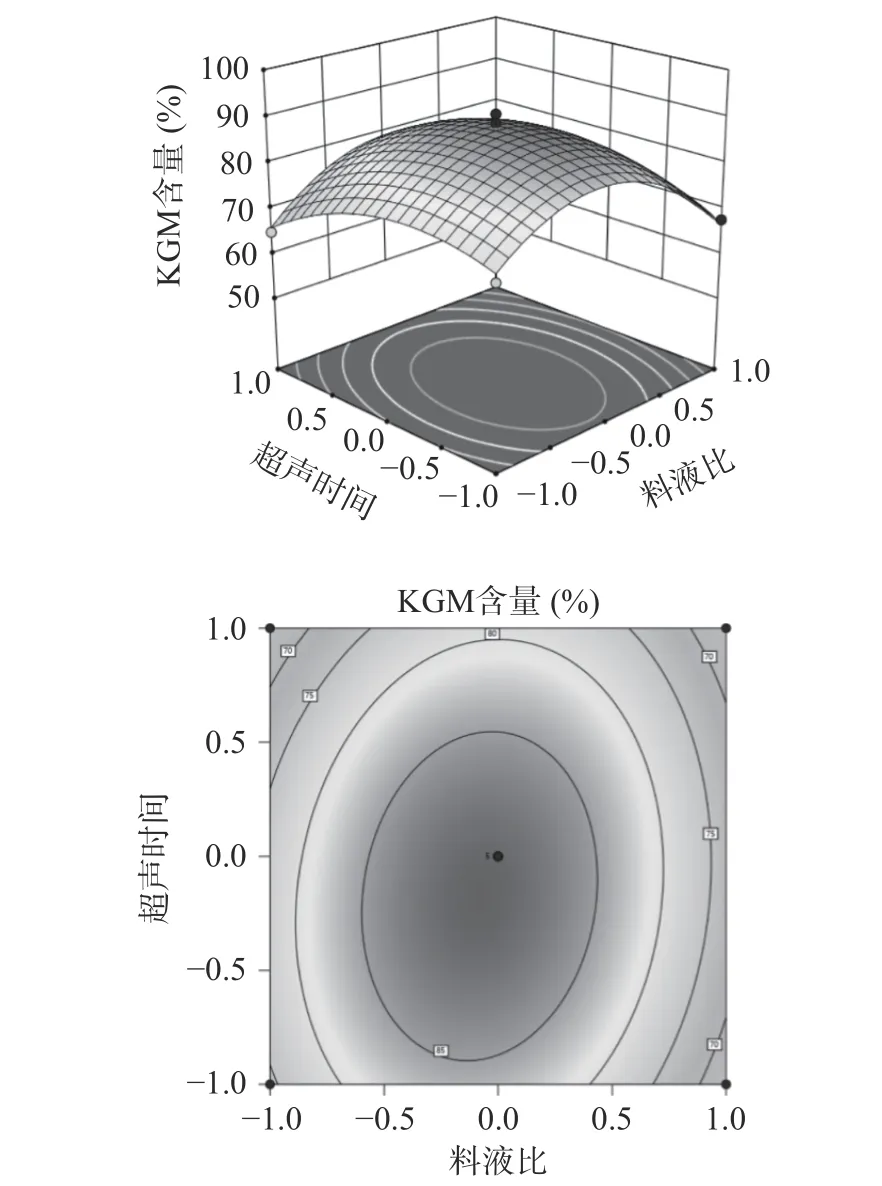
图7 料液比、超声时间交互项对KGM 含量的影响Fig.7 Influence of material-liquid ratio and ultrasonic time interaction on the content of KGM
图8 所示响应面图可以看出,乙醇浓度比超声时间更陡峭,结合等高线图,乙醇浓度轴向的等高线更密集,表明与超声时间相比,乙醇浓度对KGM 含量的影响更显著。椭圆形的等高线图和陡峭的响应面图,说明了乙醇浓度和超声时间交互效应较强。在不改变其他条件的基础上,超声时间的延长和乙醇浓度的升高会使KGM 含量先升高达到峰值后再减小。
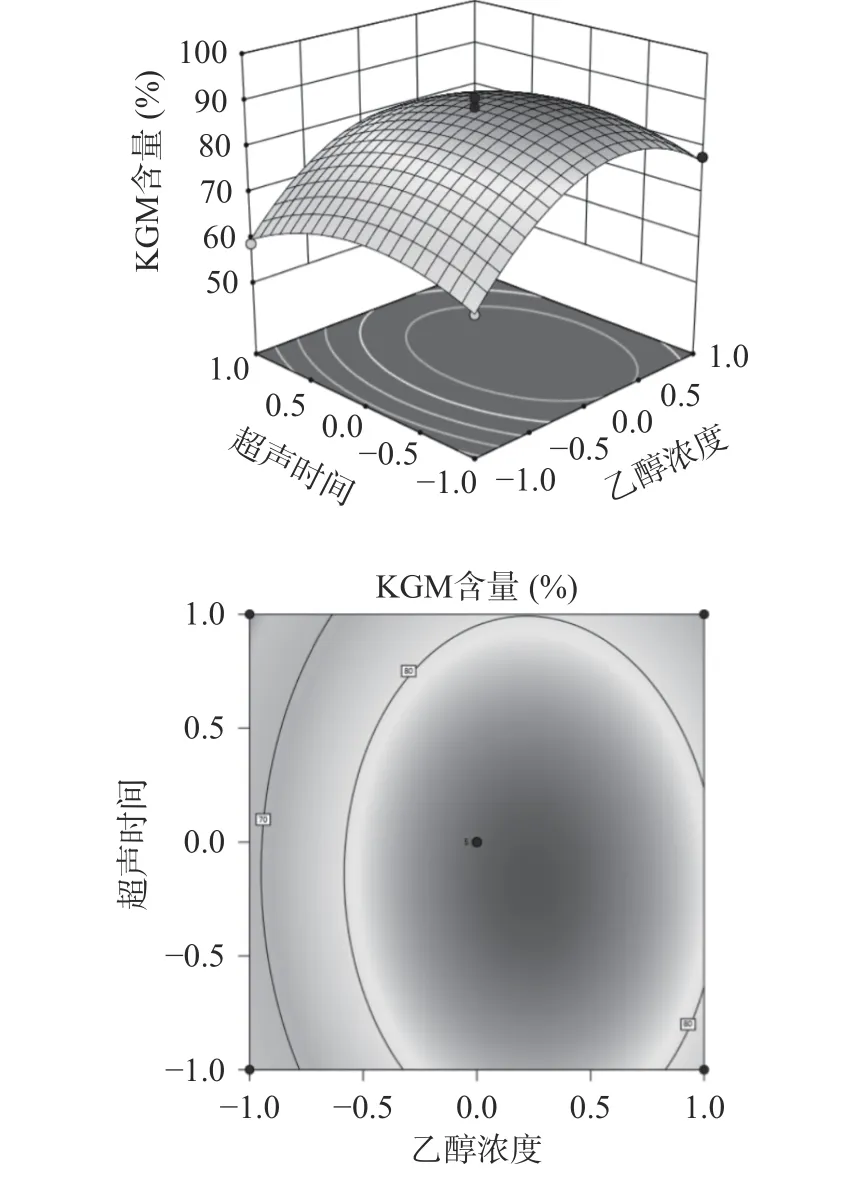
图8 乙醇浓度、超声时间交互项对KGM 含量的影响Fig.8 Influence of ethanol concentration and ultrasonic time interaction on the content of KGM
利用Design-Expert 软件得出,魔芋粉最佳纯化条件是料液比1:101.538(g/mL),乙醇浓度72.777%,超声时间为54.808 min,KGM 含量可达88.672%。根据实际操作进行修整,料液比、乙醇浓度、超声时间分别为1:102(g/mL)、73%和55 min,通过三次验证实验得到KGM 含量为88.1%±1.05%,与预测值较为接近,说明优化模型是合理可行的。
经公式(1)计算纯化前KGM 含量为59.70%±0.97%,纯化后含量为88.1%±1.05%;经公式(2)计算纯化前KGM 得率为52.24%±1.29%,纯化后得率为62.93%±1.73%。因此,工艺优化后KGM 含量与得率均显著提高。
2.3 结构表征
2.3.1 FT-IR 图谱分析 为了解纯化前后官能团的变化情况,采用傅里叶红外光谱仪对其结构进行探测[36],如图9 红外图谱所示,吸收峰的形状以及出现位置大致相同,未出现新的吸收峰,这与所报道的结果一致[37]。KGM 中-OH 的伸缩振动峰出现在3000~3700 cm-1之间,这是多糖的特征峰[38]。在2800~3000 cm-1范围内的峰由-CH3和-CH2基团中的-CH 键拉伸所产生。在1647 cm-1处的吸收带代表分子内氢键的特征峰。

图9 纯化前后KGM 的傅里叶红外光谱图Fig.9 FT-IR spectrum of KGM before and after purification
2.3.2 XRD 图谱分析 如图10 所示,纯化前后KGM的XRD 图谱在2θ处于4°~40°间均未表现出明显的结晶峰,在2θ处于20°左右时均出现一个较宽的弥散峰,与报道所述一致[39]。此外,没有观察到新的特征峰的出现,说明纯化工艺对KGM 结构、结晶度以及氢键作用力的影响微弱[39]。

图10 纯化前后KGM 的X 射线衍射图Fig.10 X-ray diffraction pattern of KGM before and after purification
3 结论
本研究通过单因素和响应面试验确定魔芋粉最佳纯化工艺条件:超声时间、乙醇浓度、料液比、超声温度和超声功率分别为55 min、73%、1:102(g/mL)、50 ℃、175 W,该条件下KGM 含量与模型预测值相差较小,达到88.1%±1.05%。经计算该工艺条件下KGM 得率为62.93%。随后对其优化前后的结构进行表征,对比两者的FT-IR 图谱和XRD 图谱,未发现明显差异,证明该优化工艺对KGM 结构影响较弱。因此在不改变KGM 结构的前提下,应用该工艺可以更加低廉、高效、无损地对魔芋粉进行纯化,得到纯度更高的KGM,为其应用于食品药品等行业加工生产提供基础理论和研究方向。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

