高分辨率CT评估免疫治疗相关性肺炎患者诊疗效果及预后研究
夏广明,陈锦灿,黄嘉敏,温中炎,黄少健,练英妮
(肇庆市第一人民医院 影像科,广东 肇庆 526020)
免疫检查点抑制剂可靶向特定分子来使免疫应答增强,免疫检查点抑制剂多为程序性死亡[蛋白]-1(PD-1)抑制剂纳武单抗和帕姆单抗、程序性死亡配体1(PD-L1)抑制剂阿特珠和德瓦鲁单抗等[1]。PD-1 抑制剂可对恶性肿瘤细胞患者机体内的免疫细胞予以激活,破坏免疫机制,从而增强组织免疫活性,对于患者预后的改善有促进作用[2]。但采用免疫检查点抑制剂治疗也存在一定的不足之处,免疫系统被激活后可引发肺炎、垂体炎、等免疫相关不良事件[3]。免疫相关性肺炎是恶性肿瘤患者经过免疫检查点抑制剂治疗后出现的一种较为少见的并发症,可使免疫检查点抑制的治疗效果受影响,严重者甚至引发死亡[4]。高分辨率计算机断层扫描(CT)检查可对肺部实质予以清晰地反映,有相关报道指出,高分辨率CT 不仅可用于间质性肺炎的诊断,还可对疾病的治疗及预后进行评估[5]。本研究重点探讨了高分辨率CT 评估免疫治疗相关性肺炎患者诊疗效果及预后,现报道如下。
1 资料与方法
1.1 一般资料
2021 年5 月至2023 年5 月于肇庆市第一人民医院进行免疫治疗的恶性肿瘤患者1 205 例,其中32 例治疗后并发免疫相关性肺炎,将所有患者的临床资料采用回顾性分析的方式,其中男19 例,女13 例;年龄50~80 岁,平均(62.85±6.40)岁;TNM 分期[6]ⅢA 期7 例,Ⅳ期25 例;8 例Ⅳ期非小细胞肺癌患者存在化疗后续贯胸部放疗史;有吸烟史的患者24 例。
纳入标准:所有患者均为恶性肿瘤者(经病理诊断确诊);均存在PD-1 抑制剂治疗史者,其中有20 例患者在上述基础上还联合了放化疗;按照患者临床表现及CT 影像表现、免疫检查点抑制剂药物治疗史,将肺栓塞、心功能不全者等诊断为免疫相关性肺炎。排除标准:合并其他原因导致肺炎的患者;临床资料不齐全者等。
1.2 方法
1.2.1 检查方法 采用64 排螺旋CT 机对所有患者进行高分辨率计算机断层扫描,患者体位为仰卧,嘱患者深呼吸后屏气之后开始对其进行扫描,从肺尖直至肺底,将各参数进行设置,包括对管电流、管电压进行设置,层间距为10 mm,层厚则设置为2 mm。
1.2.2 免疫相关性肺炎的分级与分型 根据美国临床肿瘤学会中的相关判定标准对患者进行分级与分型。
1.2.3 临床分级 按照患者的临床表现等进行分级,其中患者未出现症状,且病变范围只在1 个肺叶之内为1 级;患者临床症状较为严重,吸氧需求大大增加;患者临床表现较为严重,病变范围甚至全部覆盖全部肺叶为3 级,患者出现呼吸受损,甚至威胁至生命安全为4 级。
1.2.4 影像学分型 由两名经验丰富的医生对高分辨率CT 检查的影像学表现进行观察,其中包括病灶的位置、分布、面积、胸膜增厚等,如在观察时意见存在不一致的地方,则需商讨后下定论。各分型的影像学表现如下:①片状、絮状稍高密度影在患者双肺弥漫分布,其密度处于正常肺和血管中间,仍可观察到内支气管血管束为磨玻璃型。②在斑片亚型中散落,病灶呈结节状致密影,只在一个肺叶内,在病变的早期阶段大部位在胸膜的下面,病变范围占全部肺部的1/4 以下,同时可伴有胸腔积液;病变范围占全肺的1/4 以上,影像学表现为斑片状或索条状致密影,多合并胸腔积液为实变型。③患者在病变的早期只在单个肺叶,主要表现为细网格状高度密影,随着病情的变化,病变的范围也不在不断地扩大,呈蜂窝状,肺间质表现为囊状结构的叠加,多合并支气管扩张。
1.3 观察指标
①免疫检查点抑制剂治疗情况分析。②分析典型免疫相关性肺炎患者临床症状及影像学表现。③对免疫相关性肺炎出现的时间、诊疗效果及预后进行分析。
1.4 统计学方法
采用SPSS 24.0 统计软件处理数据。计数资料以百分率(%)表示,采用χ2检验;计量资料以均数±标准差()表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 典型病例影像学图片分析
患者1,男,47 岁,原发肿瘤为肺癌,经单抗治疗6.0 个月后,胸部影像学显示双肺胸膜下有斑片状、网格状致密影分布,分型为网格型,见图1。患者2,男,61 岁,原发肿瘤为肺癌,经单抗治疗2.0 个月后,胸部影像学显示为片状磨玻璃影分布,分型为磨玻璃型,见图2。
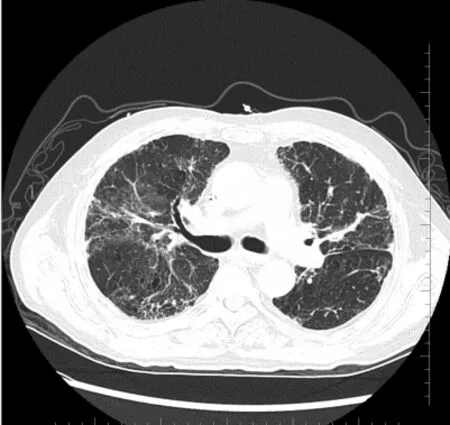
图1 典型病例1 胸部CT 影像学表现
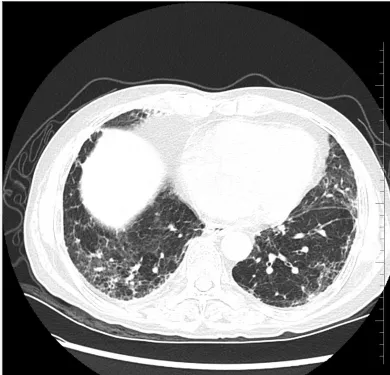
图2 典型病例2 胸部CT 影像学表现
2.2 32 例免疫相关性肺炎患者免疫检查点抑制剂治疗情况分析
14 例非小细胞肺癌患者及6 例肺部低分化肉瘤样癌均采用纳武力尤单抗注射液静脉滴注治疗,用药剂量为3 mg/kg,治疗频次为每半个月1 次;12 例非小细胞肺癌患者采用信迪利单抗静脉滴注治疗,剂量为200 mg/次,频次为每21 d 1 次。
2.3 32 例免疫相关性肺炎患者临床症状及影像学表现
32 例免疫相关性肺炎患者的临床分级情况为:2 级3 例,3 级20 例,4 级9 例;12 例为对称分布,而20 例为非对称分布;患者分型情况如下:20 例为磨玻璃型;6 例为实变型;6 例为网格型;其中有23 例伴有胸膜变厚,23 例纵隔淋巴结受累,12 例伴有支气管扩张,9 例伴有小叶间隔变厚,9 例伴有多发小叶中心结节,3 例伴有胸腔积液;其中10 例为纤维化。
2.4 免疫相关性肺炎出现的时间、诊疗效果及预后
32 例中位免疫相关性肺炎出现的时间为采用免疫检查点抑制剂治疗后5 个月,经诊断证实后停止采用免疫抑制剂治疗。其中有6 例右肺非小细胞癌患者采用免疫检查点抑制剂治疗后5 个月出现免疫相关性肺炎3 级。采用120 mg/d 甲泼尼龙对患者进行静脉滴注治疗,治疗两周后,患者有感染、气胸等表现,在上述药物的基础上加用3.0 g/d 亚胺培南西司他丁钠、0.4 g/d 替考拉宁对患者进行静脉滴注8 d 后,患者的病情未见改变。19 例右肺非小细胞癌患者采用免疫检查点抑制剂治疗半天后出现了免疫相关性肺炎3 级,采用80 mg/d甲泼尼龙对患者进行治疗,治疗7 d 后患者临床症状明显好转,采用高分辨率CT 对患者复查后发现双肺的病灶吸收,于1 个月后对患者采用注3 mg/kg纳武力尤单抗注射液治疗后临床分级为4 级,之后采用10 g/d 丙种球蛋白静脉注射、400 mg/d 盐酸莫西沙星静脉滴注,并在此基础上加用500 mg/d甲泼尼龙静脉滴注3 d,患者病情未见好转。6 例右肺非小细胞癌采用免疫检查点抑制剂治疗4 个月后出现免疫相关性肺炎4 级,采用500 mg/d 甲泼尼龙静脉滴注3 d 之后再对患者静脉滴注4.0 g/d头孢唑肟钠、400 mg/d 盐酸莫西沙星静脉滴注,患者治疗5 d 后病情未见好转。其余的1 例患者出现免疫相关性肺炎的时间分别为采用免疫检查点抑制剂治疗后2、10 个月后,对患者采用60 mg/d甲泼尼龙静脉滴注治疗半个月后患者临床症状有所好转,之后改为泼尼松口服,剂量为30 mg/d,逐渐减少用药剂量,直至10 mg/d 以内,患者连续治疗6 周后停止治疗。
3 讨论
PD-1 抑制剂主要通过对免疫抑制信号的阻断作用,从而促进患者抗肿瘤免疫应答的恢复,临床多用于晚期非小细胞癌患者的治疗中,但患者在使用该类药物治疗时,也可能出现一些不良反应,其中以免疫相关性肺炎最为严重[7]。免疫相关性肺炎多出现于恶性肿瘤患者在采用PD-1 抑制剂治疗后几个月,中位时间为2.8 个月[8]。本研究中结果得出,32 例中位免疫相关性肺炎出现的时间为采用PD-1 抑制剂治疗后5 个月,与之前的报道并不相符,其原因可能在于本研究选取的病例数较少。
临床有报道指出,发生免疫相关性肺炎的患者中,3 级以上免疫相关性肺炎的发生率较高[9]。其中3 级免疫性相关肺炎患者的主要临床症状为咳嗽、胸闷气促、呼吸困难等;而经高分辨率CT检查显示主要呈现为弥漫性实质性肺疾病的表现,其中有机化性肺炎、变应性肺炎等。本研究中7例患者临床症状均表现为呼吸困难、胸闷等。有一项关于恶性肿瘤患者采用免疫检查点抑制剂治疗后的研究发现,免疫相关性肺炎的发生率在2.8%左右,且患者的临床表现、影像学表现呈现出不同的特征[10]。有学者报道指出,非小细胞肺癌患者发生免疫相关性肺炎的风险较高,这是由于患者有吸烟史,以及肺部疾病史[11]。
免疫相关性肺炎的诊断属于排他性诊断,对于该疾病的诊断需要符合以下条件:存在免疫检查点抑制剂治疗史;临床症状多为咳嗽、呼吸困难等,也可合并发热等;在对患者进行高分辨率CT 检查时可呈现为快速进展的磨玻璃型、实变型等;需对肺栓塞、心功能不全的患者予以排除[12-13]。本研究中对32 例免疫相关性肺炎患者临床症状及影像学表现进行了分析发现,2 级3 例,3 级20 例,4 级9 例;12 例为对称分布,而20 例为非对称分布;患者分型情况如下:20 例为磨玻璃型;6 例为实变型;6 例为网格型;其中有23例伴有胸膜变厚,23 例纵隔淋巴结受累,12 例伴有支气管扩张,9 例伴有小叶间隔变厚,9 例伴有多发小叶中心结节,3 例伴有胸腔积液,与上述研究基本相符。
免疫相关性肺炎的出现除了是因为采用免疫检查点抑制剂治疗所引发,其他发病原因尚不明确。因此,针对采用免疫检查点抑制剂治疗的恶性肿瘤患者,临床需对患者出现的症状及影像学表现密切监测,使得免疫相关性肺炎及早被发现,并及时采取相关的治疗措施。对于已经明确诊断为免疫相关性肺炎的患者,应停止采用免疫检查点抑制剂的治疗[14-16]。本研究中免疫相关性肺炎出现的时间、诊疗效果及预后进行分析发现,32例患者均停止采用PD-1 抑制剂治疗,应用糖皮质激素连续治疗1~6 周,仅有4 例出院,可能原因在于患者病情程度较为严重。
综上所述,采用高分辨率CT 可以免疫性肺炎进行诊断,并且有助于对患者进行准确分级、分型,对于已经明确诊断的免疫相关性肺炎患者,应立即停止PD-1 抑制剂治疗,之后采用糖皮质激素对患者进行治疗,必要时还可联合抗生素治疗。

