巨噬细胞极化在肝纤维化中的调控作用机制
白小洋, 张旭, 海龙, 丁向春
1 宁夏医科大学总医院 a.感染科, b.医学科学研究院外科学研究室, 银川 750000
2 宁夏医科大学临床医学院, 银川 750000
肝星状细胞(HSC)的活化被认为是肝纤维化的中心事件,其中活化的HSC转分化为肌成纤维细胞并分泌大量沉积在细胞之间的细胞外基质(ECM),导致肝纤维化[1]。HSC是肝纤维化发病机制中的关键细胞,但某些免疫细胞如T和B淋巴细胞、NK细胞和巨噬细胞也发挥了重要作用[2]。其中,巨噬细胞是最丰富的肝免疫细胞,在肝损伤和随后的肝纤维化过程中也起着关键作用[3]。
巨噬细胞是先天免疫系统的重要组成部分,巨噬细胞的激活已被证明在某些方面是不可缺少的,如免疫防御、炎症反应、组织重塑和稳态[4]。巨噬细胞在不同因素的刺激下分化为不同的表型,表现出不同的特征和作用,从而在机体的生理和病理活动中发挥不同的调节功能,这也被称为巨噬细胞的极化效应[5]。
近年来,大量文献表明巨噬细胞在许多病理生理过程中起着至关重要的作用,如炎症、肿瘤、组织修复和代谢[6-8]。这些病理过程也发生于肝纤维化中,这表明巨噬细胞可能对肝纤维化的发展和逆转起着关键作用[9-11]。随着进一步研究肝纤维化中巨噬细胞的作用,通过靶向巨噬细胞来阻断甚至逆转纤维化病理改变,已被认为是治疗肝纤维化的潜在策略[12]。然而,肝巨噬细胞的起源和巨噬细胞极化的机制是复杂的,它们对不同类型的肝病,甚至对一种肝病的不同阶段的影响并不相同[13]。此外,在肝纤维化的病理过程中,巨噬细胞可以分化为具有促炎功能的M1型,以及具有促纤维化和组织重塑作用的M2型。探讨巨噬细胞极化在肝纤维化中的作用机制,以期为肝纤维化的防治提供新的思路。
1 巨噬细胞概述
1.1 巨噬细胞的来源 巨噬细胞按照来源不同可以分为Kupffer细胞和单核细胞衍生巨噬细胞两类。Kupffer细胞多来源于胚胎卵黄囊细胞、骨髓造血干细胞,有自我维持性、局部增殖性和致耐受性等,单核细胞衍生巨噬细胞多由外周血中循环的单核细胞分化而来,更容易接受信号来促进其功能的分化和浸润。在肝损伤时,Kupffer细胞与单核细胞衍生巨噬细胞有着不同的作用,Kupffer细胞具有吞噬有害物质和调节肝脏免疫反应的哨兵功能,单核衍生巨噬细胞则主要产生炎性因子,并调节肝脏炎症和创伤修复[5-14]。
1.2 巨噬细胞的分型及功能 按照功能异质性常分为M1和M2型巨噬细胞,M1型巨噬细胞多为促炎和抗肿瘤表型,能被脂多糖(LPS)刺激而激活,表达一系列促炎的细胞因子和招募其他免疫细胞的趋化因子如TNF-α、IL-1β、IL-12、CCL2和活性氧(ROS),在纤维化过程中的肝损伤期起促炎作用。相反,M2型巨噬细胞多具有抗炎和促肿瘤作用,能被IL-4、IL-13等细胞因子极化,促进组织修复、重塑与血管生成等,在肝纤维化过程中的肝修复期起抗炎作用。M2型巨噬细胞根据激活条件的不同,还能再分为M2a、M2b、M2c和M2d四个亚群,M2a亚群主要受IL-4、IL-13激活,能产生CD206、IL-1Ra等,发挥抗炎与组织重塑的功能;M2b亚群主要受Toll样受体激动剂或免疫复合物激活,能产生IL-10、IL-6、TNF-α等,既有抗炎也有促炎的作用;M2c主要受糖皮质激素和IL-10激活,能产生大量IL-10与TGF-β,有较强抗炎活性,主要介导对凋亡细胞的吞噬作用;M2d亚群是利用Toll样受体激动剂通过腺苷受体刺激产生,包括VEGF与IL-10,有促进血管生成的作用[5-14]。在慢性肝病发展时,巨噬细胞会根据炎症和纤维化的程度及时间发生动态变化,产生不同表型。在纤维化进程中,M1型巨噬细胞通常会先出现,针对损伤区域释放一系列促炎因子,而持续高水平的M1型会造成组织的损伤。当M1型巨噬细胞到达峰值时,M2表型会被激活,通过释放抗炎因子,促进组织的修复、重塑与血管生成。可以说M1与M2型巨噬细胞极化的平衡决定了肝纤维化的发生发展与结局。巨噬细胞可以在不同的局部微环境下极化成不同的亚群,在肝纤维化组织炎症和损伤的起始、进展中发挥重要作用[12]。
2 巨噬细胞极化的机制
2.1 Notch信号通路 Notch信号通路包括一系列高度保守的表面受体,参与细胞增殖和凋亡,影响各种生物器官和组织的发育。研究[15]发现,M1型巨噬细胞的Notch1受体表达显著增加,而抑制Notch1受体导致M1极化减少,M2极化增加。近年来,大量文献报道,许多药物可以通过靶向Notch信号通路来调节巨噬细胞的极化。例如,黄芪多糖激活Notch信号通路,诱导M1极化[16]。此外,Zheng等[17]发现,Notch1/Jagged1信号通路可以抑制血吸虫感染诱导的M2极化。因此,这提示Notch/Jagged1通路可能是与M2型巨噬细胞极化相关的一些疾病的治疗靶点。
2.2 TGF-β/Smad信号通路 TGF-β首先作用于Ⅱ型受体,然后与Ⅰ型受体结合形成受体复合物,导致Ⅰ型受体结构域的磷酸化,从而通过激活其下游信号分子(Smad2和Smad)来调节相关基因的表达[18]。TGF-β家族的生长分化因子3通过促进Smad2和Smad3的磷酸化,抑制M1、促进M2型的极化。同样,也有多项研究分析TGF-β/Smad信号通路在促进M2型巨噬细胞极化中的作用。例如,研究[19]发现,槲皮素通过抑制TGF-β1-Smad2/3通路来抑制M2型的极化。实验[20]表明,Smad3可以被巨噬细胞吞噬直接激活,而独立于TGF-β,这可能是通过过氧化物酶体增殖物激活受体(PPAR)促进巨噬细胞向抗炎表型极化。
2.3 Janus激酶(JAK)/信号转导和转录激活因子(STAT)信号通路 JAK/STAT通路主要介导细胞因子受体的信号转导[21]。IFN-γ与受体结合并激活JAK,诱导STAT1的磷酸化,从而导致巨噬细胞极化为M1[22]。IFN-γ还可以促进M1巨噬细胞的代谢开关,进而通过JAK/STAT1途径增强其细胞活力和促炎活性[23]。JAK/STAT6是IL-4抑制M1并诱导M2极化的重要途径[24]。例如,姜黄素通过分泌IL-4和IL-13来上调STAT6的表达,从而诱导M0和M1巨噬细胞极化为M2[25]。此外,STAT3对M2巨噬细胞的极化具有重要作用。研究[26]表明,抑制IL-6/STAT3和JAK3/STAT3信号通路可导致巨噬细胞从M2表型向M1表型极化。综上所述,M1巨噬细胞的极化与STAT1的磷酸化密切相关,而M2的极化主要依赖于STAT3和STAT6表达的增加。
2.4 微小RNA(microRNA) 根据目前的研究,microRNA对巨噬细胞极化的作用已经逐渐被强调,主要依赖于对其他信号通路的调控。例如,miR-221-3p通过抑制JAK3/STAT3信号通路促进M2巨噬细胞向M1表型极化[26]。miR-1246通过靶向TERF2IP诱导M2极化,激活STAT3,抑制NF-κB[27]。此外,miR-30c、miR-99a和miR-155均被证明可以抑制M1巨噬细胞的极化,而miR-let7和miR-32则有助于M2的极化[28-29](图1)。
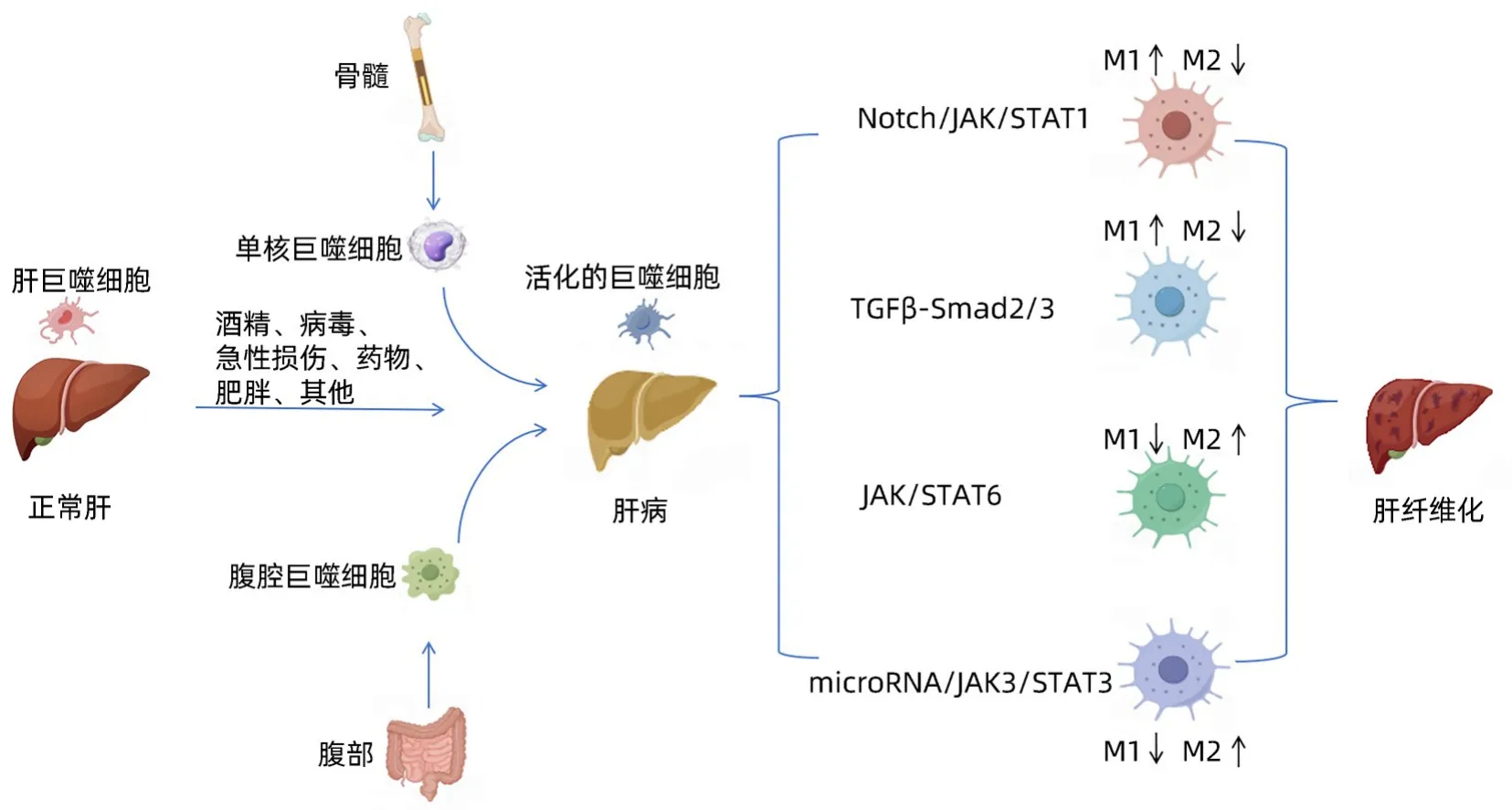
图1 巨噬细胞极化在肝纤维化中的调控作用机制Figure 1 The regulatory mechanism of macrophage polarization in liver fibrosis
3 巨噬细胞在肝纤维化中的调控机制
巨噬细胞与HSC的交互作用在肝纤维化进程中起着关键作用,两者通过产生各种细胞因子和趋化因子调节HSC的表型,从而导致纤维化表型的出现和细胞外基质的沉积。同时,相关研究表明,巨噬细胞浸润的阻断或耗竭能减少HSC的激活,延缓纤维化的进程。肝巨噬细胞能产生一系列与促纤维化相关的细胞因子和趋化因子,包括细胞因子TGF-β、血小板衍生生长因子(PDGF)、抗血管内皮生长因子(VEGF)、TNF-α、IL-1β;趋化因子CCL2、CCL3、CCL5。同样,浸润的单核/巨噬细胞也能产生抗纤维化的介质,如MMP-12、MMP-13等。HSC的激活是细胞外基质的主要来源,也是肝纤维化形成的中心环节[30]。HSC激活的起始和持续时间直接受到肝巨噬细胞的调控。一方面,巨噬细胞激活HSC,促进肝纤维化的进展[31]。另一方面,在肝纤维化逆转过程中,巨噬细胞可驱动HSC凋亡和细胞外基质降解[32]。巨噬细胞调控肝纤维化的机制很复杂,涉及多种通路和信号分子。其中,Notch信号通路与多种细胞活性密切相关,通过调节星状细胞活化和巨噬细胞极化在肝纤维化中发挥重要作用。Bansal等[33]通过实验证明,抑制Notch通路有助于减少M1型巨噬细胞,促进M2型巨噬细胞极化,以及减少HSC和成纤维细胞的活化。在血吸虫感染诱导的肝纤维化中,Notch通路抑制了M2型巨噬细胞的极化,从而改善了肝纤维化[19]。
目前,骨髓间充质干细胞移植是一种很有前途的抗纤维化策略。Watanane等[34]表明骨髓间充质干细胞可诱导骨髓源性巨噬细胞M2极化,在逆转肝纤维化中发挥协同作用。同样,Luo等[35]发现骨髓间充质干细胞移植可促进巨噬细胞M2极化,抑制巨噬细胞M1极化,增加MMP-13表达,抑制HSC的活化,具有协同抗肝纤维化作用。随后,进一步的研究发现,TNF刺激的基因6是骨髓间充质干细胞发挥抗纤维化作用的主要细胞因子[36-37]。此外,在肝纤维化的发生发展过程中,增加的NKp46+细胞产生IFN-γ,诱导M1型巨噬细胞极化,限制了M2极化和促纤维化因子的产生,从而抑制代谢相关肝纤维化的发生[38]。
4 总结与展望
肝巨噬细胞具有显著的异质性,是由多种来源的巨噬细胞组成。目前的研究表明,巨噬细胞主要极化为两种表型,促炎M1型和抗炎M2型[39]。具体来说,M1和M2型巨噬细胞在被各自的激活物诱导后,产生大量的促炎或抗炎细胞因子和趋化因子,从而作用于不同的靶点,激活与多个病理过程相关的信号通路,发挥其调节功能。巨噬细胞的极化主要与Notch、TGF-β/Smad、JAK/STAT和microRNA信号通路相关。此外,TLR4/NF-κB、MAPK、mTOR等其他信号通路也可能参与其中。因此,靶向这些信号通路可能会调节巨噬细胞的极化,从而改变巨噬细胞在肝纤维化中的作用。
肝纤维化典型特征是细胞外基质在肝脏中过度沉积,不同表型的巨噬细胞对不同类型的肝纤维化有不同的作用。一般而言,M1型巨噬细胞促进CCl4诱导的肝纤维化,抑制血吸虫感染诱导的肝纤维化,但M2型巨噬细胞的作用则相反。然而,M1型极化的增加或M2型极化的减少有时也可减轻CCl4诱导的肝纤维化[9]。此外,肝纤维化治疗中常用的骨髓间充质干细胞移植也依赖于巨噬细胞极化的调节。因此,巨噬细胞的极化可能在肝纤维化中起着不可或缺的作用。
以肝巨噬细胞作为治疗肝纤维化的靶点,为抗肝纤维化治疗提供了新思路,进一步研究肝巨噬细胞在肝纤维化中的调控机制有助于更好地探究肝纤维化病理机制,同时对于开发安全有效、敏感性高、针对性强的抗纤维药物具有重要意义。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:白小洋负责撰写与修改论文;海龙参与查阅相关文献;丁向春、张旭负责拟定写作思路,指导撰写文章并最后定稿。

