小麦籽粒镉元素含量全基因组关联分析及候选基因预测
王健胜 时夏 周正富 马爱锄 王二伟 侯桂玲 晁岳恩 李文旭 王亚欢 吴政卿 雷振生


摘 要 以国内外207份小麦种质为材料,利用660K SNP芯片对其进行基因型检测,并结合不同环境下表型数据和最佳线性无偏预测值 (BLUP,Best linear unbiased prediction) 对小麦籽粒镉元素含量进行全基因组关联分析。结果表明:与小麦籽粒镉元素含量显著关联的SNP 310个,这些SNP分布于除3D和4D外的19条染色体上,单个SNP解释变异率为10.95%~14.66%。不同环境下检测到的关联SNP结果存在差异,其中在原阳地区检测到186个SNP,开封地区检测到71个SNP。基于BLUP值分析获得53个SNP。基于SNP物理位置,将距离较近的SNP进行整合,共获得有效QTL位点52个。同时发现了7个在多环境下表现稳定的SNP,并对其进行单标记效应分析。最后对基于获得的关联SNP进行了候选基因预测,共获得7个与小麦籽粒镉元素含量相关的候选基因,其中 TraesCS1B01G321700和TraesCS1B01G320200可能与镉元素调控相关基因转录有关,而TraesCS7B01G459000和TraesCS7B01G456900可能与镉元素的吸收和转运等代谢过程有关。还筛选出了对镉具有良好避性的部分小麦优异种质,如‘云麦51‘郑麦379‘白穗白‘云麦53‘双丰收。
关键词 小麦;Cd含量;SNP芯片;全基因组关联分析
品质安全是小麦生产的重要前提,也是保障国民健康的基础。然而近年来随着环境污染问题的日益凸显,重金属污染已经成为影响小麦品质及小麦安全生产的主要因素之一[1-6]。镉是环境中常见的重金属,也是人体非必需元素,进入人体的镉会在肾、肝等器官蓄积并引起相关疾病[7]。一般而言,镉主要存在于土壤、水等环境介质中,这些镉会被小麦吸收并转移至籽粒等食用组织器官[8-9],故开展小麦籽粒镉含量分析并探索其遗传控制机制是保障小麦品质安全的重要课题,其已经引起国内外研究者的重视[10-11]。但国内有关小麦籽粒镉遗传机制研究报道甚少,只有国外学者在此方面开展了部分研究。Yusuke等[12]利用Chugoku 165×Chukei10-22的DH群体对小麦籽粒中镉浓度进行了QTL定位,在4B和6B染色体上检测到两个稳定且遗传效应显著的QTL。Safdar等[13]利用90 K SNP芯片对120个春小麦种质组成的关联群体进行了籽粒镉含量分析,结果在1A、1D、2B和6D上共检测到5个与镉吸收显著关联的QTL位点。Hussain等[14]利用关联分析方法在小麦2A和2B染色体上发现2个与籽粒镉元素浓度相关的QTL。也有部分学者开展了小麦镉相关基因的研究[15-16]。基于此,本研究以国内外收集的207份小麦种质为材料,利用小麦660K SNP芯片进行了小麦籽粒镉浓度的全基因组关联分析,以期为小麦镉含量控制及优异抗镉新品种培育提供一定科学基础和有效材料。
1 材料与方法
1.1 试验材料及其田间种植
本研究关联分析群体共包含207个小麦种质/品种,其来自8个国家,包括中国、俄罗斯,法国、保加利亚、罗马尼亚、墨西哥、澳大利亚和日本,国内的小麦种质均来自中国主要小麦种植区(包括陕西、甘肃、河南、北京、四川、山东、贵州、河北、江苏、山西、云南、安徽、湖北、宁夏和黑龙江)。这些小麦材料主要由审定品种、地方种质以及国外引进的小麦品种或种质组成(表1),均由河南农科院小麦研究所提供。2017-2018年将关联分析群体分别种植于河南省开封和原阳,这两个地区是河南省小麦主要种植区域,其土壤总镉含量平均分别为0.23 mg/kg(开封)和0.37 mg/kg(原陽)[17]。各试验点田间均采用随机区组设计,每个小麦材料种植3行,行长2 m,行距25 cm,株距10 cm,设3次重复。试验田土壤肥力中等,田间管理按照当地常规栽培管理标准进行。
1.2 镉元素含量测定
小麦籽粒收获及预处理:待小麦自然成熟后,按小区混收。收获的小麦籽粒自然充分晾干,取一定量籽粒用小型粉碎机粉碎,经孔径0.15 mm筛子过筛后,称取0.50 g 样品放入50 mL微波消解管中,加入一定量的硝酸和过氧化氢,混匀后放入微波消解仪进行消解,最后充分过滤消解液并用1%硝酸溶液定容至50 mL。
小麦籽粒镉元素含量测定:首先利用镉 (1 mg/kg)元素标准溶液分别配制0.02 mg/kg、 0.05 mg/kg、0.10 mg/kg、0.20 mg/kg 4个浓度梯度溶液,利用日本岛津原子吸收分光光度仪 AA-6300,采用火焰-原子吸收法测定其吸光度,构建镉元素的标准曲线。基于构建好的镉元素标准曲线,采用同样方法分别测定小麦种质籽粒的镉元素含量,每个小麦样品重复测定3次,取平均值作为每个材料籽粒镉元素含量。
1.3 基因型检测
在小麦幼苗期采集叶片利用改良的SDS法提取DNA[18],利用0.8%琼脂糖凝胶电泳检验DNA质量。利用博奥晶典生物技术有限公司小麦660 K iSelectSNP 芯片对207份小麦材料进行SNP分型,同时对分型结果进行质量控制,剔除数据缺失率>2%、杂合率>50%和最小等位基因频率(Minor allele frequency,MAF)<0.05的 SNP 标记,最终获得多态性高、稳定性好高质量SNP 标记244 508个,这些标记将被用于后续关联分析。
1.4 全基因组关联分析
基于Tassel v5.0软件中的GLM (Generalized Linear Model) 模型[19],结合已获得的关联群体基因型数据及其表型数据,对207份小麦种质籽粒镉元素含量进行关联分析。分析中,当 P≤0.001时,认为该SNP标记与性状显著关联,并计算该标记位点对表型变异的贡献率。利用Rstudio软件绘制曼哈顿图和Quantile-Quantile 散点图[20],每个位点的显著性则通过曼哈顿图来展示。
1.5 候选基因预测
以 LD 距离作为候选基因的预测区间,以与镉元素含量显著关联的 SNP 标记序列为探针,在NCBI(http://www.ncbi.nlm.nih.gov;National center for biotechnology information)和 ENA(European Nucleotide Archive;http://www.ebi.ac.uk/ena)数据库中进行Blast比对,获得镉元素含量相关的候选基因,并对部分候选基因进行功能注释。
2 结果与分析
2.1 小麦种质籽粒镉元素含量分布状况
关联分析群体包含的207份小麦种质籽粒镉元素含量在不同环境下变化较大。从图1和表1可知,在开封地区,不同小麦种质镉元素含量分布在0.03~2.19 mg/kg,平均值为0.92 mg/kg,其标准差为0.46,表明在该环境下关联分析群体的镉元素含量变异较大。与开封地区相比,关联分析群体镉元素含量在原阳地区无论变异程度还是平均值方面均相对较小,其变化范围为0.07~ 1.44 mg/kg,镉元素平均含量为0.55 mg/kg,标准差为0.31。从偏度和峰度值看,两个环境下关联群体镉元素含量均呈偏态分布,相对而言开封环境下镉元素含量更接近正态分布。另外,研究利用不同环境获得了该群体最佳线性无偏差预测值(BLUP),可以发现,群体镉元素含量的BLUP值表现较好。从小麦种质在不同环境下的综合表现来看,有个别小麦种质镉元素含量较低且表现稳定,表现最突出的种质为‘云麦51,其在原阳环境下的镉元素含量只有0.07 mg/kg,在开封环境下镉元素含量为0.10 mg/kg。表现比较突出的还有‘郑麦379‘白穗白‘云麦53‘双丰收等,这些种质将在未来选育对镉具有良好避性的小麦新品种中具有较好利用前景。
2.2 小麦籽粒镉元素含量GWAS分析
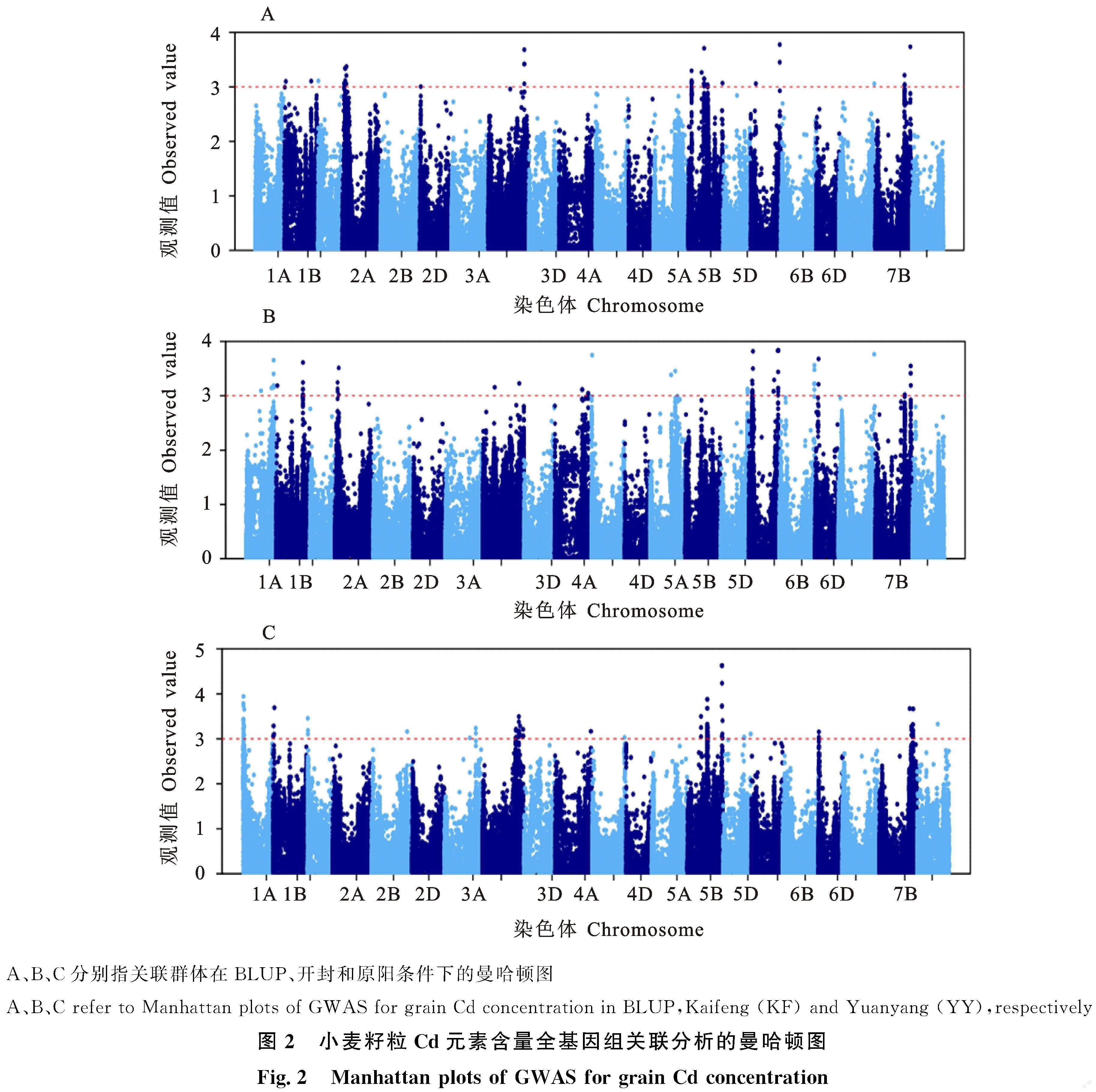
基于660K SNP芯片本研究共检测到与镉元素含量显著相关的SNP 310个,这些SNP分布在除3D和4D以外的19条染色体上。不同染色体上SNP数量存在较大差异,其中5B染色体上最多,有141个,2B、2D和7D染色体上最少,都只有1个(图2)。检测到的SNP对镉元素含量的解释变异率表现均较好,单个SNP的解释变异率均超过10%,介于10.95%~14.66%,其中5B染色体上位于692 510 863 bp处的SNP(AX-111038088)、位于692 511 047 bp处的SNP (AX-109544279)和位于692 511 175 bp处的SNP(AX-108797374)均具有最高的变异解释率 (14.66%)。不同环境下检测到的关联SNP也存在较大差异。其中在原阳环境下检测到186个关联SNP,这些SNP解释变异率分布在10.95%~14.66%;开封地区共检测到显著关联SNP 71个,单个SNP的解释变异率介于11.70%~ 13.48%。利用BLUP值共检测到显著SNP 53个,这些SNP解释变异率范围为11.74%~ 13.37%。可以看出,在原阳环境下检测到的关联SNP数量远高于另外两种环境,这可能与两个地区土壤镉含量差异有关,原阳地区土壤镉含量比开封高,较高镉的土壤环境可能更有利于形成小麦籽粒中镉含量的丰富变异。
多环境下均能检测到的稳定SNP对小麦Cd元素遗传及应用研究更具意义。本研究共检测到7个稳定SNP,分别是1B染色体上位于 546 447 821 bp处的AX-109947438、3B染色体上位于737 764 644 bp处的AX-94568844、5B染色体上位于275 179 328 bp处的AX-111054376、5B染色体上位于398 809 332 bp处的AX-110470884、5B染色体上位于399 033 284 bp处的AX-110994155、7A染色体上位于715 775 570 bp处的AX-110746365和7B染色体上位于 716 293 661 bp处的AX-109921835,后期应加强对这些稳定SNP 的深入研究。同时,研究基于SNP物理位置将距离较近的SNP整合为QTL,共获得52个有效QTL (表3)单个QTL包含的显著SNP数量存在较大差异,介于1 ~ 101。检测到的与Cd含量相关的QTL在不同染色体上的分布也不均衡,其中3B和6A染色体上检测到的QTL最多,分别达到了6个,1D、2B、2D、6B、7A和7D染色体上均只发现1个QTL。Cd元素含量QTL在不同环境下数量也有差异,其中在原阳共检测到23个QTL,开封共检测到25个QTL。
2.3 稳定遗传SNP的效应分析
基于上述发现镉元素关联的7个稳定SNP,研究对其进行了单标记效应分析。从图3和表2可以发现,不同SNP优势等位变异在关联分析群体所占比例差异明显。其中AX-109947438、AX-110746365和AX-109921835优势等位变异在关联群体中占有比例较低,均小于20%,而AX-111054376、AX-110470884和AX-110994155的优势等位变异在群体中所占比例均较高,超过80%,只有AX-94568844的优势等位变异与非优势等位变异在群体中所占比例较为接近。分析同时发现,对小麦籽粒镉元素含量而言,7个SNP的优势等位变异均为非优异等位变异,而非优势等位变异均是优异等位变异,比较后发现,携带SNP非优势等位变异的小麦种质比携带优势等位变异的小麦种质其籽粒镉元素含量平均降低 0.03~0.05 mg/kg。7个SNP中AX-110994155非优势等位变异的效应最突出(降低镉元素含量 0.05 mg/kg),其次是AX-109921835(降低镉元素含量0.04 mg/kg)。另外,研究也對不同环境下7个SNP等位变异的表型效应进行了差异性比较分析,可以发现,除AX-109947438在原阳环境、AX-111054376在开封环境外,7个SNP等位变异的镉元素含量差异均达到了显著性水平。
2.4 候选基因分析
本研究共获得镉元素相关基因277个,这些基因主要分布在1B、3B、5B、7A、7B染色体上,通过对这些基因在小麦不同组织(根、叶片、穗部和籽粒)中表达分析比较,筛选到只在小麦籽粒中特异表达的候选基因7个,具体信息详见表3。其中, TraesCS1-B01G320200可能编码RNA聚合酶Ⅱ转录亚单位12G调节因子,而该调节因子影响RNA聚合酶Ⅱ行使转录功能的关键环节。TraesCS7B01G456900可能编码线粒体中ATP合成酶的有关亚基,该亚基对ATP的正常生物合成有影响。TraesCS7B01G459000可能编码类似LEUNIG的G蛋白,该蛋白可以与镉离子结合有利于镉的吸收与转运。TraesCS1B01-G321700可能编码戊二酸甲酸氨基转移酶,该酶参与植物中叶酸的代谢,而叶酸对于叶绿素和木质素的合成是必须的。候选基因TraesCS3B01G493300、 TraesCS3B01G493400和TraesCS3B01G493500功能尚不清楚。
3 讨 论
为了减少重金属镉对小麦品质的影响,小麦抗镉育种中应重点选择对环境中镉吸收少的小麦材料进行研究利用。因此对现有小麦种质籽粒镉元素含量调查及筛选是一项重要的基础性工作,但前期有关此方面研究报道较少。为此,本研究采用原子吸收法对国内外207份小麦种质籽粒的镉元素含量进行了测定,结果发现,不同小麦种质籽粒镉元素含量差异较大,而且环境条件对籽粒镉元素含量有一定的影响。在本研究试验种植的两个地区,开封地区种植的小麦种质镉元素含量相对较高,平均含量达到了0.92 mg/kg,而原阳地区小麦种质镉元素含量相对较低,平均为0.55 mg/kg,该结果可能是两个地区土壤环境的差异所致。同时发现,小麦籽粒镉元素平均含量均超过当地土壤镉元素平均含量,这可能与镉在小麦籽粒中的富集效应有关。在镉元素抗性小麦品种选育中,筛选镉元素含量低的小麦种质尤为重要,本研究获得了镉元素较低的部分小麦种质,例如,‘云麦51‘郑麦379‘白穗白‘云麦53‘双丰收,这些种质镉元素含量不仅低且其在不同环境下表现稳定,这表明这些种质在不同环境下对镉元素均具有较少吸收,说明这些种质对土壤镉具有良好的避性。下一步可以选择其作为亲本配制杂交来选择培育抗镉优良小麦新品种。
众所周知,镉元素含量是受多基因控制的数量性状,而全基因组关联分析是解析数量性状遗传机制的有效途径之一。但截至目前,国内外有关小麦镉元素关联分析的研究仍较少。近年来小麦SNP芯片作为一种有效手段已被广泛应用于小麦重要基因定位及相关研究中[21-24]。本研究利用小麦660K SNP芯片对国内外207份小麦种质
籽粒镉元素含量进行了全基因组关联分析,结果共检测到与镉元素显著关联SNP 310个,与前人研究[12-14]相比,本研究检测到了更丰富的与镉元素显著关联的SNP。推测可能由于以下两方面原因所致,一方面可能与本研究的关联分析群体构成特点有关。本研究关联群体的种质来源较为丰富,其不仅包含了国内15个不同生态区的小麦种质,也包括一些国外小麦种质,丰富的小麦种质可能蕴藏更多的遗传变异。另一方面,660K SNP芯片的利用为镉元素更多遗传位点的检测发现创造了条件。遗传图谱构建中分子标记密度直接影响目标性状显著关联位点检测的数量和准确性。在本研究中,660K基因芯片提供了可用于关联分析的有效SNP标记共244 508个,每个连锁群SNP标记数量平均在11 000个以上,该图谱有利于提高镉元素关联遗传位点的检测效率。
本研究对检测到的小麦镉含量QTL与前人研究结果进行了比较。在1A染色体上,本研究发现1个QTL,其位于504 277 686 bp处。Safdar等[13]在该物理位置附近的462 435 832 bp处也发现了1个QTL,同时Safdar和本研究在1D染色体上也均检测到了QTL,Safdar发现的1个QTL位于1D染色体上的14 985 862 bp处,而本研究检测的1个QTL位于907 312 bp~ 5 519 062 bp区段,可以看出,两个研究在1D染色体上发现的QTL距离较远。本研究在2A染色体的36 196 690 bp~83 784 774 bp区段共发现了3个QTL,Hussain等[14]在该染色体上也发现了1个QTL,但其物理位置与本研究的QTL较远,位于2A染色体的715 333 165 bp~ 717 146 211 bp物理区段。Hussain等[14]在5A染色体上检测到了1个QTL,该QTL位于 580 939 178 bp~ 581 302 317 bp区段内,本研究在5A染色体上发现了2个QTL,其分别位于427 202 113 bp和510 096 323 bp处,可以看出,两个研究发现的QTL物理位置相差较远。Hussain等[14]在2B染色体上696 677 568 bp~ 701 097 263 bp处检测到1个QTL,本研究在该染色体上707 178 993 bp处发现1个QTL,两个QTL距离较近(约6 Mb)。另外,由于前人部分研究结果并未显示QTL准确物理位置信息,因此本研究只能和其进行粗略比较。例如,本研究在4B染色体的13 280 997 bp和642 231 359 bp处分别检测到1个QTL,在相同染色体上Yusuke等[12]却发现了7个QTL,但其处于 37.0 cM~51.3 cM遗传区段内,在6B染色体上Yusuke等检测到了7个QTL,而本研究只发现了1个QTL。可以看出,本研究发现的多数QTL在以前研究中并未发现,雖然少数QTL与以前报道的QTL位于相同染色体上,但其物理位置仍较远。当然通过比较,我们也发现了富含小麦镉含量QTL的较重要染色体,如1A、3B、5B和6A染色体,下一步应加强对这些染色体上QTL的深入研究。
候選基因分析可以有效揭示小麦籽粒镉元素含量遗传调控机制,为培育抗镉元素小麦良种提供科学支撑。故在获得小麦籽粒镉元素含量显著关联SNP的基础上,本研究也开展了镉元素候选基因的预测分析。共获得了7个与镉元素相关的候选基因,这些基因主要通过编码与镉元素代谢相关蛋白或其调节因子而影响小麦籽粒镉元素含量。小麦植株体内的镉元素主要来源于其生长的土壤环境,这些进入植株体的镉元素都要经历吸收、分配、转运、跨膜等复杂代谢过程才能到达小麦籽粒,而这些代谢过程又有涉及到很多相关因子的参与,通过调节这些因子的功能或活性进而对小麦籽粒镉元素含量影响。可以发现,本研究获得的部分候选基因与镉元素代谢不同因子有关。RNA聚合酶Ⅱ在真核生物中负责所有mRNA的生物合成,亚单位12G是其重要的组成部分[25-26],而亚单位12G的调节因子对RNA聚合酶Ⅱ完成基因转录功能产生影响[27],TraesCS1B01G320200可能通过调控RNA聚合酶Ⅱ转录亚单位12G的调节因子而影响相关基因的转录,同时对与镉元素代谢相关mRNA合成产生影响,最终使小麦籽粒镉元素含量发生变化。ATP合成酶由多种亚基组成,主要负责为植物各种代谢活动提供所需能量,而亚基对ATP合成酶的功能会产生直接影响[28-29],植物对镉元素的吸收和转运等过程是需要能量的,而 TraesCS7B01G456900可能通过编码线粒体中ATP合成酶的有关亚基进而对ATP生物合成产生影响,进而影响镉元素的相关代谢过程及其在小麦籽粒中的累积。在生物对镉的吸收与转运过程中,生物体内能与镉有效结合的特异蛋白发挥着重要作用,目前已有类似蛋白被发现[30-31],本研究发现的TraesCS7B01G459000基因可能编码可以与镉结合的相关蛋白,其对籽粒中镉含量产生影响。TraesCS1B01G321700编码戊二酸甲酸氨基转移酶,关于该酶的研究绝大多数集中于动物方面,其在植物中的研究报道较少,在植物中戊二酸甲酸氨基转移酶主要与叶酸的合成代谢有关,而叶酸不仅对于植物叶绿素和木质素合成较为关键[32],同时也参与甘氨酸和丝氨酸的相互转化过程,该过程在植物光呼吸中是非常重要的[33]。可以看出,该基因通过对相关物质合成及生理代谢过程的间接调节,进而对镉吸收代谢产生影响。可以看出,镉元素候选基因通过编码相关蛋白或其组成因子进而影响镉元素在植物体内的代谢,而作为植物重要组织器官的籽粒,其镉元素含量也会受到这些代谢过程的影响。由于本研究是有关小麦籽粒镉含量遗传的初步探索,下一步需要针对发现的候选基因继续进行特异分子标记的开发并将其在不同小麦群体中进行验证。本结果将为小麦镉元素遗传调控机制解析提供一定研究基础。
4 结 论
本研究利用660 K SNP芯片对国内外207份小麦种质籽粒镉元素含量进行了全基因组关联分析,检测共发现了310个显著关联SNP位点,这些SNP分布于除3D、4D外的19条染色体上,单个SNP平均解释变异率介于10.95%~ 14.66%。研究同时发现了7个在多环境下表现稳定的SNP,并对其进行了单标记效应分析。最后研究获得7个与小麦籽粒镉元素含量有关的候选基因,这些基因的功能均与小麦吸收、转运等镉元素代谢过程有关。研究也筛选获得了籽粒镉含量较低的小麦种质,如‘云麦51‘郑麦379‘白穗白‘云麦53‘双丰收等,这些种质将在未来选育对镉具有良好避性的小麦新品种中具有较好利用前景。
参考文献 Reference:
[1] GRTER R,COSTEROUSSE B,BERTONI A,et al.Green manure and long-term fertilization effects on soil zinc and cadmium availability and uptake by wheat (Triticum aestivum L.) at different growth stages[J].Science of the Total Environment,2017,600:1330-1343.
[2]LIU Y M,LIU D Y,ZHANG W,et al.Health risk assessment of heavy metals (Zn,Cu,Cd,Pb,As and Cr) in wheat grain receiving repeated Zn fertilizers[J].Environmental Polluiont,2020,257:113581.
[3] KJELLSTRM T,LINNMAN L,CARLGUSTAF E.Variation of cadmium concentration in Swedish wheat and barley[J].Archives Environmental Health,1975,30 (7):321-328.
[4] GUO G H,LEI M,WANG Y W,et al.Accumulation of As,Cd,and Pb in sixteen wheat cultivars grown in contaminated soils and associated health risk assessment[J].International Journal of Environmental Research and Public Health,2018,15:2601.
[5] ZHOU Z F,SHI X,ZHAO G Q,et al.Identification of novel genomic regions and superior alleles associated with Zn accumulation in wheat using a genome-wide association analysis method[J].International Journal of Molecular Science,2020,21(6):1928.
[6] CHUNHABUNDIT R.Cadmium exposure and potential health risk from foods in contaminated area[J].Toxicoogyl Research,2016,32:65-72.
[7] NAWROT T,PLUSQUIN M,HOGERVORST J,et al.Environmental exposure to cadmium and risk of cancer:a prospective population-based study[J].Lancet Oncology,2006,7(2):119-126.
[8] PAGE V,FELLER U.Heavy metals in crop plants:transport and redistribution processes on the whole plant level[J].Agronomy,2015,5:447-463.
[9] WELCH R M.Micronutrient nutrition of plants[J].Critical Reviews Plant Sciences,1995,14:49-82.
[10]OLIVER D P,GORE P J,MOSS H J,et al.Cadmium in wheat-grain and milling products from some Australian flour mills[J].Australian Journal of Agricultural Research,1993,44:1-11.
[11] CORGUINHA A P B,de SOUZA G A,GONCALVES V C,et al.Assessing arsenic,cadmium,and lead contents in major crops in brazil for food safety purposes[J].Jouranl of Food Composition and Analysis,2015,37:143-150.
[12] YUSUKE B,ISHIKAWA G,UEDA H,et al.Novel quantitative trait loci for low grain cadmium concentration in common wheat (Triticum aestivum L.)[J].Breeding Science,2020,70(3):331-341.
[13] SAFDAR L B,ALMAS F,SARFRAZ S,et al.Genome-wide association study identifies five new cadmium uptake loci in wheat[J].Plant Genome,2020,13(2):e20030.
[14] HUSSAIN W,CAMPBELL M T,JARQUIN D,et al.Variance heterogeneity genome-wide mapping for cadmium in bread wheat reveals novel genomic loci and epistatic interactions[J].Plant Genome,2020,13(1):e20011.
[15] PENG F,WANG C,ZHU J S,et al.Expression of TpNRAMP5,a metal transporter from Polish wheat (Triticum polonicum L.),enhances the accumulation of Cd,Co and Mn in transgenic arabidopsis plants[J].Planta,2018,247:1395-1406.
[16] SHIM D,HWANG J U,LEE J,et al.Orthologs of the class A4 heat shock transcription factor hsfA4a confer cadmium tolerance in wheat and rice[J].The Plant Cell,2009,21:4031-4043.
[17] 段玲玲,楊家林,张 宁,等. 河南省农业土壤镉元素污染现状及来源分析[J].矿产勘查,2021,12(2):477-481.
DUAN L L,YANG J L,ZHANG N,et al.Pollution status and source analysis of cadmium in agricultural soil of Henan Province[J].Mineral Exploration, 2021,12(2):477-481.
[18] DELLAPORT S L,WOOD J,HICKS J B.A plant DNA minipreparation:version II[J].Plant Molecular Biology Reporter, 1983,1:19-21.
[19] YU J M,PRESSOIR G,BRIGGS W H,et al.A unified mixed-model method for association mapping that accounts for multiple levels of relatedness[J].Nature Genetics, 2006,38(2):203-208.
[20] KHRAMTSOVA E A,STRANGER B E.Assocplots:a python package for static and interactive visualization of multiple-group GWAS results[J].Bioinformatics, 2017,33(3):432-434.
[21] CUI F,ZHANG N,FAN X L,et al.Utilization of a wheat 660K SNP array-derived high-density genetic map for high-resolution mapping of a major QTL for kernel number[J].Scientific Reports, 2017,7:3788.
[22] 靳義荣,刘金栋,刘彩云,等.普通小麦氮素利用效率相关性状全基因组关联分析[J].作物学报,2021,47(3):394-404.
JIN Y R,LIU J D,LIU C Y,et al.Genome-wide association study of nitrogen use efficiency related traits in common wheat (Triticum aestivum L.)[J].Acta Agronomica Sinica,2021,47(3):394-404.
[23] 顾晶晶,余 慷,陈树林,等.河南小麦品种穗粒数性状的动态变化及全基因组关联分析[J].分子植物育种,2017,15(10):4143-4158.
GU J J,YU K,CHEN SH L,et al.Dynamic variation and genome-wide association analysis of grain number related traits in Henan wheat (Triticum aestivum L.)[J].Molecular Plant Breeding,2017,15(10):4143-4158.
[24] 周思远,毕惠惠,程西永,等.小麦耐低磷相关性状的全基因组关联分析[J].植物遗传资源学报,2020,21(2):431-441.
ZHOU S Y,BI H H,CHENG X Y,et al.Genome-wide association study of low-phosphorus tolerance related traits in wheat[J].Journal of Plant Genetic Resources,2020, 21(2):431-441.
[25] BUSHNELL D A,KORNBERG R D.Complete,12-subunit RNA polymerase II at 4.1-Aresolution:implications for the initiation of transcription[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(12):6969-6973.
[26] LALLET S,HERV G,GARMENDIA-TORRES C,et al.Role of Gal11,a component of the RNA polymerase II mediator in stress-induced hyperphosphorylation of Msn2 in saccharomyces cerevisiae[J].Molecular Microbiology,2006,62(2):438-452.
[27] ZHANG S J,O′REGAN R,XU W.The emerging role of mediator complex subunit 12 in tumorigenesis and response to chemotherapeutics[J].Cancer,2020,126(5):939-948.
[28] LAPAILLE M,THIRY M,PEREZ E,et al.Loss of mitochondrial ATP synthase subunit beta (Atp2) alters mitochondrial and chloroplastic function and morphology in chlamydomonas[J].Biochimica et Biophysica Acta,2010,1797(8):1533-1539.
[29] BGU D,GRAVER P V,DOMEC C,et al.RNA editing of wheat mitochondrial ATP synthase subunit 9:direct protein and cDNA sequencing[J].The Plant Cell,1990,2:1283-1290.
[30] INANOBE A,MATSUURA T,NAKAGAWA A,et al.Inverse agonist-like action of cadmium on G-protein-gated inward-rectifier K+ channels[J].Biochemical and Biophysical Research Communications,2011,407:366-371.
[31] EINICKER-LAMAS M,MORALES M M,MIRANDA K,et al.P-glycoprotein-like protein contributes to cadmium resistance in Euglena gracilis[J].Journal of Comparative Physiology B,2003,173:559-564.
[32] DOUCE R,BOURGUIGNON J,NEUBURGER M,et al.The glycine decarboxylase system:a fascinating complex[J].Trends in Plant Science,2001,6:167-176.
[33] REBEILLE F,NEUBURGER M,DOUCE R.Interaction between glycine decarboxylase,derine hydroxymethyltrasferase and tetrahydrofolate polyglutamates in pea leaf mitochondria[J]. Biochemical Journal,1994,302:223-228.
Genome-Wide Association Analysis and Candidate Gene Prediction of Wheat Grain Cd Concentration
Abstract Cadmium (Cd) is a heavy metal that adversely affects the quality of wheat,and breeding Cd-resistant wheat is crucial. In the present study,a genome-wide association study (GWAS) was conducted in Cd content in wheat grains using the wheat 660 K genotyping assay and a diverse panel of 207 wheat accessions. A field trial was conducted in two locations in 2017. A total of 310 SNPs significantly associated with Cd content were identified,which distributed on 19 wheat chromosomes except for 3D and 4D. The phenotypic variation explained by each SNP varied from 10.95% to 14.66%. The number of significant SNP varied across the different environments,of which 186 SNPs and 71 SNPs were found in Yuanyang and Kaifeng,respectively. Fifty-three significant SNPs were also identified based on the BLUP value. Furthermore,the adjacent SNPs based on the marker physical locations were integrated to the same QTL,finally,52 effective QTLs were obtained,seven significant SNPs were also repeatedly detected under two environments and the BLUP value,and their genetic effect on Cd content was analyzed. In addition,seven candidate genes were predicted for Cd content in wheat grains,of which TraesCS1B01G321700 and TraesCS1B01G320200 were possibly associated to the transcription of genes,whereas TraesCS7B01G459000 and TraesCS7B01G456900 possibly had the functions on the absorption and transportation of Cd in wheat. Finally,we identified some elite wheat germplasms with good Cd avoidance,including Yunmai 51,Zhengmai 379,Baisuibai,Yunmai 53.
Key words Wheat; Cd concentration; SNP array; Genome-wide association analysis

