嗜水气单胞菌外膜蛋白TolB 的原核表达及生物信息学分析
陈甜梦,蔡彤璇,王嘉璐,田牧野,赵宝华,刘 东
(河北师范大学 生命科学学院,河北 石家庄 050024)
嗜水气单胞菌(Aeromonas hydrophila)是一种淡水、兼性厌氧、化学有机异养细菌,可引起鱼类、两栖动物、爬行动物、鸟类和哺乳动物的疾病,尤其可引起鱼类细菌性败血症[1],由于其高发病率和死亡率,给全球水产养殖带来巨大的经济损失[2]。抗生素治疗是对抗嗜水气单胞菌感染的主要措施。然而,由于抗生素耐药性发展和传播的严峻形势,以及药物残留和环境污染,迫切需要抗生素的替代品[3]。疫苗免疫是水产养殖业疾病防控中重要的、有效的方式,在抗生素减少和替代的背景下,疫苗开发和应用的意义更加突出[4]。
Tol-Pal 系统是由革兰氏阴性细菌产生的一组蛋白质复合物。这一系统由内膜相关亚单位TolA、TolQ、TolR 3 种蛋白质以及外膜锚定亚单位TolB 和Pal 蛋白组成[5]。Tol-Pal 系统首先在大肠杆菌中发现,随后在许多其他细菌属中也有报道。对于革兰氏阴性菌来说,Tol-Pal系统具有重要而多样的生物学功能[6]。tol-pal基因的突变对细胞形态发生和细菌致病性具有重要作用。目前,关于Tol-Pal系统在细菌致病机制中的作用主要体现在:tol-pal基因突变体细胞壁及包膜完整性被破坏,某些细菌毒力蛋白如毒素和鞭毛蛋白的功能减低或产生缺陷[7]。tol-pal基因对某些致病微生物的生长或存活是至关重要的,tol-pal基因突变体不能在宿主体内存活等[8]。
革兰氏阴性菌细胞表面外膜蛋白(Outer membrane protein,OMP)在维持细胞结构、生命活动方面发挥重要作用[9-11]。革兰氏阴性细菌外膜蛋白TolB 是一种周质蛋白,它与外膜脂蛋白Pal 相互作用以介导细菌内外层之间的接触。TolB 还可以与位于外膜的几种蛋白质相互作用,包括OmpA、OmpF和Lpp[5]。研究表明,TolB位于细胞膜表面,广泛与外界接触,而且又是病原菌转运毒素的必要装置,有较好的免疫原性和免疫保护性,是亚单位疫苗的潜在候选[12]。
嗜水气单胞菌外膜蛋白表面的抗原决定簇可使其极易被免疫系统识别,从而引起机体的特异性免疫[13-15]。目前,未见关于嗜水气单胞菌Tol-Pal 系统致病性的研究报道,对嗜水气单胞菌外膜蛋白TolB 特性的研究,将有助于嗜水气单胞菌减毒疫苗或抗菌药物的开发。为了深入研究嗜水气单胞菌外膜蛋白TolB 的免疫功能,表达纯化得到TolB 蛋白,并借助生物信息学软件分析了TolB 的蛋白质序列相似性,预测和分析了其基本理化性质、信号肽和跨膜结构,二级结构与三级结构,磷酸化与糖基化位点,蛋白质相互作用网络及优势的B 细胞和T细胞抗原表位,以期为TolB 蛋白亚单位疫苗的制备奠定理论基础。
1 材料和方法
1.1 菌株
嗜水气单胞菌(Aeromonas hydrophila)ATCC 7966、大 肠 杆 菌(Escherichia coli)DH5α 和BL21(DE3)。A.hydrophila与E.coli均使用LB培养基,在37 ℃进行培养。使用的抗生素终质量浓度:氨苄青霉素(Amp)为100 μg/mL,卡那霉素(Kan)为50 μg/mL。
1.2 主要试剂
Taq酶、DNA 连接酶、T4 DNA 连接酶、限制性内切酶和IPTG(异丙基-β-D-硫代半乳糖苷)购自Takara 公司;DNA 片段回收试剂盒购自生工公司;Ni-NTA agarose 树脂购自Qiagen 公司;蛋白质Marker购自天根公司;其他化学试剂均为分析纯。
1.3 引物
本研究所用引物为tolB-up:CGCCATATGTCTTCTTCTGATTCTGACG;tolB-down:AAACTCGAGGTAAACCAGAACCGCA。酶切位点分别为NdeⅠ和XhoⅠ。引物合成由金唯智公司完成。
1.4 嗜水气单胞菌tolB基因的克隆
以A.hydrophilaATCC 7966 基因组DNA 为模板,tolB-up 和tolB-down 为 引 物,PCR 反 应 条 件:95 ℃2 min;95 ℃30 s,56 ℃1 min,72 ℃2 min,30个循环;72 ℃10 min,4 ℃1 h。使用胶回收试剂盒回收PCR产物,4 ℃保存。
1.5 嗜水气单胞菌tolB基因异源表达载体的构建
将所得的tolB基因片段经限制性内切酶NdeⅠ和XhoⅠ双酶切后,纯化回收目的片段,与经过酶切的表达载体pET-22b(+)连接,转化E.coliDH5α,获得阳性转化子,提取重组质粒再转化入E.coliBL21(DE3),挑取阳性克隆,提取质粒送测序公司测序。
1.6 嗜水气单胞菌TolB蛋白的原核异源表达
将筛选到的阳性克隆接种到含有50 μg/mL 卡那霉素的100 mL LB 培养基中,37 ℃条件下培养至菌液OD600达到0.4~0.6 后,添加IPTG 使其终浓度达到0.5 mmol/L,16 ℃180 r/min 过夜诱导表达。收集菌液,经4 ℃、8 000 r/min 离心10 min 收集菌体沉淀,将沉淀用20 mL裂解液重悬,用超声破碎仪破碎细胞(电压:16 V;时间:20 min;脉冲周期:pulse on:8 s;pulse off:8 s)。将细胞裂解液于4 ℃、15 000 r/min离心10 min,收集上清。
1.7 嗜水气单胞菌TolB蛋白的纯化
将收集到的上清液用镍柱进行纯化。把上清液加到Ni-NTA agarose 树脂中轻轻混匀,4 ℃结合1 h,用含75 mmol/L咪唑的洗涤液洗去未结合蛋白,再用含300 mmol/L 咪唑的溶液洗脱目的蛋白,收集各个组分,用SDS-PAGE 分析纯化效果。具体操作参照Qiagen公司蛋白质纯化手册。
1.8 嗜水气单胞菌TolB的生物信息学分析
1.8.1 TolB 的理化性质和修饰位点分析 采用ExPASy-ProtParam(http://web.expasy.org/protparam/)网络在线软件对嗜水气单胞菌TolB 蛋白的相对分子质量、亲水性、等电点、脂肪指数和稳定性进行预测分析;采用ProtScale analysis(https://web.expasy.org/protscale/)方法预测亲水性图谱。利用在线网站YinOYang-1.2(https://services.healthtech.dtu.dk/services/YinOYang-1.2/)和 NetNGlyc-1.0(https://services.healthtech.dtu.dk/services/NetNGlyc-1.0/)分别分析TolB蛋白的O糖基化和N糖基化位点。
1.8.2tolB基因序列测定、序列相似性分析以及系统进化树绘制 测序分析由金唯智生物科技有限公司完成。使用生物信息网站NCBI(https://www.ncbi.nlm.nih.gov/)和DNAMAN 软件拼接基因的全长序列,并推导编码的氨基酸序列。利用NCBI 网站下载嗜水气单胞菌(A.hydrophila,GenBank 登录号:WP_011707363.1)、杀 鲑 气 单 胞 菌(Aeromonas salmonicida,GenBank 登录号:RSM27999.1)、简氏气单 胞 菌(Aeromonas jandaei,GenBank 登 录 号:BCS50541.1)、舒氏气单胞菌(Aeromonas schubertii,GenBank 登 录 号:QCG49071.1)、豚 鼠 气 单 胞 菌(Aeromonas caviae,GenBank 登录号:BDC85372.1)、维氏气单胞菌(Aeromonas veronii,GenBank 登录号:QLH68355.1)、产 碱 普 罗 维 登 斯 菌(Providencia alcalifaciens,GenBank 登录号:CAG9413353.1)以及爱德华氏菌(Edwardsiella ictaluri,GenBank 登录号:QPW30779.1)的tolB基因编码的氨基酸序列,使用GeneDoc 软件进行相似性分析,并计算出序列相似度,采用MEGA 5.0软件绘制系统发育树。
1.8.3 TolB 的信号肽、跨膜结构域和蛋白质高级结构预测 采用Signal P4.1(https://services.healthtech.dtu.dk/services/SignalP-5.0/)软件对TolB 蛋白进行信号 肽 预 测。 利 用TMHMM serverv.2.0(https://services.healthtech.dtu.dk/services/TMHMM-2.0/)隐马尔科夫模型(Hidden Markov Model,HMM)对TolB蛋白跨膜结构进行分析。利用SOPMA(https://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl? page=npsa_sopma.html) 和 SWISS-MODEL (https://swissmodel.expasy.org/)在线软件,分别对TolB 蛋白进行二级结构和三级结构的预测。
1.8.4 TolB 的的磷酸化位点预测和蛋白质相互作用网络分析 采用NetPhosBac-1.0server(https://services.healthtech.dtu.dk/services/NetPhosBac-1.0/)预测TolB 蛋白的磷酸化位点。通过String蛋白质相互作用预测网站(https://cn.string-db.org/),预测TolB蛋白与其他蛋白质的相互作用关系网络。
1.8.5 TolB 的细胞抗原表位分析 采用ABCpred(https://webs.iiitd.edu.in/raghava/abcpred/index.html)和 BepiPred-2.0(http://www.cbs.dtu.dk/services/BepiPred/)方法预测TolB 蛋白的B 细胞表位,分析其肽段位置分布情况。细胞毒性T 淋巴细胞(CTL)抗原表位采用nHLAPred(https://webs.iiitd.edu.in/raghava/nhlapred/)进 行 预 测,选 择HLA-A*020l、HLA-A*0202、HLA-A*0203、HLA-A*0205 四 类 限制表型。采用在线软件ProPred(https://webs.iiitd.edu.in/raghava/propred/index.html)对TolB 蛋白进行Th 抗 原 表 位 预 测,选 用HLA-DRBl_0101、HLADRBl_0102、HLA-DRBl_030l 三种不等位基因类型进行预测。
2 结果与分析
2.1 A.hydrophila tolB基因的PCR扩增结果
TolB 信号肽预测结果显示,嗜水气单胞菌TolB蛋白的信号肽序列由N 端的21 个氨基酸残基组成(1—21 位),切割位点在第21—22 个氨基酸残基,分值是0.946。因此,本研究根据NCBI 数据中嗜水气单胞菌(Aeromonas hydrophila)ATCC 7966 的tolB核苷酸序列(登录号:NC_008570)设计得到去除信号肽的特异性PCR 引物,从基因组中扩增1 条大小约为1 263 bp 的DNA 单一条带,与预期基因大小一致。将扩增基因产物命名为AHtolB,将目的基因与克隆载体连接并测序,测序结果表明,AHtolB与A.hydrophilaATCC 7966tolB基因(GenBank 登录号:WP_017412185.1)相似度100%。
2.2 TolB蛋白的异源表达与纯化
以pET-22b(+)为载体成功构建pET-22b-tolB重组质粒,NdeⅠ和XhoⅠ双酶切验证正确后转入E.coliBL21(DE3)进行异源表达。重组菌株经IPTG 诱导表达,表达产物经Ni 柱纯化后超滤浓缩,将产物进行SDS-PAGE检测,得到分子质量约46 ku的目的蛋白,这与根据氨基酸序列推导出的TolB 蛋白分子质量相近(图1)。
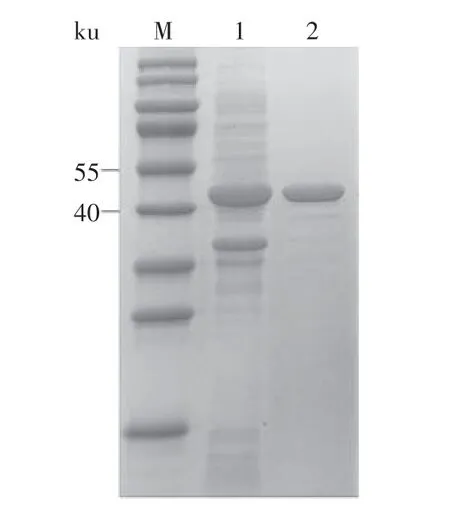
图1 亲和层析纯化TolB 蛋白的SDS-PAGE分析Fig.1 SDS-PAGE analysis of the purified TolB protein
2.3 TolB蛋白理化性质分析
TolB 蛋白理化性质预测结果表明,蛋白的分子质量为45.78 ku;相对分子质量为86.26,理论等电点为8.75。TolB 蛋白全长序列氨基酸数量为441个,含量较多的氨基酸是甘氨酸(39个,占8.8%)、丝氨酸(39 个,占8.8%)和丙氨酸(38 个,占8.6%);TolB 只含有一个半胱氨酸,不含有二硫键。带负电荷的氨基酸(天冬氨酸和谷氨酸)共有41个,带正电荷的氨基酸(精氨酸和赖氨酸)共有44个,其分子式为C2137H3392N594O647S14,原子总数6 784。假设TolB所有的胱氨酸残基以半胱氨酸的形式出现,即形成二硫键,消光系数为60 850 mol/cm,A280为1.262;假设二硫键全部打开,消光系数为60 850 mol/cm,A280为1.262。TolB 在哺乳动物红细胞中的半衰期为30 h,在酵母体内的半衰期大于20 h,在大肠杆菌体内半衰期大于10 h。TolB不稳定指数为34.14,表明嗜水气单胞菌TolB 蛋白属于稳定蛋白;脂肪指数是86.26,平均亲水性(GRAVY)为-0.194,表明嗜水气单胞菌TolB蛋白为亲水性蛋白。
2.4 嗜水气单胞菌tolB基因序列相似性比较
序列相似性比对结果表明,TolB 氨基酸序列在气单胞菌间具有高度的同源性,分别为99.3%(维氏气单胞菌)、98.4%(简氏气单胞菌)、97.5%(豚鼠气单胞菌)、96.6%(杀鲑气单胞菌)和90.9%(舒氏气单胞菌),而在不同属间菌株也具有一定的同源性,如32.5%(产碱普罗维登斯菌)和33.6%(爱德华氏菌)(图2)。以MEGA 5.0 软件构建的进化树显示,几种不同的气单胞菌亲缘关系均较近,且不同种属间也有一定的亲缘关系(图3)。因而,TolB 蛋白免疫动物后产生的抗体可能对不同种属的细菌具有交叉免疫的作用。

图2 气单胞菌属菌株间TolB蛋白氨基酸序列同源性分析Fig.2 Alignment of amino acid sequences from A.hydrophila and other Aeromonas strains
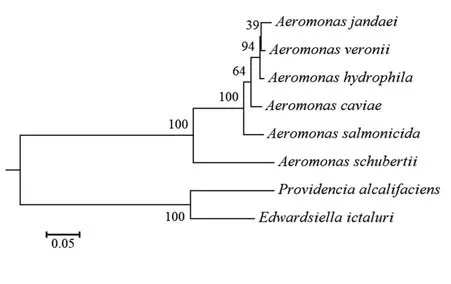
图3 不同菌株间TolB蛋白系统发育树Fig.3 Phylogenetic relationships of TolB among different strains
2.5 TolB蛋白跨膜结构和高级结构预测
跨膜结构预测结果显示,TolB 蛋白没有跨膜区,所有区域都在细胞膜外,是一种外膜蛋白。
TolB 蛋白二级结构预测结果如图4 所示。TolB蛋白包含的二级结构分别为α 螺旋(蓝色)66个,占14.97%;β 片层(红色)129 个,占29.25%;β 转角(绿色)52 个,占11.79%;无规则卷曲(紫色)194 个,占43.99%。无规则卷曲是TolB 蛋白含量最丰富的结构原件。
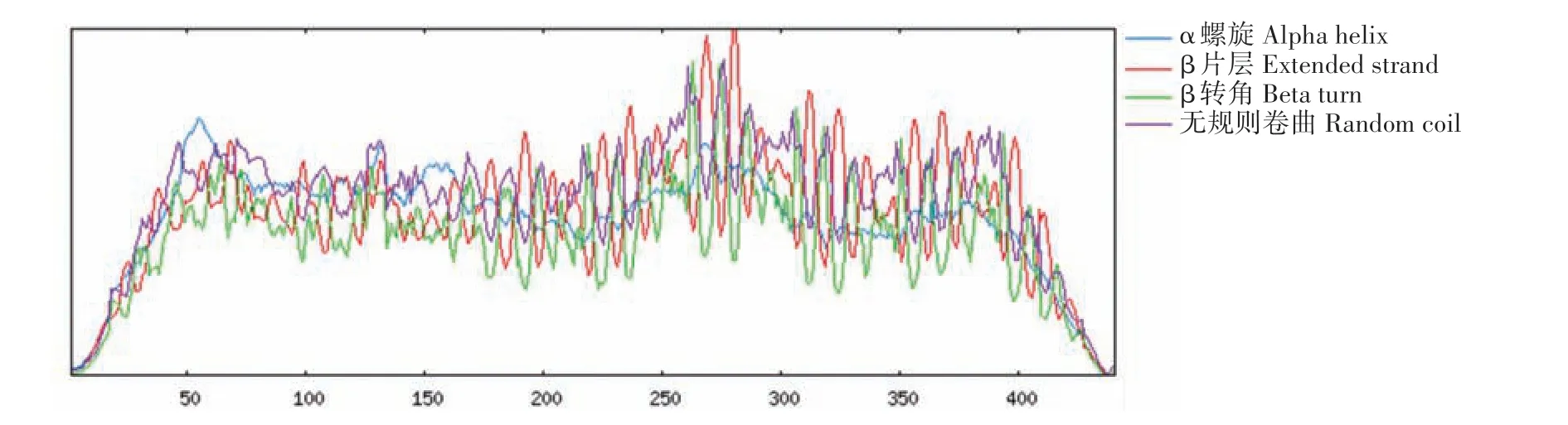
图4 TolB蛋白二级结构预测结果Fig.4 The secondary structure prediction of TolB
利用SWISS-MODEL 进行同源建模,得到了以PDB ID:3iax.1.A 为模板的预测模型。比对结果显示,模板与TolB 同源性最高为48.72%,基于模板构建了TolB 蛋白的三级结构图(图5),全局模型质量评估分数(GMQE)为0.79,GMQE 值在0~1,数字越高表明可靠性越高。TolB 蛋白三级结构模型覆盖率最高为97%,说明模型的质量和匹配度较好,可靠性较高。从TolB 蛋白三级结构模型可以看出,其α 螺旋和无规则卷曲结构数量较多,推测α螺旋和无规则卷曲对TolB蛋白生物学功能具有重要作用。
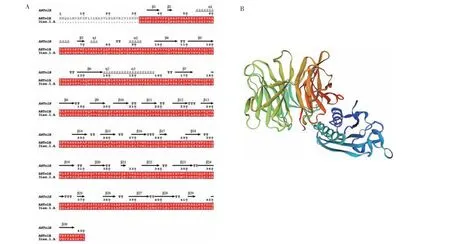
图5 TolB蛋白三级结构预测结果Fig.5 The 3-D structure prediction of TolB
2.6 TolB蛋白翻译后的修饰
2.6.1 磷酸化位点的预测 NetPhosBac 软件预测结果表明,TolB 蛋白的磷酸化位点有12 个,全部为丝氨酸磷酸化位点。包括第18、33、103、134、141、208、247、277、187、296、410、428位氨基酸。
2.6.2 糖基化位点的预测 利用NetNGlyc-1.0 服务器预测TolB 蛋白存在1 个N 糖基化位点,位于395位。应用在线软件YinOYang-1.2预测该蛋白可能存在1个O糖基化位点,位于294位。
2.7 TolB蛋白质相互作用网络分析
TolB 蛋白相互作用预测结果显示,TolB 蛋白与10 种蛋白质存在相互作用,其中与Tol-Pal 系统中的Pal 蛋白、TolQ 蛋白、TolA 蛋白、TolR 蛋白以及外膜蛋白CpoB 蛋白、BamD 蛋白和BamA 蛋白之间的相互作用更加紧密(图6)。
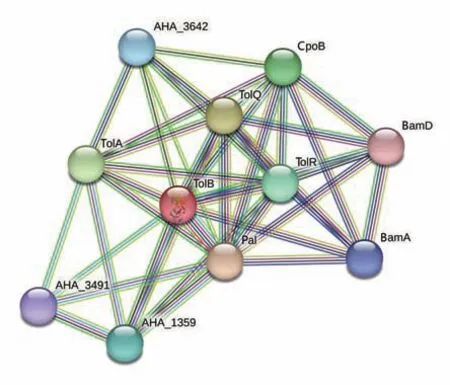
图6 TolB蛋白相互作用网络预测Fig.6 Prediction of TolB protein interaction
2.8 TolB蛋白B细胞抗原表位预测
通过ABCpred 软件预测TolB 蛋白的B 细胞抗原表位,序列的得分越高,表明作为抗原表位的概率越高。预测得到的抗原表位评分大于0.85 的表位有10 条,分别 为190—205、301—427、74—89、167—182、334—349、352—367、346—361、422—437、256—277、131—147 aa。利用BepiPred-2.0 方法预测获得的细胞优势B 抗原表位共有13条,其中长度大于6 aa的共有11条,分别为43—67、69—95、123—156、160—173、199—205、242—252、287—295、334—342、380—387、419—425 aa。使用在线软 件Vaxi-Jen 2.0(http://www.ddg-pharmfac.net/vaxijen/VaxiJen/VaxiJen.html)进一步对抗原性进行评估,结果显示,潜在B 细胞抗原表位数量为9 个(表1)。
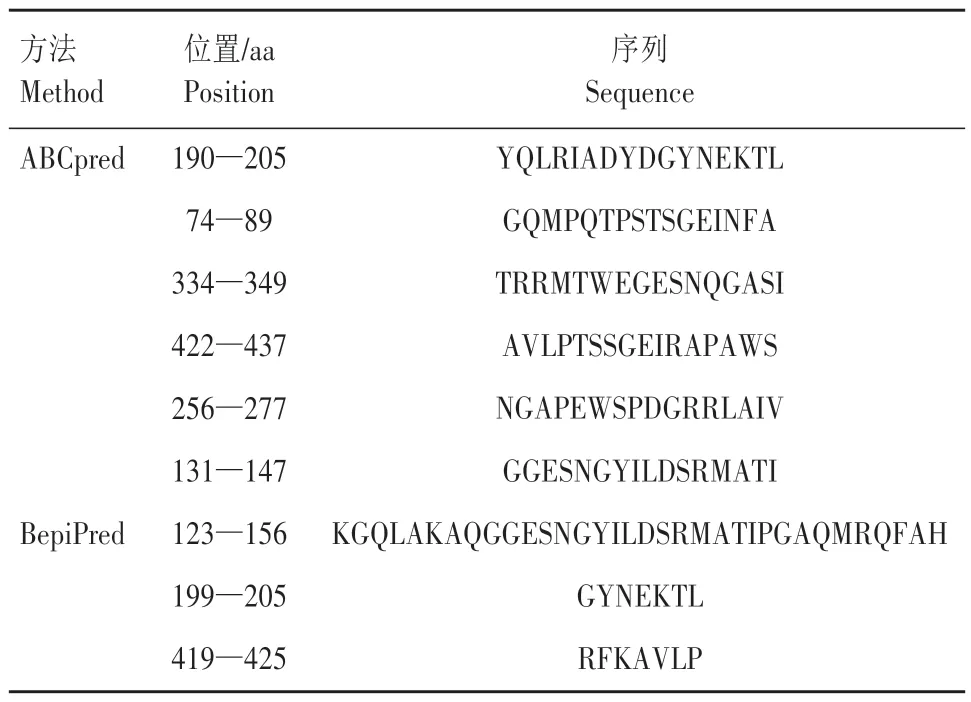
表1 TolB蛋白B细胞抗原表位预测Tab.1 B-cell epitope prediction results of TolB
2.9 TolB蛋白T细胞抗原表位预测
2.9.1 TolB 蛋白CTL 抗原表位预测 通过nHLAPred 在线软件预测CTL 抗原表位,选择HLAA_020l、HLA-A_0202、HLA-A_0203、HLA-A_0205四类限制表位,筛选出表位肽共20 条。属于HLAA2 表 位 有7—21、138—146、364—372 aa,属 于HLA-A_0201 表位有49—57、388—396 aa。属于HLA-A_0202 表 位 的 有49—57、99—107、388—396 aa。属于HLA-A_0203 表位有121—129、150—158、185—293 aa。属于HLA-A_0205 表位有1—9、34—46、110—122、150—158、166—180、260—268、359—367、426—434、442—450 aa。将预测得到的CTL抗原表位应用Vaxi-Jen 2.0软件进一步评估,最终确定8个CTL细胞优势表位(表2)。
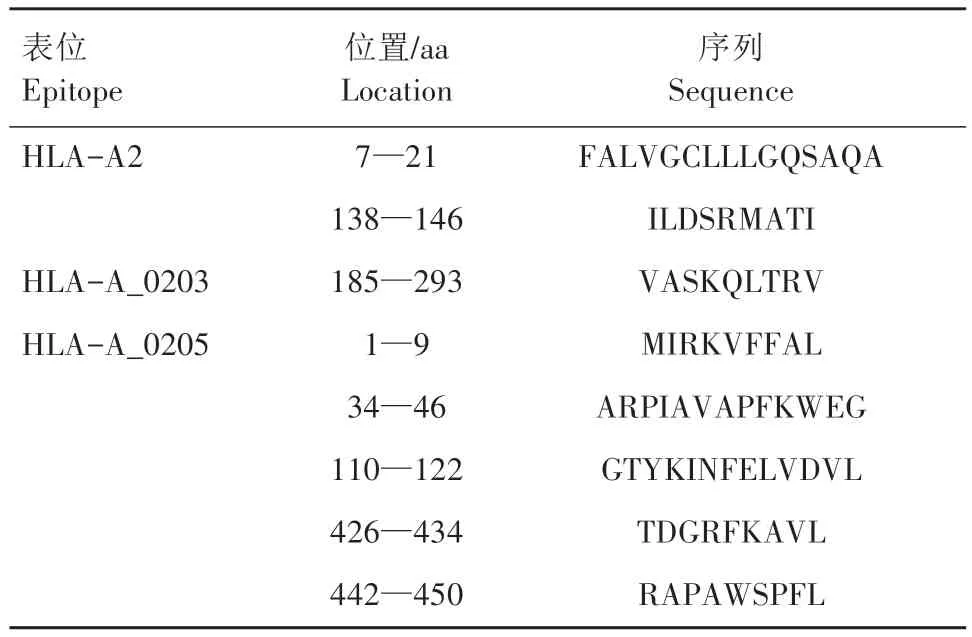
表2 TolB蛋白CTL抗原表位预测Tab.2 CTL peptide prediction results of TolB
2.9.2 TolB 蛋白Th 抗原表位预测 分别选择等位基因HLA-DRB1_0101、HLA-DRB1_0102 和HLADRB1_0301 预测Th 细胞抗原表位。预测得到HLA-DRB1_0101 的 表 位 为6—22、25—33、226—234 aa。预测得到HLA-DRB1_0102 的表位6 条,分别 为6—22、25—33、100—108、252—260、356—364、278—386 aa。预测得到HLA-DRB1_0301的表位8 条,分 别 为25—33、57—70、100—108、137—145、206—214、281—289、349—370、414—422 aa。将预测得到的Th抗原表位应用Vaxi-Jen 2.0软件进一步评估,最终确定2 个HLA-DRB1_0101 优势表位,1个HLA-DRB1_0102 优势表位和4 个HLADRB1_0301优势表位(表3)。

表3 TolB蛋白Th抗原表位预测Tab.3 Th peptide prediction results of TolB
3 结论与讨论
疫苗免疫是水产养殖疾病防控的重要手段。嗜水气单胞菌灭活疫苗通过诱导宿主免疫反应,对水生动物具有较好的免疫保护作用,因此被广泛研究和应用[16]。嗜水气单胞菌灭活疫苗对斑点叉尾鮰(Ictalurus punctatus)幼鱼表现出显著的免疫保护作用,免疫后能够诱导机体产生特异性抗体[17]。通过腹腔注射或浸泡接种嗜水气单胞菌灭活疫苗可显著上调细鳞鲳(Piaractus mesopotamicus)血清和皮肤黏液中溶菌酶和特异性抗体水平,从而提高感染后的存活率[18]。然而,由于嗜水气单胞菌来源广泛、血清型多,限制了灭活疫苗的免疫保护作用和应用范围。虽然嗜水气单胞菌减毒活疫苗和核酸疫苗也表现出很好的免疫保护作用,但这些研究还停留在实验室阶段[19]。
外膜蛋白TolB 在不同菌株之间高度保守,它在维持菌株外膜的完整性方面起关键作用,是制备亚单位疫苗的理想抗原[20,21]。KHAN 等[22]通过针对嗜肺军团菌疫苗开发的基因组学与反向疫苗学发掘到TolB 蛋白等3 个靶向蛋白可以作为潜在疫苗靶点。外膜蛋白TolB 作为一种候选疫苗,具有参与代谢途径简单、与其他蛋白质相互作用紧密、与人类微生物菌群蛋白相似度低且有较高抗原性的特点。本研究分析了嗜水气单胞菌TolB 蛋白的理化特性,发现TolB 蛋白是一个结构稳定的亲水性外膜蛋白。三级结构预测结果表明,TolB 蛋白具有多个可以形成表位的结构。这些结果都与嗜肺军团菌外膜蛋白TolB 的生物信息学分析结果极为相近。可见,嗜水气单胞菌TolB 蛋白也极有可能是一种潜在的候选疫苗。
生物信息学是随着人类基因组计划的发展而出现的一门新学科,现已成为基因组学和蛋白质组学研究的有力工具[23]。通过分析氨基酸序列、基本理化性质、跨膜结构、蛋白质翻译后修饰、三维结构和抗原性,能够筛选出潜在的抗原表位,从而加快疫苗的研究,避免浪费的重复工作和无效的试验过程[24]。生物信息学因其高效、经济的优点,已广泛应用于蛋白质结构分析、蛋白质功能研究和抗原表位预测等领域。SONG 等[12]利用生物信息学软件预测了鲍曼不动杆菌(Acinetobacter baumannii)TolB 蛋白的结构,表明TolB 是一种亲水性好、可塑性强、可及性高、抗原性指数高、T 细胞和B 细胞表位多的潜在的疫苗抗原。对4 株鲍曼不动杆菌的tolb基因片段进行测序,结果表明,TolB 蛋白的相似性为96.2%。前人对TolB氨基酸序列上的T细胞和B细胞表位进行了筛选和重组,设计了1个优秀的表位,并验证了免疫效果[9,25]。本研究利用生物信息学软件分析了TolB 蛋白的基本理化性质和翻译后修饰及二维和三维结构,利用专用的预测软件对TolB 蛋白潜在的B 细胞表位和T 细胞表位进行了预测,表明TolB 蛋白具有丰富的B 细胞和T 细胞抗原表位,可以开发成为诊断及治疗嗜水气单胞菌感染的新型表位疫苗。

