NRG1基因修饰的骨髓基质干细胞移植对大鼠脊髓半横切损伤的修复作用及其机制
符禹玄,陈君,赵富生,李媛媛,张可心,武庚*
1牡丹江医学院第一临床医学院骨科,黑龙江牡丹江 157000;2牡丹江医学院组织学与胚胎学教研室,黑龙江牡丹江157000
脊髓损伤(spinal cord injury,SCI)是一种由交通事故、高处坠落等引起的严重中枢神经系统疾病,主要表现为脊髓受损平面以下感觉、运动和自主神经功能障碍或丧失,可严重影响生活质量,同时给患者家庭和社会带来沉重的经济负担[1]。SCI可分为原发性和继发性损伤两个连续的病理阶段[2]。原发性SCI 多因脊柱骨折压迫脊髓引起,继发性损伤是由水肿、炎症反应、氧化应激、钙超载、神经元凋亡等继发性损害因素引起的一系列病理变化[3-4]。因此有效抑制神经元坏死和凋亡,恢复神经传导功能,成为临床治疗SCI 的重点和难题[5]。神经调节蛋白1(neureglin1,NRG1)是一种含表皮生长因子样结构域的跨膜蛋白,属于神经生长因子家族,参与突触塑形、髓鞘形成、神经细胞发育及成熟等多种生理过程[6]。研究发现,NRG1 与其下游信号受体ErbBs 结合,形成同源二聚体或异二聚体,通过激活胞内酪氨酸激酶,参与调控神经元和胶质细胞的增殖和分化过程[6]。NRG1还与阿尔茨海默病、帕金森病等多种神经退行性疾病的发生发展相关[7]。骨髓基质干细胞(bone marrow mesenchymal stem cells,BMSCs)是骨髓中的非造血干细胞,具有高度自我复制能力和多向分化潜能[8-10]。BMSCs可分泌多种神经细胞营养因子,如血管内皮生长因子、脑源性神经营养因子等,改善损伤局部微环境,促进损伤细胞修复[8]。BMSCs 易于进行基因修饰,并能够稳定表达外源基因[11],且取材方便,易于扩增,可降低免疫排斥反应,因而成为较理想的组织工程种子细胞[12]。有研究发现,在大鼠大脑中动脉闭塞模型中,BMSCs 移植可减轻卒中后脑组织损伤[13]。本研究通过建立大鼠SCI模型,移植并观察NRG1-BMSCs对SCI的修复作用,以期为临床治疗SCI提供新思路。
1 材料与方法
1.1 主要试剂及仪器 pcDNA3.1(+)-Nrg1-IRES/eGFP 质粒由广州赛业生物科技有限公司构建及鉴定;DMEM 培养液、胎牛血清、ECL 化学发光试剂盒(上海碧云天生物技术有限公司);青链霉素双抗溶液(SV30010,美国Hyclone 公司);FuGene6(E269,美国Promega 公司);NRG1 ELISA 试剂盒(上海康朗生物科技有限公司);兔抗鼠葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)、转录激活因子4(activating transcription factor 4,ATF4)、ATF6、C/EBP同源蛋白(C/EBP homologous protein,CHOP)、X-box结合蛋白1(X-box binding protein 1,XBP1)、B 淋巴细胞瘤-2 蛋白(B-cell lymphoma-2,Bcl-2)、Bcl-2 相关X蛋白(Bcl-2-asslciated protein X,Bax)抗体(武汉三鹰生物技术有限公司)。PVDF膜(上海碧云天生物技术有限公司);CO2细胞培养箱(MCO-15AC,日本SANYO公 司);微 量 注 射 器(UMC4 Micro4TMController)、Model ELX800 酶标仪(ELX800,美国Bio-Tek 公司);冷冻切片机(CM3050S,德国Leica 公司);体视显微镜(SMZ745T,日本Nikon公司);激光共聚焦显微镜(LSM700,德国Zeiss 公司);凝胶成像系统(Gel Doc XR+,美国Bio-Rad 公司);Image-Pro PLUS 图像分析软件(美国Meyer Instruments公司)。
1.2 方法
1.2.1 实验动物 4 周龄SPF 级SD 大鼠4 只,体重(100±5) g,用于BMSCs 分离培养;8 周龄SPF 级SD大鼠43 只,雌22 只,雄21 只,体重(280±20) g,由牡丹江医学院实验动物中心提供[实验动物使用许可证号:SYXK(黑)2019-006]。实验前适应性饲养1周,环境温度20~24 ℃,湿度42%~46%,昼夜12 h 交替光照,自由摄食饮水。实验过程符合国家及单位实验动物的管理和使用规定。
1.2.2 BMSCs 分离培养 将4周龄SD 大鼠颈椎脱臼处死,置70%乙醇中浸泡10 min,无菌条件下分离股骨和胫骨,剪除骨骺,暴露骨髓腔,用20 ml DMEM 培养液冲洗骨髓腔,经200 目无菌筛网过滤后,将细胞接种于50 ml 培养瓶中,置于37 ℃、5%CO2培养箱中培养,72 h后更换培养液,去除未贴壁细胞,之后每隔3 d更换1次培养液,于倒置相差显微镜下观察细胞形态变化,并采集图像。当细胞融合度达80%~90%时,进行传代培养,取第3 代BMSCs进行后续实验。
1.2.3 NRG1 质 粒 转 染BMSCs 将BMSCs 按1×105个/ml接种于6孔板,当细胞融合度达80%时,按照FuGene6 说明书将NRG1 质粒或空载质粒转染入BMSCs,具 体 操 作 如 下:取91 μl DMEM、6 μl FuGene6、3 μl NRG1 质粒混匀后加入BMSCs 培养液中,培养48 h 后更换含G418 的培养液,收集G418抗性NRG1-BMSCs 扩增培养,在荧光显微镜下观察BMSCs 转染情况,并采集图像。按照ELISA 试剂盒说明书步骤分别检测BMSCs 和NRG1-BMSCs 裂解液及培养液中NRG1蛋白含量。
1.2.4 细胞增殖检测 取生长状态良好的BMSCs 和NRG1-BMSCs,制备细胞悬液,调整细胞密度为1×105个/ml,以每孔相同的细胞数接种于24 孔板,连续培养14 d,每天取3孔细胞消化,应用细胞计数板计数,取平均值绘制细胞生长曲线。
1.2.5 动物实验分组及脊髓半横切损伤模型制备取8周龄SPF级SD大鼠随机分为对照组(n=10)、SCI模型组(n=10)、空载体-BMSCs(BMSCs)组(n=10)和NRG1-BMSCs 组(n=13,其中3 只用于细胞迁移检测)。SCI 模型组、BMSCs 组和NRG1-BMSCs 组大鼠参照赵富生等[14]的方法,建立脊髓半横切模型。具体操作如下:用1.5%戊巴比妥钠(30 mg/kg)腹腔注射麻醉大鼠,俯卧位固定于手术台上,背部手术区去毛、消毒,以T8棘突为中心,行背部正中纵行切口,长约3 cm,用眼科弯镊钝性分离筋膜及双侧椎旁肌,暴露T7-T9三个棘突、双侧椎板及横突,用止血钳固定T8并轻轻向上提起,张开椎间隙,剪除T8棘突及棘突下椎板暴露脊髓,在体式显微镜下,用眼科虹膜刀紧贴脊髓正中动脉右侧垂直刺入脊髓至椎管底部,刀锋向右划动至右侧脊髓完全横断,大鼠即刻出现一过性鼠尾连续性抽动和后肢持续性痉挛,表示造模成功。术后使用无菌明胶海绵填塞术区,逐层缝合硬脊膜、肌肉、筋膜和皮肤,注射青霉素(20 万U/kg),2 次/d,连续3 d,将饲料、饮水置于大鼠可及范围,保持垫料干燥。
造模成功后2 h,BMSCs 组和NRG1-BMSCs 组大鼠在脊髓损伤中心(垂直进针)以及损伤中心上、下0.5 cm 处倾斜45°进针,刺入深度为1.5 mm,使用微量注射器以5 μl/min 匀速注入5 μl BMSCs 或NRG1-BMSCs 悬液(1×107个/ml)至皮质脊髓侧束(图1),注射后留针3 min;SCI 模型组以同样方法注入15 μl PBS。对照组仅行T8棘突及椎板切除术。
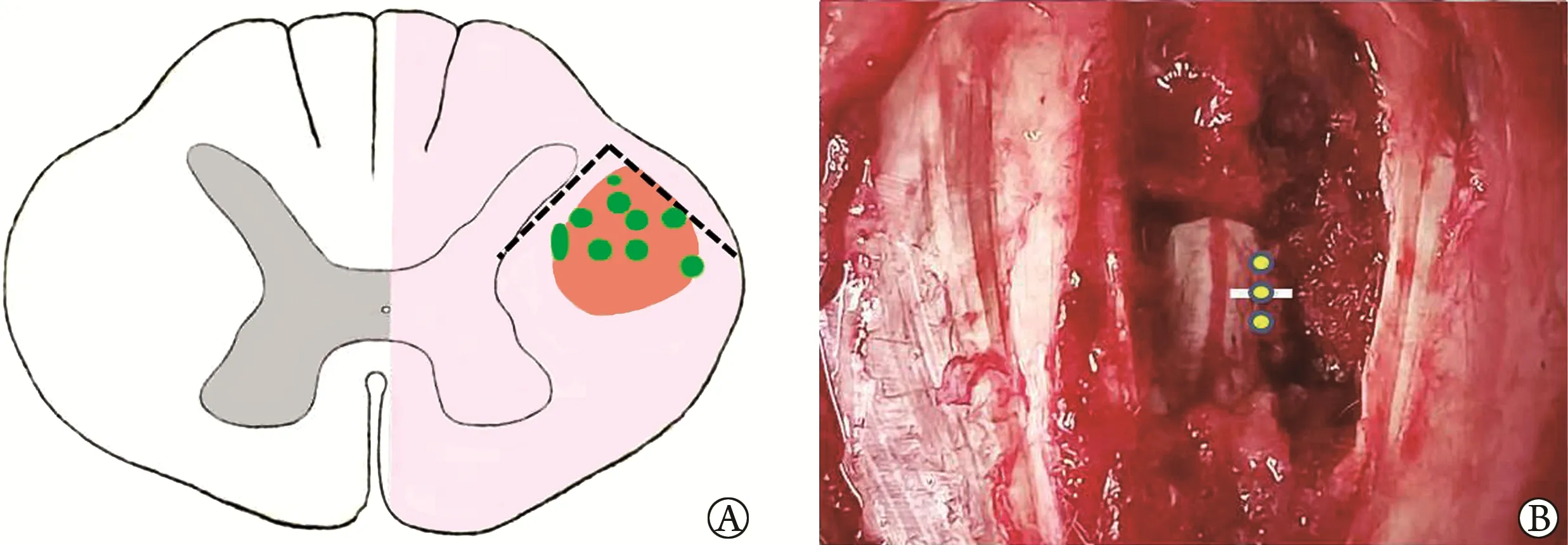
图1 大鼠脊髓半横切损伤模型及细胞移植示意图Fig.1 Schematic diagram of rat spinal cord hemisection injury model and cell transplantation
1.2.6 大鼠术后运动功能和脊髓组织病理学及相关蛋白表达水平观察
1.2.6.1 NRG1-BMSCs 迁移及分布观察 细胞移植第7天,随机选取NRG1-BMSCs组3只大鼠,用1.5%戊巴比妥钠过量麻醉后,左心室插管灌注4%多聚甲醛溶液,切取损伤节段脊髓用OCT包埋,冰冻切片机常规切片(厚度6~10 μm)。采用DAPI 染细胞核,用抗荧光淬灭剂封片后,于荧光显微镜下观察NRG1-BMSCs迁移及分布情况。
1.2.6.2 大鼠后肢运动功能评估 造模后第1、7、14、21、28 天,各组随机选取6 只大鼠进行BBB 评分和斜板实验。BBB 评分范围为0~21 分,0 分表示瘫痪,21 分表示后肢运动功能正常。斜板实验将大鼠置于平坦、不光滑的斜板上,斜板由0°缓慢上升,每次升高5°,大鼠坚持时间至少5 s不从斜板上跌落为成功,使用量角器测量斜板角数。实验采用双盲、双人独立完成评价,最终结果取平均值。
1.2.6.3 HE 染色、Nissl 染色和TUNEL 染色 完成BBB 评分和斜板实验后,各组随机选取5 只大鼠经1.5%戊巴比妥钠过量麻醉后,剖胸行左心室插管,灌注4%多聚甲醛溶液固定,切取0.5 cm损伤节段脊髓,以损伤为中心横断为两段,一段制备石蜡切片行HE 染色和Nissl 染色,另一段制备冰冻切片行TUNEL染色。
HE染色:石蜡切片经二甲苯脱蜡和梯度乙醇水化后,苏木精染液染色10 min,1%酸性乙醇浸泡5 s,蒸馏水漂洗,置于伊红溶液中染色5 min,经梯度乙醇脱水、中性香脂封片后,于光学显微镜下观察组织形态结构,并采集图像。
Nissl 染色:切片经脱蜡水化后,置于Nissl 染液中染色,于光学显微镜下观察脊髓组织神经元形态结构以及尼氏体密度和分布情况。
TUNEL 染色:取冰冻切片,按照TUNEL 试剂盒说明书进行染色,在激光共聚焦显微镜下观察,TUNEL 阳性细胞呈现红色荧光,采用ImageJ 软件分析TUNEL 阳性细胞率。TUNEL 阳性细胞率(%)=(TUNEL阳性细胞数/DAPI染色细胞数)×100%。
1.2.6.4 Western blotting 检测脊髓组织中内质网应激相关蛋白及凋亡相关蛋白的表达 完成BBB 评分和斜板实验后,取各组剩余5 只大鼠的脊髓组织,经RIPA 裂解、离心,取上清采用BCA 法测定蛋白含量。通过SDS-PAGE 凝胶电泳分离蛋白,经转膜、封闭后,加入XBP1(1∶1000)、CHOP(1∶800)、ATF4(1∶1000)、ATF6(1∶1000)、GRP78(1∶800)、Bcl-2(1∶500)、Bax(1∶400)和β-actin(1∶2000)一抗,4 ℃孵育过夜,次日TBST清洗3次,加入相应二抗37 ℃孵育2 h,滴加ECL发光试剂,置于成像仪中成像,应用ImageJ软件分析目的蛋白条带相对灰度值。
1.3 统计学处理 应用SPSS 18.0 软件进行统计分析。所有数据以±s表示,两组间比较采用独立样本t 检验,多组间比较采用单因素方差分析,方差齐时,进一步两两比较采用Bonferroni 校正t 检验;方差不齐时,进一步两两比较采用Tamhane's T2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 BMSCs 培养及NRG1 基因修饰 倒置相差显微镜观察显示,培养第1 天,BMSCs 呈圆形、不规则形或多角形,分布均匀(图2A);培养第3 天,BMSCs 形成多个散在集落,紧密排列呈聚集生长(图2A);传代培养后,BMSCs 分布均匀呈长梭形或束状生长(图2A)。荧光显微镜观察显示,转染NRG1基因后,BMSCs呈明亮绿色荧光(图2B)。
ELISA 法检测结果显示,BMSCs 培养液和裂解液中NRG1 含量在转染24 h 略有升高,但差异无统计 学 意 义(P>0.05),转 染48 h 明 显 升 高(P<0.05,图2C、D)。
细胞增殖检测结果显示,BMSCs 和NRG1-BMSCs生长曲线呈S形(图2E)。接种后第1~3天为滞留期,第6~8天进入对数生长期,第12天达到高峰,此后细胞生长缓慢,进入平台期,且NRG1-BMSCs增殖速度明显快于BMSCs(P<0.05,图2E)。
2.2 NRG1-BMSCs 迁移和分布情况 移植第7 天,NRG1-BMSCs 大鼠脊髓组织切片中可观察到呈现绿色荧光的移植细胞,细胞呈圆形、椭圆形或不规则形状,多聚集在损伤中心,偶见少量NRG1-BMSCs向损伤中心周围区域迁移扩散(图3)。

图3 GFP标记的NRG1-BMSCs在脊髓组织内示踪观察(A-C,×50;D,×100)Fig.3 Trace observation of GFP-labeled NRG1-BMSCs in spinal cord tissues
2.3 各组大鼠后肢运动功能比较 术前各组大鼠BBB 评分均为21 分。术后第1、7、14、21、28 天,SCI模型组、BMSCs组和NRG1-BMSCs组BBB评分均明显低于对照组(P<0.05)。术后第7、14 天,SCI 模型组、BMSCs 组和NRG1-BMSCs 组BBB 评分均较术后第1 天增高,但组间比较无统计学差异(P>0.05);术后第21、28 天,NRG1-BMSCs 组BBB 评分明显高于SCI 模型组和BMSCs 组(P<0.05),BMSCs 组与SCI模型组BBB评分无统计学差异(P>0.05,图4A)。
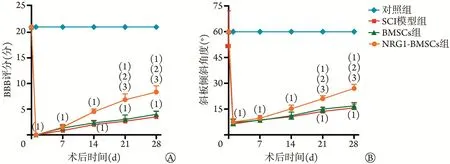
图4 移植后不同时间点各组大鼠BBB评分和斜板倾斜角度比较Fig.4 Comparison of the BBB scores and the slope angle of rats in each group at different time points after transplantation
术前各组大鼠斜板实验均为60°,术后第1、7、14、21、28 天,SCI 模 型 组、BMSCs 组 和NRG1-BMSCs 组斜板倾斜角度均明显低于对照组(P<0.05)。术后第7、14 天,SCI 模型组、BMSCs 组和NRG1-BMSCs 组斜板倾斜角度均较术后第1 天增高,但组间差异无统计学意义(P>0.05);术后第21、28 天,NRG1-BMSCs组斜板倾斜角度明显高于SCI模型组和BMSCs组(P<0.05),BMSCs组与SCI模型组斜板倾斜角度无统计学差异(P>0.05)(图4B)。
2.4 各组大鼠脊髓组织病理学改变 HE 染色结果显示,移植第28天,对照组脊髓组织结构清晰,神经元形态结构正常,细胞核大而圆,核仁明显;SCI模型组脊髓灰质中有炎性细胞浸润,空洞较多,可见神经元核固缩、凋亡;BMSCs 组脊髓组织结构紊乱,神经元形态不规则,空洞明显;NRG1-BMSCs组脊髓组织中炎性细胞浸润明显减少,神经元核固缩、坏死减轻,空洞减少(图5)。
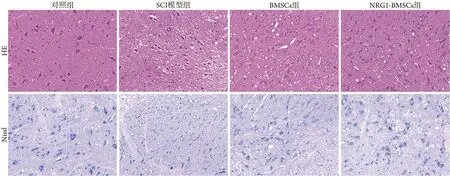
图5 各组大鼠脊髓组织HE染色(×200)和Nissl染色(×200)Fig.5 HE staining and Nissl staining of spinal cord tissues of rats in each group
Nissl 染色结果显示,对照组神经元胞质中尼氏体丰富、染色清晰;SCI 模型组神经元溶解、破坏,尼氏体密度降低;BMSCs组神经元排列紊乱、皱缩,尼氏体减少;NRG1-BMSCs组神经元形态结构完整,尼氏体密度明显增加(图5)。
2.5 各组大鼠脊髓组织中内质网应激相关蛋白表达水平比较 Western blotting检测结果显示,与对照组相比,SCI 后大鼠脊髓组织中内质网应激相关蛋白XBP1、CHOP、ATF4、ATF6 和GRP78 表达水平明显升高(P<0.05);经NRG1-BMSCs移植治疗后,内质网应激相关蛋白表达水平明显降低(P<0.05),但未恢复到对照组水平(P<0.05);SCI模型组与BMSCs组脊髓组织中XBP1、CHOP、ATF4、ATF6 和GRP78 蛋白表达水平差异无统计学意义(P>0.05)(图6)。

图6 各组大鼠脊髓组织内质网应激相关蛋白XBP1、CHOP、ATF4、ATF6和GRP78表达水平比较Fig.6 Comparison of expression levels of endoplasmic reticulum stress-related proteins XBP1, CHOP, ATF4, ATF6 and GRP78 in rat spinal cord tissues
2.6 各组大鼠脊髓组织TUNEL 染色阳性细胞率比较 细胞移植第28 天,SCI 模型组脊髓损伤区域可见大量TUNEL 阳性细胞(细胞核呈红色),而NRG1-BMSCs 组TUNEL 阳性细胞明显减少(图7)。NRG1-BMSCs 组TUNEL 阳性细胞率明显低于SCI 模型组(P<0.05),但 高 于 对 照 组(P<0.05);SCI 模 型 组 与BMSCs 组TUNEL 阳性细胞率差异无统计学意义(P>0.05)(图7)。

图7 各组大鼠脊髓组织TUNEL阳性细胞率比较(TUNEL ×200)Fig.7 Comparison of TUNEL-positive cells rate in spinal cord tissues of rats in each group (TUNEL ×200)
2.7 各组大鼠脊髓组织中凋亡相关蛋白表达水平比较 Western blotting 检测结果显示,细胞移植第28天,与对照组相比,SCI 后大鼠脊髓组织中Bcl-2 蛋白表达水平明显降低(P<0.05),Bax 蛋白表达水平明显升高(P<0.05);NRG1-BMSCs组损伤节段脊髓组织中Bcl-2 蛋白表达水平明显高于BMSCs 组和SCI 模型组(P<0.05),而Bax 蛋白表达水平明显低于BMSCs 组和SCI 模型组(P<0.05);BMSCs 组与SCI 模型组Bcl-2、Bax 蛋白表达水平比较差异无统计学意义(P>0.05)(图8)。
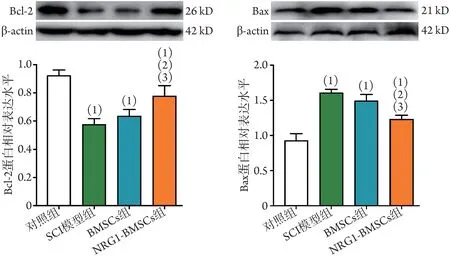
图8 各组大鼠脊髓组织中凋亡相关蛋白Bcl-2、Bax表达水平比较Fig.8 Comparison of expression levels of apoptosis-related proteins Bcl-2 and Bax in spinal cord tissues of rats in each group
3 讨 论
SCI通常是由脊柱创伤引起的破坏性中枢神经系统疾病,目前其治疗方法主要包括药物治疗、手术减压、康复理疗等手段,但均未取得满意效果。本研究采用脊髓半横切损伤模型,探讨移植NRG1 基因修饰的BMSCs 对SCI 的保护作用,结果显示,NRG1能够提高BMSCs的治疗效果,促进大鼠SCI后运动功能恢复,其机制可能与增加BMSCs 增殖活性、抑制脊髓组织细胞凋亡、减轻内质网应激有关[15]。
BMSCs 具有在特定条件下分化为神经细胞的特性,并可自体移植、促进轴突再生,因而在中枢神经系统疾病治疗中应用前景广阔[16]。研究发现,BMSCs 中MHC-I 类分子表达水平较低,且缺乏MHC-Ⅱ类分子和共刺激分子表达,这些特性致使BMSCs 移植后极少引起同种异体免疫排斥反应[17]。此外,BMSCs 通过分泌白细胞抗原G5、T 淋巴细胞发育抑制因子、白血病抑制因子以及γ 干扰素,可使其免受T淋巴细胞和NK细胞的损害[17]。有研究发现,将BMSCs 移植于SCI 模型大鼠中,大鼠损伤部位M2 型巨噬细胞数量明显增多,M1 型巨噬细胞数量明显减少,且脊髓组织中TNF-α、IL-6 含量也明显减少,提示BMSCs 可减轻SCI 炎症反应。同时,BMSCs 能够减轻SCI 后神经性疼痛,阻止血脊髓屏障破坏,抑制星形胶质细胞增生引起的瘢痕形成[18]。但研究发现,单纯移植BMSCs 治疗效果有限,联合其他治疗方式或进行基因修饰能够显著提高BMSCs的治疗效果[17]。有研究发现,将KLF7 基因导入BMSCs,可明显上调BMSCs 中KLF7 的表达,提高BMSCs的增殖活性,抑制BMSCs凋亡,增高BMSCs中神经生长因子分泌水平[19]。本研究成功分离培养BMSCs,并转染NRG1基因。在NRG1修饰的BMSCs培养液和细胞裂解液中,NRG1 表达水平呈时间依赖性增高,并能够显著增加BMSCs 的增殖活性,提示将NRG1-BMSCs 移植到脊髓组织可能增加损伤组织中NRG1 含量,一定程度改善局部微环境,促进神经修复。同时,NRG1 也可能促进BMSCs 存活以及向损伤部位迁移,改善神经功能。有研究发现,应用NRG1 基因转染人脂肪源性基质干细胞,能够上调该细胞中NRG1的表达;将NRG1高表达的脂肪基质干细胞注射到大鼠纹状体14 d 后,可增高大鼠脑组织中NRG1 蛋白表达水平,促进卒中大鼠肢体运动功能恢复[20]。NRG1 是神经调节蛋白家族中信号蛋白,含有表皮生长因子样结构域,通过与其下游ErbB2、ErbB3 和ErbB4 受体结合,介导神经元迁移分化、髓鞘形成、神经肌肉接头发育,参与调节神经元兴奋性、突触塑形、神经传递,以及维持脑稳态,并在学习和记忆过程中发挥重要作用[21]。有研究发现,鞘内注射NRG1蛋白可减轻SCI后炎症反应,减少硫酸软骨素聚糖蛋白生成,抑制损伤区胶质瘢痕形成,促进SCI后大鼠神经功能恢复[22]。
研究发现,BMSCs 可合成包括外泌体在内的多种细胞因子,抑制损伤局部炎症反应、细胞凋亡,进而促进SCI后神经功能修复[23]。有临床研究报道,经椎管内移植或静脉输注BMSCs,2 年后核磁共振成像显示SCI 患者脊髓组织结构改善,肢体感觉和运动功能明显恢复,且无感染、疼痛及肿瘤形成等并发症发生[24]。体视学检查发现,经静脉移植BMSCs 可阻止SCI 后脊髓灰质和白质体积减小,抑制损伤区神经元凋亡[25]。本研究HE 染色和Nissl 染色结果显示,NRG1-BMSCs 移植后大鼠脊髓组织灰质和白质结构清晰,坏死区明显缩小,脊髓灰质中神经细胞形态清晰可见,大部分神经元形态结构正常,提示移植NRG1-BMSCs 有利于抑制SCI 引起的核固缩,恢复受损神经元尼氏体密度,减轻SCI 诱导的神经元损伤,进而促进SCI 后神经电生理功能恢复。有研究发现,BMSCs 移植结合超短波治疗可抑制SCI 后空洞形成,减轻损伤组织炎症反应,促进大鼠运动诱发电位恢复[26]。本研究通过原位移植NRG1-BMSCs治疗SCI,经BBB运动功能评分和斜板实验观察显示,NRG1-BMSCs能明显改善大鼠SCI后肢体运动功能。由此推测,移植携带外源性NRG1基因的BMSCs 可能通过改善损伤局部微环境,抑制细胞凋亡过程,从而促进大鼠SCI 后肢体运动功能恢复。
研究发现,内质网应激介导的细胞凋亡参与SCI的病理过程[27]。内质网是真核生物细胞中一种重要细胞器,具有合成、修饰和转运蛋白质的功能。内质网应激为细胞的一种防御和自我保护机制,但剧烈而持久的内质网应激反应可导致细胞损伤甚至凋亡[28-29]。在SCI过程中,机体在炎症、氧化应激或其他致病因素刺激下,内质网功能可能受到影响,导致错误折叠蛋白在内质网中堆积,继而诱发内质网应激反应。研究发现,当内质网应激持续存在时,机体可通过启动内质网信号途径激活凋亡相关因子而诱发细胞凋亡[30]。蛋白激酶类RNA 内质网激酶(protein kinase RNA-like endoplasmic reticulum kinase,PERK)是位于内质网膜上的Ⅰ型跨膜蛋白,也是参与机体适应性应答的关键蛋白受体。正常生理条件下,PERK与GRP78结合处于无活性状态;当内质网应激发生时,PERK与GRP78解离磷酸化而激活,促使eIF2α 活化并上调ATF4 的表达,进而促进CHOP蛋白合成,最终激活下游信号分子转导,诱发细胞凋亡[31]。研究发现,内质网应激在SCI 早期即被激活,在脊髓组织中内质网应激相关蛋白GRP78、PERK、eIF2α、CHOP表达明显上调[32],与本研究结果一致。本研究发现,SCI 大鼠脊髓组织中GRP78、ATF4、CHOP、XBP1、ATF6 蛋白表达水平明显增高,经NRG1-BMSCs 治疗后,脊髓组织中内质网应激相关蛋白表达水平明显降低,提示NRG1-BMSCs能够调控内质网应激信号通路,减轻内质网应激引起的组织损伤,进而发挥神经保护作用。Bax基因是机体中主要的凋亡基因,具有促进细胞凋亡的作用。Bcl-2 主要定位于线粒体外膜上,通过调控线粒体膜通透性,发挥抑制细胞凋亡的作用[33]。本研究结果表明,NRG1-BMSCs 移植能够减少脊髓损伤区TUNEL 阳性细胞数,同时降低脊髓组织中Bax 蛋白水平,提高Bcl-2 蛋白水平。由此推测,NRG1-BMSCs 可能通过调节内质网应激介导的凋亡途径,抑制SCI诱导的细胞凋亡。
综上所述,移植NRG1-BMSCs能够促进大鼠SCI后运动功能恢复,其作用机制可能包括:(1)NRG1促进BMSCs 在脊髓组织内增殖、存活及迁移,参与受损神经组织修复,进而促进大鼠运动功能恢复;(2)NRG1-BMSCs 参与改善损伤局部微环境,促进轴突再生和髓鞘形成;(3)NRG1-BMSCs 可能通过分泌NRG1 及多种神经营养因子,促进神经组织结构重构;(4)NRG1-BMSCs 可能通过调节内质网应激介导的凋亡通路,抑制细胞凋亡。本研究结果表明,移植NRG1-BMSCs 能够减轻SCI,改善大鼠运动功能,为其用于临床治疗SCI 提供了实验依据。但本研究未深入探讨NRG1-BMSCs 对大鼠脊髓组织分化、轴突再生及髓鞘化、胶质细胞增生和胶质瘢痕形成的影响,以及对脊髓损伤局部血管形成和炎症反应的作用,后续需进一步探讨NRG1-BMSCs 的神经保护作用及分子机制。

