碧绿米仔兰茎枝化学成分及其生物活性研究
千 一,李如琪,吴俊丽,李 欣,张 峰*
(1.河南大学第一附属医院,河南 开封 475000; 2.河南大学中医药研究院,药学院,河南 开封 475004)
碧绿米仔兰Aglaiaperviridis是楝科米仔兰属植物,主要生长在中国南部及西南部,其枝叶或花朵在民间常作为草药使用。米仔兰属药用植物中富含多种类型的次生代谢产物,包括Flavagline 类、萜类、黄酮类、生物碱类等,具有抗炎、抗菌、抗肿瘤等作用[1-5]。本实验对碧绿米仔兰茎枝的化学成分及其生物活性进行研究,从中分离得到21 个化合物,并首次分别采用T-AOC 试剂盒及MTT 法评价其抗氧化活性和神经保护活性,化合物1 ~20 均为首次从该种植物中分离得到。化合物2、9、10、14~20 具有较强的总抗氧化能力; 化合物10 的神经保护作用与浓度呈正相关,化合物9、15 的最佳浓度分别为50、100 μmol/L。
1 材料
1.1 药物与试剂 甲醇、乙腈均为色谱纯; 二氯甲烷、乙酸乙酯、甲醇、石油醚均为分析纯,购自天津市富宇精细化工有限公司; 氘代甲醇和氘代氯仿购自宁波旋光医药科技有限公司; C18反相填料购自上海博势生物科技有限公司; 硅胶GF254薄层板和柱层析硅胶(200~300、300~400 目) 购于青岛海洋化工有限公司; 总抗氧化能力 (T-AOC)测定试剂盒购自南京建成生物工程研究所; 维生素C 购自上海阿拉丁生化科技股份有限公司; 依达拉奉注射液(20 mL/30 mg) 购自吉林省博大制药股份有限公司; 30%过氧化氢购自天津市科密欧化学试剂有限公司。人源神经母细胞瘤 (SH-SY5Y)购自中国科学院上海生化细胞所。碧绿米仔兰药材采集于云南西双版纳,经河南大学药学院袁王俊教授鉴定为正品。
1.2 仪器 LC-20AT 型高效液相色谱仪、LC-6A型制备高效液相色谱仪(日本岛津公司); 基质辅助激光解析离子飞行质谱检测仪、AVANCE AV-300 核磁共振波谱仪(德国Bruke 公司); Agilent 1100 Series LC/MSD Trap 质谱仪(美国安捷伦公司); 摇摆式粉碎机(温岭市林大机械有限公司);旋转蒸发仪(郑州长城科工贸有限公司)。
2 提取与分离
取碧绿米仔兰茎枝10 kg,粉碎成粗粉,95%乙醇加热回流提取3 次。提取液过滤后减压浓缩成浸膏(926.5 g),分别用石油醚、二氯甲烷、乙酸乙酯萃取,萃取液减压浓缩,分别得到浸膏139、43.6、40 g。
二氯甲烷浸膏43.6 g 经石油醚-乙酸乙酯(50 ∶1、20 ∶1、10 ∶1、5 ∶1、2 ∶1、1 ∶1) 梯度洗脱,TLC 检测合并后得到Fr.1 ~Fr.6; Fr.1、Fr.2 中分别直接获得化合物1 (72.3 mg)、21(60.9 mg)。Fr.3 经硅胶柱分离,以石油醚-乙酸乙酯(15 ∶1) 洗脱,得到化合物2 (9.8 mg)。Fr.4 经硅胶柱分离,以石油醚-乙酸乙酯(10 ∶1)洗脱,得到化合物3 (6 mg)、4 (49.7 mg)、5(211.6 mg)。Fr.5、Fr.6 经硅胶柱分离,以石油醚-乙酸乙酯(8 ∶1) 洗脱,得到化合物6 (21.8 mg)、7 (6.7 mg)。
乙酸乙酯部位浸膏40 g,以二氯甲烷-甲醇(100 ∶1、50 ∶1、30 ∶1、20 ∶1、10 ∶1、5 ∶1、1 ∶1) 梯度洗脱,经TLC 检测合并,得到Fr.1~Fr.7。从Fr.1 直接得到化合物8 (51.5 mg)。Fr.4经ODS 分离,以20% ~90% 甲醇梯度洗脱,在30%甲醇流分中直接得到化合物11 (16.2 mg),40%甲醇的洗脱液经TLC 检测合并后得到Fr.4-1~Fr.4-3。Fr.4-1 经制备HPLC 分离(流动相33%乙腈-水,检测波长210、254 nm,体积流量3 mL/min),得到化合物18 (tR=23 min,10.5 mg)。Fr.4-2 经制备HPLC 分离(流动相25%乙腈-水,检测波长210、254 nm,体积流量3 mL/min),得到化合物13 (tR=22 min,18.6 mg)、10 (tR=27 min,19.9 mg)、19 (tR=31.5 min,14.7 mg)。从Fr.4-3 直接得到化合物9 (6 mg)。从Fr.5 直接得到化合物12 (16.8 mg)。Fr.6 经ODS 分离,以20% ~90%甲醇梯度洗脱,20% 甲醇流分经制备HPLC 分离(流动相15%乙腈-水,检测波长210、254 nm,体积流量3 mL/min),得到化合物15 (tR=27 min,275.7 mg)、16 (tR=33 min,153 mg)、17 (tR=40.5 min,85.6 mg); 30%甲醇流分经制备HPLC 分离(流动相25%乙腈-水,检测波长210、254 nm,体积流量3 mL/min),得到化合物14 (tR=40 min,4.7 mg)、20 (tR=62 min,39 mg)。
3 结构鉴定
化合物1: 白色粉末(甲醇),分子式C30H52O3,ESI-MSm/z: 483.52 [M +Na]+。1H-NMR (300 MHz,DMSO-d6)δ: 0.74 (3H,s),0.78 (3H,s),0.81 (3H,s),0.84 (3H,s),0.90 (3H,s),0.98 (3H,s),1.02 (3H,s),1.03 (3H,s);13C-NMR (75 MHz,DMSO-d6)δ: 31.8 (C-1),24.4 (C-2),77.3 (C-3),36.5 (C-4),48.8(C-5),19.5 (C-6),35.4 (C-7),44.6 (C-8),54.6 (C-9),37.5 (C-10),21.4 (C-11),27.5(C-12),43.9 (C-13),50.2 (C-14),33.5 (C-15),28.0 (C-16),49.5 (C-17),16.3 (C-18),12.6 (C-19),86.4 (C-20),23.6 (C-21),35.9(C-22),26.4 (C-23),83.5 (C-24),71.5 (C-25),27.4 (C-26),24.5 (C-27),28.5 (C-28),22.2 (C-29),16.8 (C-30)。以上数据与文献[6] 报道基本一致,故鉴定为3-epicotillol。
化合物2: 无色结晶(甲醇),分子式C9H10O5。与三氯化铁-铁氰化钾和与溴甲酚绿反应呈阳性,ESI-MSm/z: 196.9 [M-H]-。1H-NMR (300 MHz,CD3OD)δ: 7.33 (2H,s,H-2,6),3.88 (6H,s,H-3,5-OCH3);13C-NMR (75 MHz,CD3OD)δ:121.9 ( C-1),108.2 ( C-2),148.8 ( C-3),141.7 (C-4),148.8 (C-5),108.2 (C-6),56.7(3,5-OCH3),169.8 (-COOH)。以上数据与文献[7] 报道基本一致,故鉴定为丁香酸。
化合物3: 白色无定形粉末(氯仿),分子式C16H32O2,与溴甲酚绿反应呈阳性,ESI-MSm/z:255.1 [M-H]-,碎片离子峰213.2 [M-C3H7]-。1HNMR (300 MHz,CDCl3)δ: 2.35 (2H,t,J=7.6 Hz,H-2),1.52 (2H,m,H-3),1.25~1.38(16H,m,H-4 ~13),1.25 (2H,m,H-14),1.38 (2H,m,H-15),0.88 (3H,t,J=7.2 Hz,H-16);13C-NMR (75 MHz,CDCl3)δ: 178.9 (C-1),34.0 (C-2),32.1 (C-14),29.9 (C-6 ~11),29.6 (C-12),24.8 (C-3),29.5 (C-5),29.4 (C-13),29.2 (C-4),22.8 (C-15),14.3(C-16)。以上数据与文献[8] 报道基本一致,故鉴定为棕榈酸。
化合物4: 黄色油状液体 (氯仿),分子式C18H26O4,ESI-MSm/z: 307.4 [M +H]+。1H-NMR(300 MHz,CDCl3)δ: 7.68 (2H,dd,J=3.2,5.6 Hz,H-3,6),7.52 (2H,dd,J=3.2,5.6 Hz,H-4 ~5),4.29 (4H,t,J=6.8 Hz,H-8,8′),1.70 (4H,m,H-9,9′),1.44 (4H,m,H-10,10′),1.24 (4H,s,H-11,11′),0.94(6H,t,J=7.2 Hz,H-12,12′);13C-NMR (75 MHz,CDCl3)δ: 132.3 (C-1 ~2),131.0 (C-4,5),128.9 (C-3,6),167.8 (C-7,7′),65.6(C-8,8′),30.6 (C-9,9′),29.8 (C-10,10′),19.2 (C-11,11′),13.9 (C-12,12′)。以上数据与文献[9] 报道基本一致,故鉴定为邻苯二甲酸二戊酯。
化合物5: 黄色油状液体,分子式C10H12O3,ESI-MSm/z: 203.2 [M+Na]+。1H-NMR (300 MHz,CDCl3)δ: 7.24 (2H,d,J=8.8 Hz,H-2,6),6.92 (2H,d,J=8.8 Hz,H-3,5),4.32 (2H,q,J=7.1 Hz,H-1′),1.40 (3H,t,J=7.1 Hz,H-2′);13C-NMR (75 MHz,CDCl3)δ: 130.3 (C-2,6),115.5 (C-3,5),125.2 (C-1),155.2(C-4),40.4 (C-7),61.2 (C-1′),14.2 (C-2′),173.3 (C-8)。以上数据与文献[10] 报道基本一致,故鉴定为对羟基苯乙酸乙酯。
化合物6: 无色针状结晶 (甲醇),分子式C10H8O4,ESI-MSm/z: 193.3 [M +H]+。1H-NMR(300 MHz,DMSO-d6)δ: 6.20 (1H,d,J=9.6 Hz,H-3),7.89 (1H,d,J=9.6 Hz,H-4),3.81 (3H,s,-OCH3),7.21 (1H,s,H-5),6.78 (1H,s,H-8);13C-NMR (75 MHz,DMSO-d6)δ: 160.6 (C-2),111.6 (C-3),144.6 (C-4),109.7 ( C-5),145.3 ( C-6),151.0 ( C-7),102.9 ( C-8),149.6 ( C-9),110.4 ( C-10),55.9 (-OCH3)。以上数据与文献[11] 报道基本一致,故鉴定为6-甲氧基-7 羟基香豆素。
化合物7: 白色油状物 (氯仿),分子式C8H18O,ESI-MSm/z: 153.4 [M +Na]+。1H-NMR(300 MHz,CDCl3)δ: 3.66 (2H,s,H-1),0.88 (3H,t,J=6.4 Hz,8-CH3),1.53 (2H,s,H-2),1.25 (n× CH2);13C-NMR (75 MHz,CDCl3)δ: 7.4 (C-1),32.1 (C-2),30.2 (C-3),29.9 (C-4),29.5 (n×CH2),22.9 (C-7),14.2 (C-8)。以上数据与文献[12] 报道基本一致,故鉴定为1-辛醇。
化合物8: 无色针状结晶 (甲醇),分子式C8H8O3,与三氯化铁-铁氰化钾和溴甲酚绿反应呈阳性,ESI-MSm/z: 153.4 [M+H]+。1H-NMR (300 MHz,CD3OD)δ: 7.07 (2H,d,J=8.5 Hz,H-2′,6′),6.74 (2H,d,J=8.5 Hz,H-3′,5′),3.48 (2H,s,H-2);13C-NMR (75 MHz,CD3OD)δ: 176.5 (C-1),41.0 (C-2),157.2 (C-4′),131.2 (C-2′,6′),126.9 (C-1′),116.3 (C-3′,5′)。以上数据与文献[13] 报道基本一致,故鉴定为对羟基苯乙酸。
化合物9: 淡黄色无定形粉末(甲醇),分子式C28H36O13,ESI-MSm/z: 603.4 [M +Na]+,。1H-NMR (300 MHz,CD3OD)δ: 6.75 (2H,s,H-2,6),6.70(2H,s,H-2′,6′),4.67 (1H,d,J=3.6 Hz,H-7),4.80 (1H,d,J=4.1 Hz,H-7′),4.18(2H,m,H-9′),3.88 (2H,dd,J=9.4 Hz,H-9),3.35 (2H,m,H-8′),2.66 (2H,m,H-8);13C-NMR (75 MHz,CD3OD)δ: 140.4 (C-1),105.2 (C-2.6),154.3 (C-3,5),133.8(C-4),89.8 (C-7),56.4 (C-8),71.7 (C-9),131.4 (C-1′),104.9 (C-2′,6′),149.3 (C-3′,5′),135.7 (C-4′),83.3 (C-7′),51.5 (C-8′),70.5 (C-9′),105.4 (C-1″),75.7 (C-2″),77.8(C-3″),71.3 (C-4″),78.3 (C-5″),62.5 (C-6″),57.1 (3,5-OCH3),56.8 (3′,5′-OCH3)。以上数据与文献[14] 报道基本一致,故鉴定为(+) -表丁香树脂醇-4-O-β-D-吡喃葡萄糖苷。
化合物10: 淡黄色无定形粉末(甲醇),分子式C28H36O13,ESI-MSm/z: 603.4 [M +Na]+,。1H-NMR (300 MHz,CD3OD)δ: 6.72 (2H,s,H-2,6),6.65(2H,s,H-2′,6′),4.77 (1H,d,J=3.6 Hz,H-7),4.71 (1H,d,J=4.1 Hz,H-7′),4.27(2H,m,H-9′),3.92 (2H,dd,J=9.2,3.1 Hz,H-9),3.13 (2H,brs,H-8,8′);13C-NMR(75 MHz,CD3OD)δ: 139.5 (C-1),104.8 (C-2.6),154.4 (C-3,5),135.5 (C-4),87.2 (C-7),55.7 (C-8),87.6 (C-7′),55.4 (C-8′),72.8 (C-9′),105.3 (C-1″),75.7 (C-2″),77.8(C-3″)。以上数据与文献 [15] 报道基本一致,故鉴定为(+) -丁香脂素-4-O-β-D-吡喃葡萄糖苷。
化合物11: 黄色油状液体(甲醇),分子式C9H10O3,ESI-MSm/z: 167.2 [M +H]+。1H-NMR(300 MHz,CD3OD)δ: 7.09 (2H,d,J=8.6 Hz,H-2,6),6.75 (2H,d,J=8.6 Hz,H-3,5),3.52 (2H,s,H-7),3.65 (3H,s,H-9);13C-NMR (75 MHz,CD3OD)δ: 157.5 (C-4),131.3 (C-2,6),126.3 (C-1),116.2 (C-3,5),174.6 (C-8),52.4 (C-9)。以上数据与文献[16] 报道基本一致,故鉴定为对羟基苯乙酸甲酯。
化合物12: 白色无定形粉末(甲醇),分子式C14H20O9,ESI-MSm/z: 355.1 [M+Na]+。与三氯化铁-铁氰化钾反应呈阳性。1H-NMR (300 MHz,CD3OD)δ: 6.13 (2H,s,H-2,6),3.79 (6H,2×OCH3),4.66 (1H,d,J=7.4 Hz,H-1′);13CNMR (75 MHz,CD3OD)δ: 106.1 (C-1′),75.7(C-2′),78.2 (C-3′),71.2 (C-4′),77.9 (C-5′),62.7 (C-6′),129.5 (C-4),154.7 (C-3,5),155.9 (C-1),56.9 (3,5-OCH3) 以上数据与文献[17] 报道基本一致,故鉴为koaburaside。
化合物13: 白色无定形粉末(甲醇),分子式C19H32O7,ESI-MSm/z: 371.4 [M-H]-。1H-NMR(300 MHz,CD3OD)δ: 1.19 (3H,d,J=6.9 Hz,H-10),1.09 (3H,s,H-11),1.01 (3H,s,H-12),2.05 (3H,d,J=1.63 Hz,H-13),5.81 (1H,s,H-4),4.33 (1H,d,J=7.1 Hz,H-1′);13C-NMR (75 MHz,CD3OD)δ: 102.1 (C-1′),75.1 (C-2′),78.1 (C-3′),71.8 (C-4′),77.9 (C-5′),62.9 (C-6′),202.4 (C-3),125.4(C-4),170.1 (C-5),19.9 (C-10),29.1 (C-11),27.5 (C-12),25.0 (C-13),75.5 (C-9),52.4 (C-6),48.1 (C-2),37.8 (C-8),37.3(C-1),26.8 (C-7)。以上数据与文献[18] 报道基本一致,故鉴定为byzantionoside B。
化合物14: 淡黄色粉末 (甲醇),分子式C21H20O11,ESI-MSm/z: 449.3 [M+H]+。1H-NMR(300 MHz,CD3OD)δ: 7.34 (1H,s,H-2′),7.30 (1H,d,J=8.3 Hz,H-6′),6.93 (1H,d,J=8.3 Hz,H-5′),6.37 (1H,d,J=2.1 Hz,H-6),6.20 (1H,d,J=2.1 Hz,H-8),5.35 (1H,s,H-1″),0.95 (3H,d,J=6.0 Hz,H-6″)。将该化合物进行酸水解与单糖标准品进行TLC 薄层对照,确定六元糖的化学结构是鼠李糖。根据δ:0.95 (3H,d,J=6.0 Hz,H-6″) 的偶合常数确定糖苷键为α 型;13C-NMR (75 MHz,CD3OD)δ:103.5 (C-1″),73.2 (C-4″),72.1 (C-3″),72.0(C-2″),71.9 (C-5″),17.7 (C-6″),179.9 (C-4),159.5 (C-5),99.8 (C-6),166.1 (C-7),94.6 ( C-8),163.3 ( C-9),105.9 ( C-10),122.9 ( C-1′,6′),116.8 ( C-5′),116.5 ( C-2′),149.9 (C-4′),146.1 (C-3′),158.4 (C-2),136.3 (C-3)。以上数据与文献[19] 报道基本一致,故鉴定为槲皮素3-O-α-L-鼠李糖苷。
化合物15: 淡黄色无定形粉末(甲醇),分子式C21H22O12,ESI-MSm/z: 465.3 [M-H]-。1HNMR (300 MHz,CD3OD)δ: 6.97 (1H,d,J=2.0 Hz,H-2′),6.80 (1H,dd,J=8.0,2.0 Hz,H-6′),6.77 (1H,d,J=8.0 Hz,H-5′),5.91(1H,d,J=2.0 Hz,H-6),5.90 (1H,d,J=2.0 Hz,H-8),3.86 (1H,d,J=7.5 Hz,H-1″);13C-NMR (75 MHz,CD3OD)δ: 102.5 (C-1″),74.5 (C-2″),78.0 (C-3″),71.1 (C-4″),77.5(C-5″),62.4 (C-6″),168.9 (C-7),165.3 (C-5),164.0 (C-9),102.5 (C-10),97.3 (C-8),96.3 ( C-6),147.2 ( C-3′),146.2 ( C-4′),128.9 ( C-1′),121.1 ( C-6′),116.2 ( C-5′),115.9 ( C-2′),195.9 ( C-4),83.5 ( C-20),77.1 (C-3)。以上数据与文献[20] 报道基本一致,故鉴定为(2R,3R) - (+) -蚁母树苷。
化合物16: 浅黄色粉末 (甲醇),分子式C21H22O12,ESI-MSm/z: 465.3 [M-H]-。1H-NMR(300 MHz,CD3OD)δ: 7.03 (1H,d,J=2.0 Hz,H-2′),6.85 (1H,dd,J=8.0,2.0 Hz,H-6′),6.83 (1H,d,J=8.0 Hz,H-5′),5.96 (1H,d,J=2.0 Hz,H-6),5.98 (1H,d,J=2.0 Hz,H-8),3.88 (1H,d,J=7.5 Hz,H-1″);13C-NMR(75 MHz,CD3OD)δ: 169.1 (C-7),165.5 (C-5),164.0 (C-9),102.3 (C-10),97.3 (C-8),96.4 ( C-6),128.8 ( C-1′),116.0 ( C-2′),146.9 ( C-3′),146.0 ( C-4′),116.2 ( C-5′),121.1 (C-6′),196.1 (C-4),83.4 (C-2),77.7(C-3); 104.6,75.4,77.9,71.4,77.8,62.7为6 个糖碳信号。以上数据与文献[20] 报道基本一致,故鉴定为(2S,3S) - (-) -蚁母树苷。
化合物17: 白色无定形粉末(甲醇),分子式C28H38O13,ESI-MSm/z: 605.4 [M+Na]+。1H-NMR(300 MHz,CD3OD)δ: 3.77 (3H,s,7-OCH3),3.74 (6H,s,3′,5′-OCH3),3.28 (3H,s,5-OCH3),4.26 (1H,d,J=7.5 Hz,H-1″),6.57(1H,s,H-8),6.43 (2H,s,H-2′,6′);13CNMR (75 MHz,CD3OD)δ: 33.8 (C-1),40.5(C-2),46.6 (C-3),42.8 (C-4),147.4 (C-5),138.8 ( C-6),148.5 ( C-7),107.7 ( C-8),130.1 ( C-9),126.3 ( C-10),134.3 ( C-1′),106.7 (C-2′,6′),148.9 (C-3′,5′),139.3 (C-4′),66.1 (C-2α),62.7 (C-3α),104.7 (C-1″),78.1 (C-3″),77.8 (C-5″),75.1 (C-2″),71.5 ( C-4″),62.7 ( C-6″),60.1 (5-OCH3),56.5 (7-OCH3),56.8 (3′,5′-OCH3)。以上数据与文献[21] 报道基本一致,故鉴定为(+) -南烛木树脂酚-3α-O-β-D-吡喃葡萄糖。
化合物18: 淡黄色粉末 (甲醇),分子式C26H34O11,ESI-MSm/z: 522.4 [M-H]-。1H-NMR(300 MHz,CD3OD)δ: 6.76 (1H,d,J=1.8 Hz,H-2′),6.64 (1H,d,J=7.9 Hz,H-5′),6.62(1H,dd,J=1.8,7.9 Hz,H-6′),6.19 (1H,s,H-5),2.07 (1H,m,H-8),4.13 (1H,d,J=7.7 Hz,H-1″),3.81 (3H,s,6-OCH3),3.78 (3H,s,3′-OCH3);13C-NMR (75 MHz,CD3OD)δ: 138.5 (C-1′),114.3 (C-2′),147.1(C-3′),145.2 ( C-4′),116.3 ( C-5′),123.1(C-6′),47.8 (C-7′),46.2 (C-8′),68.8 (C-9′),104.1 (C-1″),75.3 (C-2″),77.9 (C-3″),71.6 (C-4″),78.0 (C-5″),62.9 (C-6″),56.3(3′-OCH3),56.4 ( 6-OCH3),128.5 ( C-1),112.3 ( C-2),149.0 ( C-3),145.8 ( C-4),117.5 (C-5),134.3 (C-6),33.9 (C-7),39.6(C-8),65.6 (C-9)。以上数据与文献[22] 报道基本一致,故鉴定为(+) -异落叶松脂素-9′-O-β-D-吡喃葡萄糖。
化合物19: 白色粉末 (甲醇),分子式C28H38O13,ESI-MSm/z: 605.4 [M+Na]+。1H-NMR(300 MHz,CD3OD)δ: 3.33 (3H,s,5-OCH3),3.83 (3H,s,7-OCH3),3.75 (6H,s,3′,5′-OCH3),4.30 (1H,d,J=7.8 Hz,H-1″),6.57( 1H,s,H-8 ),6.43 ( 2H,s,H-2′,6′);13C-NMR (75 MHz,CD3OD)δ: 33.6 (C-1),41.1 (C-2),46.8 (C-3),42.7 (C-4),147.6(C-5),139.0 (C-6),148.7 (C-7),107.8 (C-8),129.3 (C-9),126.0 (C-10),134.5 (C-1′),106.8 (C-2′,6′),148.7 (C-3′,5′),139.0(C-4′),68.4 (C-2α),62.8 (C-3α),104.8 (C-1″),75.1 (C-3″),78.2 (C-5″),75.1 (C-2″),78.2 (C-3″),71.6 (C-4″),77.9 (C-5″),62.8(C-6″),60.1 (5-OCH3),56.5 (7-OCH3),56.8(3′,5′-OCH3)。以上数据与文献[23] 报道基本一致,故鉴定为(-) -南烛木树脂酚-3α-O-β-D-吡喃葡萄糖苷。
化合物20: 淡黄色无定形粉末(甲醇),分子式C21H24O10,ESI-MSm/z: 577.9 [M+H]+。与三氯化铁-铁氰化钾反应呈蓝色。1H-NMR (300 MHz,CD3OD)δ: 6.16 (1H,d,J=2.1 Hz,H-3′),6.14 (1H,d,J=2.1 Hz,H-5′),7.04 (2H,dd,J=8.8,1.8 Hz,H-2,6),6.66 (2H,dd,J=8.8,1.8 Hz,H-3,5),4.99 (1H,d,J=8.1 Hz,H-1″),3.42 (2H,t,J=7.5 Hz,H-α),2.81 (2H,t,J=7.5 Hz,H-β);13C-NMR (75 MHz,CD3OD)δ: 102.0 (C-1″),74.7 (C-2″),78.4 (C-3″),71.1 (C-4″),78.5 (C-5″),62.4(C-6″),206.4 (C =O),106.6 (C-1′),166.3(C-2′),98.4 (C-3′),167.6 (C-4′),95.5 (C-5′),162.3 (C-6′),133.9 (C-1),130.4 (C-2,6),116.1 (C-3,5),156.3 (C-4),46.9 (Cα),30.8 (C-β)。以上数据与文献[24] 报道基本一致,故鉴定为根皮苷。
化合物21: 白色针状结晶(石油醚-丙酮),分子式C29H50O,沸点130 ~132 ℃,Liebermann-Burchard 反应呈阳性,使用3 种不同的展开剂与β-谷甾醇对照品对照在同一薄层板展开,具有相同的薄层行为,与β-谷甾醇对照品混合熔点保持不变,故鉴定为β-谷甾醇。
4 活性实验
4.1 总抗氧化能力(T-AOC) 将化合物1 ~20制成浓度为3.7 mmol/L 的溶液,因试验体系为3.7 mL,其中样品溶液为0.1 mL,即样品终浓度为0.1 mmol/L。按照总抗氧化能力(T-AOC) 试剂盒说明书进行样品处理,样品分为测定管和对照管。测定管加入1 mL 试剂一、0.1 mL 的样品溶液、2 mL 试剂二、0.5 mL 试剂三,对照管加入1 mL试剂一、2 mL 试剂二、0.5 mL 试剂三; 涡旋混匀后,37 ℃水浴30 min 后,再分别在测定管与对照管中加0.1 mL 试剂四和0.1 mL 样品溶液; 涡旋混匀后,室温放置10 min,在520 nm 波长处测量吸光度(双蒸水调零)。按下式(1) 计算总抗氧化能力,结果见表1。化合物2、9 ~10、14 ~20具有较强的总抗氧化能力。根据结构类型分析发现,天然酚酸类总抗氧化能力最高,黄酮类和木脂素类的总抗氧化能力次之,其他类型的化合物总抗氧化能力最弱。
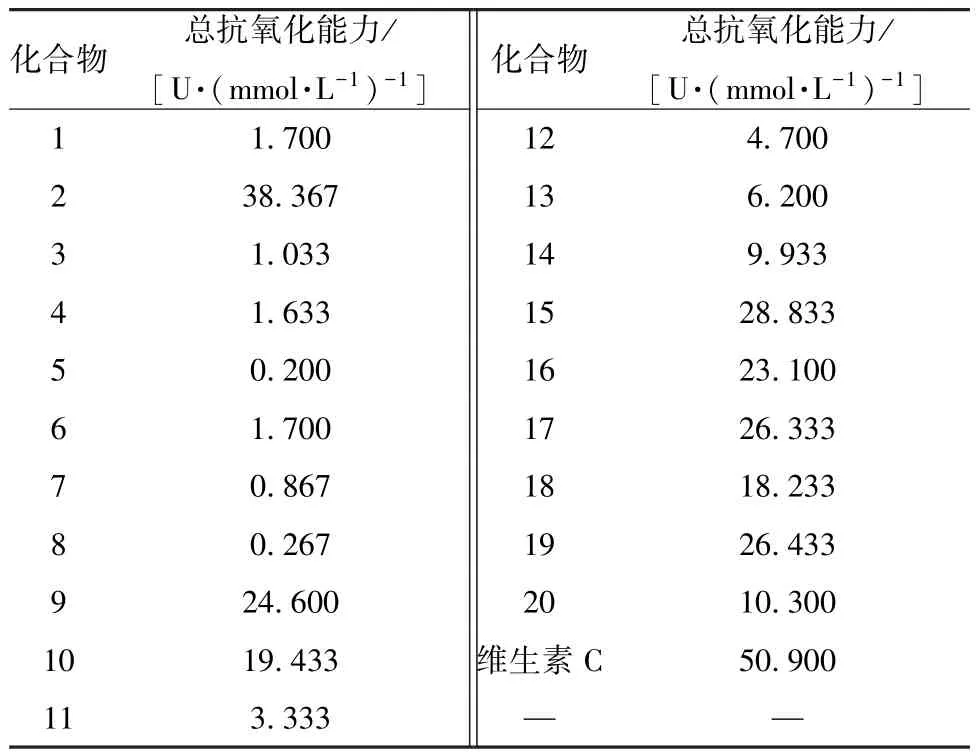
表1 化合物1~20 的总抗氧化能力测定结果Tab.1 Detemination results of total antioxidant capacities of compounds 1-20
A为吸光度,T为反应时间30 min,N为样品测试前稀释倍数。
4.2 神经细胞保护活性 经MTT 法检测发现,化合物2、15、17 和依达拉奉分别在10、25、50、100、200 μmol/L 对SH-SY5Y 细胞存活率无影响,化合物9 ~10 对SH-SY5Y 细胞的增殖具有促进作用,无细胞毒性,见图1。

图1 部分化合物和依达拉奉对SH-SY5Y 细胞生长的影响Fig.1 Effects of some compounds and edaravone on the growth of SH-SY5Y cells
经MTT 法检测发现,不同浓度H2O2(100、200、300、400、500、600 μmol/L) 处理SH-SY5Y细胞6、24 h 后,细胞存活率随浓度增大和时间延长而减小。造模6 h 时SH-SY5Y 的存活率分别为(92.34±0.19)%、(91.04±0.20)%、(88.07±0.23)%、(77.45±0.34)%、(76.04±0.35)%、(69.62±0.41)%; 造模2 h 时SH-SY5Y 的存活率分别为 (99.62±0.11)%、(87.20±0.24)%、(83.25±0.28)%、(76.11±0.35)%、(54.62±0.56)%、(42.87±0.68)%,比对发现400 μmol/L的H2O2处理细胞6 h 为最优建模条件,见图2。

图2 不同时间和浓度的H2O2 对SH-SY5Y 细胞的影响Fig.2 Effect of different time and concentration of H2O2 on SH-SY5Y cells
经MTT 法检测发现,模型组细胞存活率为(72.34±0.45)%,阳性对照组(依达拉奉) 在10、25、50、100、200 μmol/L 时存活率分别为(80.93±0.36)%、(83.40 ± 0.34)%、(84.31 ± 0.33)%、(86.70±0.30)%、(90.29±0.36)%,细胞存活率随着浓度的增大而增加,见图3。

图3 不同浓度的依达拉奉对H2O2 诱导的SH-SY5Y 细胞损伤的影响Fig.3 Effect of edaravone at different concentration on H2O2-induced SH-SY5Y cell injury
经MTT 法检测发现,化合物2 和17 对H2O2诱导的SH-SY5Y 细胞损伤保护作用随药物浓度的增大而增大,但与模型组比较无显著差异; 化合物9 和15 的最佳保护浓度分别为50、100 μmol/L,其保护作用在大于最佳浓度时作用下降; 化合物10 保护作用与药物浓度呈正比,且同等浓度下化合物10 保护作用更强,见图4。

图4 部分化合物对H2O2 诱导的SH-SY5Y 细胞损伤的影响Fig.4 Effects of some compounds on H2O2-induced SH-SY5Y cell injury
综上所述,本实验从碧绿米仔兰中分离得到化合物1~20,并对其进行总抗氧化能力(T-AOC)测定,发现天然酚酸类总抗氧化能力最高,黄酮类和木脂素类的总抗氧化能力次之。对化合物2、9~10、15、17 进行神经细胞保护活性研究时,发现化合物2 和17 对H2O2诱导的SH-SY5Y 细胞损伤保护作用与药物浓度呈正相关,但与模型组比较无显著性差异; 化合物9 和15 对H2O2诱导的神经细胞损伤后的保护作用的最优保护浓度分别为50、100 μmol/L; 化合物10 保护作用与药物浓度呈正比,且同等浓度下化合物10 保护作用更强。

