壮药双路通脑方对脑缺血再灌注损伤大鼠神经元凋亡的影响
翟 阳,莫雪妮,滕红丽,胡跃强,郑光珊,马 威,杨 鹏,梅小平,邹 敏,王凯华*
(1.广西国际壮医医院脑病科,广西 南宁 530200; 2.广西中医药大学,广西 南宁 530200; 3.广西中医药大学第一附属医院脑病科,广西 南宁 530200; 4.广西国际壮医医院科技部,广西 南宁 530200;5.广西国际壮医医院内分泌代谢病科,广西 南宁 530200; 6.广西国际壮医医院儿科,广西 南宁 530200)
缺血性脑卒中的主要特征是大脑供血不足,溶栓和取栓是其首选治疗方法[1]。但血流恢复(再灌注) 会加重损伤,导致脑缺血再灌注损伤[2]。氧化应激和炎症反应在缺血性脑卒中的病理过程中起关键作用,可直接或间接导致神经元死亡[3-4]。Toll 样受体4 (TLR4) /核因子-κB (NF-κB) 是脑缺血再灌注损伤后的炎症级联反应信号通路。TLR4 在脑缺血再灌注损伤后上调,激活NF-κB,诱导促炎因子释放,加重组织损伤[5-6]。核因子E2相关因子2 (Nrf2) /血红素加氧酶-1 (HO-1) 通路是抗氧化应激和细胞凋亡的关键保护通路。在脑缺血再灌注损伤后,Nrf2、HO-1 表达降低会增加梗死面积,加重脑损伤[7-8]。因此,靶向TLR4/NF-κB 和Nrf2/HO-1 通路是缺血性脑卒中的重要治疗靶点。
壮药双路通脑方是在壮医经验方壮通饮的基础上由广西国际壮医医院自主研发的院内复方制剂,由扶芳藤、黄花倒水莲、茯苓、法半夏、桂枝尖等广西特色壮药配伍而成,对缺血性脑卒中有疗效[9],但其作用机制尚不明确。方中多种中药及其活性成分有抗炎和抗氧化作用,如扶芳藤[10-11]、黄花倒水莲(总皂苷[12]、多糖[13])、茯苓(茯苓多糖[14]、茯苓酸[15])。本研究通过大脑中动脉闭塞/再灌注(MCAO/R) 建立脑缺血再灌注损伤大鼠模型,初步探讨壮药双路通脑方对缺血性脑卒中的潜在保护机制。
1 材料
1.1 动物 SPF 级健康成年雄性SD 大鼠108 只,体质量250~280 g,6 ~7 周龄,购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号SCXK (湘) 2019-0004,经广西中医药大学伦理委员会批准(伦理号DW20200511-078)。大鼠饲养在12 h/12 h 光照/黑暗循环、温度(23±1)℃、相对湿度45% ~55%的空调房间内,常规饲料喂养,自由饮水。
1.2 试剂与药物 壮药双路通脑方由扶芳藤20 g、桂枝尖15 g、苍术15 g、法半夏20 g、茯苓15 g、南山楂20 g、田七15 g、陈皮15 g、黄花倒水莲15 g、肉苁蓉15 g、火麻仁15 g、生姜15 g、炙甘草5 g 组成,以上药材均为精制饮片,购于广西国际壮医医院,经广西中医药大学莫雪妮教授鉴定为正品。按常规方法煎煮、过滤,并浓缩至每1 mL含原药材2 g,4 ℃冰箱保存备用。2,3,5-氯化三苯基四氮唑(TTC)、苏木精-伊红(HE) 染色试剂盒(批号T8170、G1120,北京索莱宝科技有限公司); TUNEL 细胞凋亡检测试剂盒 (批号11684817910,瑞士Roche 公司); 超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、丙二醛(MDA) 检测试剂盒(批号A001-3-2、A006-2-1、A003-1-2,南京建成生物工程研究所); 白细胞介素6 (IL-6)、IL-1β、肿瘤坏死因子-α (TNF-α) ELISA 试剂盒(批号ml102828、ml003057、ml002859,上海酶联生物科技有限公司); 兔源一抗cleaved-caspase-3、caspase-3 (批号9661、9662,美国Cell Signaling Technology 公司); TLR4、NF-κB p65、p-NF-κB p65、Bax、Bcl-2、β-actin(批号PA5-23124、PA5-16545、PA5-37718、PA5-78857、PA5-27094、PA1-183,美国Thermo Fisher Scientific 公司); Nrf2、HO-1、Lamin B1 ( 批号 ab137550、ab68477、ab16048,英国Abcam 公司)。
1.3 仪器 iMark680 型多功能酶标仪(美国Bio-Rad公司); BX61 电动显微镜(日本Olympus 公司)。
2 方法
2.1 分组与造模 采用随机数字表法将大鼠分为假手术组,模型组,壮药双路通脑方低、中、高剂量组(9.0、18.0、36.0 g/kg),依达拉奉组(3.0 mg/kg),每组18 只,参考文献[16] 报道方法采用线栓法构建MCAO/R 模型。称定各组大鼠体质量,用2%戊巴比妥钠(0.3 mL/100 g) 腹腔注射麻醉,仰卧固定在大鼠板上,脱去颈部毛发,在颈部中线处切开1 个2 cm 的切口,仔细分离脂肪和结缔组织以暴露左侧颈总动脉(CCA),进一步分离颈内动脉 (ICA) 和颈外动脉 (ECA),结扎ECA 和CCA 的近端,同时在CCA 的远端穿上细线,用镊子提起CCA,在距三叉神经交点约0.5 cm 的CCA 处切开1 个小切口,将预涂有硅胶(直径0.26 mm) 的线栓从分叉处插入ICA (18 ~20 mm) 中2 h。2 h 后,小心拉出线栓,恢复再灌注。假手术组大鼠除不行闭塞/再灌注外,其余操作同模型组。整个实验过程中用加热垫维持每只大鼠的直肠温度在(37±0.5)℃。
2.2 给药 在造模前30 min 和再灌注清醒后1 h,壮药双路通脑方低、中、高剂量组分别灌胃给予9.0、18.0、36.0 g/kg 壮药双路通脑方(临床等效剂量的0.5、1、2 倍),依达拉奉组腹腔注射3.0 mg/kg 依达拉奉[17],假手术组和模型组灌胃给予等体积生理盐水。之后除依达拉奉组每天给药1 次外,其余组均于每天上午、下午各灌胃给药1 次,连续6 d。
2.3 神经功能缺损评分 末次给药干预后2 h,观察各组大鼠的神经功能缺损变化,并采用Zeal Longa 5 级评分法进行评分[17]。评分标准为1 级(0 分),无神经缺损体征,动物行为正常; 2 级(1 分),不能充分屈曲对侧前爪; 3 级(2 分),向对侧转圈; 4 级(3 分),向对侧倾倒; 5 级(4分),不能自发行走,意识丧失。分数越高表明神经功能缺损越严重。
2.4 TTC 染色检测脑梗死面积 每组随机选取6只大鼠,麻醉后断头取脑,用生理盐水清洗后,放入脑模具中,以视交叉为起点,冠状切2 mm 的脑片。将脑片放入1%TTC 溶液(现配现用) 中,于37 ℃避光孵育15~20 min,期间翻动1 次脑片使染色均匀,将脑片用4%多聚甲醛固定,拍照。红色为正常脑组织,白色为梗死部分。通过Image J 软件检测梗死面积,计算梗死率。
2.5 HE 染色检测脑组织缺血半暗带海马CA1 区神经元病理损伤 每组随机选取6 只大鼠,麻醉后取出脑组织,冠状切分为两部分,一部分取缺血侧制备10%的组织匀浆液; 另一部分在4%多聚甲醛中固定48 h 后进行梯度脱水、石蜡包埋,连续切4 μm冠状切片,进行HE 染色,在光学显微镜下观察缺血半暗带海马CA1 区神经元病理学损伤。
2.6 TUNEL 染色检测脑组织缺血半暗带海马CA1区神经元凋亡 将石蜡组织切片在二甲苯中脱蜡10~20 min 后,在梯度乙醇(100%、100%、95%、80%、70%) 中浸泡5 min,用0.02 μg/μL 蛋白酶K 溶液(pH 7.6) 渗透15 ~20 min,将切片与3%H2O2孵育10 min,再与TUNEL 反应混合液37 ℃避光孵育1 h,加DAB 溶液室温孵育15 min,苏木精复染30 s,在光学显微镜下观察结果并拍照。每个样品制备3 张切片,每张切片随机选取3 个视野,通过Image-Pro Plus 6.0 软件对切片中具有深褐色细胞核的细胞(TUNEL 阳性细胞) 进行计数,计算细胞凋亡率。
2.7 脑组织中氧化应激和炎症因子水平检测 取缺血侧脑组织约100 mg,加入9 倍量生理盐水研磨,4 ℃、2 300×g离心15 min,收集上清液。严格按照相关试剂盒说明书操作,硫代巴比妥酸(TBA) 法检测MDA 水平,WST-1 法检测SOD 活性,微板法检测GSH 水平,ELISA 法检测IL-6、IL-1β、TNF-α 水平。
2.8 Western blot 法检测脑组织各蛋白表达 各组剩余6 只大鼠,麻醉后取脑并分离缺血半暗带脑组织,使用核和细胞质提取试剂盒提取核和细胞质蛋白质。BCA 法测定蛋白质浓度后,10% ~15%SDSPAGE 凝胶电泳分离等量(20 μg) 蛋白质,转移到聚偏二氟乙烯(PVDF) 膜上。将PVDF 膜用5%脱脂牛奶封闭1 h,与一抗Bax (1 ∶1 000)、Bcl-2 (1 ∶ 1 000)、caspase-3 (1 ∶ 1 000)、cleaved-caspase-3 (1 ∶500)、TLR4 (1 ∶1 000)、p-NF-κB p65 (1 ∶ 1 000)、NF-κB p65 (1 ∶1 000)、Nrf2 (1 ∶1 000)、HO-1 (1 ∶1 000)、Lamin B1 (1 ∶1 000)、β-actin (1 ∶1 000) 在4 ℃下孵育过夜,次日将PVDF 膜与二抗(1 ∶5 000)在室温下孵育2 h,用增强型化学发光(ECL) 试剂显影后捕获蛋白质电泳条带,并通过Image J 软件进行条带灰度值分析。以目的条带灰度值与内参条带灰度值的比值作为目的蛋白的相对表达量。βactin 和Lamin B1 分别为细胞质和核蛋白的内参。
2.9 统计学分析 通过GraphPad Prism 8.0 软件进行处理,数据以(±s) 表示,组间比较采用单因素方差分析和SNK-q检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 壮药双路通脑方对大鼠神经功能缺损评分的影响 与假手术组比较,模型组大鼠神经功能缺损评分升高(P<0.05),表明造模成功; 与模型组比较,壮药双路通脑方中、高剂量组和依达拉奉组大鼠神经功能缺损评分降低(P<0.05),并呈剂量依赖性,见表1。
表1 各组大鼠神经功能缺损评分比较(±s,n=18)Tab.1 Comparison of rat neurological deficit scores in each group (±s,n=18)

表1 各组大鼠神经功能缺损评分比较(±s,n=18)Tab.1 Comparison of rat neurological deficit scores in each group (±s,n=18)
注: 与假手术组比较,*P<0.05; 与模型组比较,#P<0.05。
组别神经功能缺损评分/分假手术组0模型组2.80±0.31*壮药双路通脑方低剂量组2.65±0.27壮药双路通脑方中剂量组1.91±0.24#壮药双路通脑方高剂量组1.52±0.20#依达拉奉组1.47±0.19#
3.2 壮药双路通脑方对大鼠脑梗死面积的影响 与假手术组比较,模型组大鼠脑梗死率升高 (P<0.05); 与模型组比较,壮药双路通脑方中、高剂量组和依达拉奉组大鼠脑梗死率降低(P<0.05),并呈剂量依赖性,见图1、表2。

图1 各组大鼠脑梗死情况(TTC 染色)Fig.1 Sizes of rat cerebral infarction in each group (TTC staining)
表2 各组大鼠脑梗死率比较(±s,n=6)Tab.2 Comparison of rat cerebral infarction rate in each group (±s,n=6)

表2 各组大鼠脑梗死率比较(±s,n=6)Tab.2 Comparison of rat cerebral infarction rate in each group (±s,n=6)
注: 与假手术组比较,*P<0.05; 与模型组比较,#P<0.05。
组别脑梗死率/%假手术组0模型组39.25±4.56*壮药双路通脑方低剂量组35.48±4.37壮药双路通脑方中剂量组24.60±2.85#壮药双路通脑方高剂量组13.17±2.16#依达拉奉组11.89±2.03#
3.3 壮药双路通脑方对大鼠脑组织缺血半暗带海马CA1 区神经元病理损伤的影响 假手术组大鼠脑组织海马CA1 区神经元形态正常,海马神经元胞体较大且圆形,核仁明显,细胞呈多层排列,整齐致密; 模型组大鼠大脑缺血半暗带海马CA1 区神经元呈三角形或不规则形,数量减少,核仁不明显,排列混乱; 与模型组比较,壮药双路通脑方中、高剂量组和依达拉奉组大鼠病理损伤有不同程度的改善,大部分神经细胞恢复正常,神经元数量增加,排列较整齐; 且壮药双路通脑方高剂量对神经元病理损伤的改善作用优于壮药双路通脑方中、低剂量,见图2。

图2 各组大鼠脑组织海马CA1 区神经元病理损伤情况(HE 染色,×400)Fig.2 Pathological damage of neurons in rat hippocampus CA1 area of each group (HE staining,×400)
3.4 壮药双路通脑方对大鼠脑组织缺血半暗带海马CA1 区神经元凋亡的影响 与假手术组比较,模型组大鼠海马CA1 区神经元凋亡率升高(P<0.05); 与模型组比较,壮药双路通脑方中、高剂量组和依达拉奉组大鼠海马CA1 区神经元凋亡率降低(P<0.05),并呈剂量依赖性,见图3、表3。

图3 各组大鼠脑组织海马CA1 区神经元凋亡情况(TUNEL 染色,×200)Fig.3 Neuronal apoptosis in rat hippocampal CA1 region of each group (TUNEL staining,×200)
表3 各组大鼠脑组织海马CA1 区神经元凋亡率比较(±s,n=6)Tab.3 Comparison of neuronal apoptosis rate in rat hippocampus CA1 area of each group(±s,n=6)

表3 各组大鼠脑组织海马CA1 区神经元凋亡率比较(±s,n=6)Tab.3 Comparison of neuronal apoptosis rate in rat hippocampus CA1 area of each group(±s,n=6)
注: 与假手术组比较,*P<0.05; 与模型组比较,#P<0.05。
组别凋亡率/%假手术组2.15±0.34模型组26.33±2.87*壮药双路通脑方低剂量组23.94±2.65壮药双路通脑方中剂量组17.21±2.32#壮药双路通脑方高剂量组10.53±1.64#依达拉奉组9.75±1.38#
3.5 壮药双路通脑方对大鼠脑组织IL-6、IL-1β、TNF-α 水平的影响 与假手术组比较,模型组大鼠脑组织IL-6、IL-1β、TNF-α 水平升高(P<0.05);与模型组比较,壮药双路通脑方中、高剂量组和依达拉奉组大鼠脑组织IL-6、IL-1β、TNF-α 水平降低(P<0.05),并呈剂量依赖性,见表4。
表4 各组大鼠脑组织IL-6、IL-1β、TNF-α 水平比较(pg/mg,±s,n=6)Tab.4 Comparison of IL-6,IL-1β and TNF-α levels in rat brain tissues of each group (pg/mg,±s,n=6)
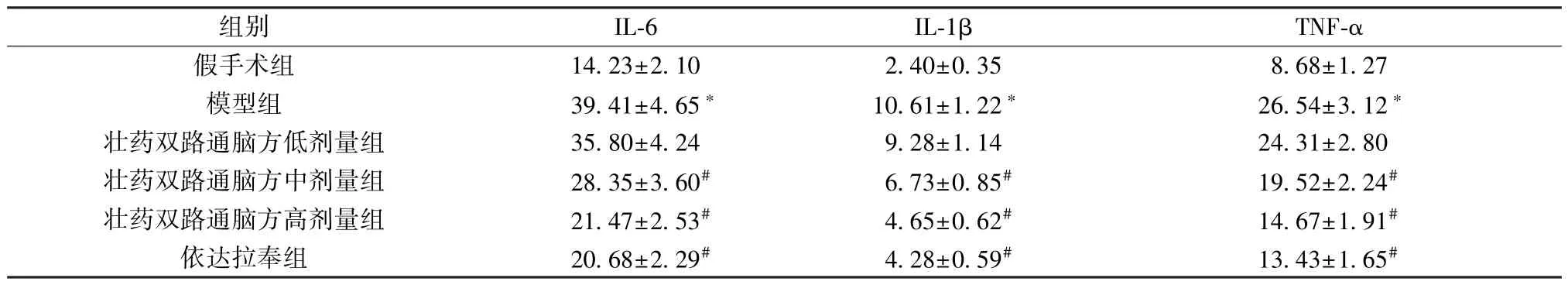
表4 各组大鼠脑组织IL-6、IL-1β、TNF-α 水平比较(pg/mg,±s,n=6)Tab.4 Comparison of IL-6,IL-1β and TNF-α levels in rat brain tissues of each group (pg/mg,±s,n=6)
注: 与假手术组比较,*P<0.05; 与模型组比较,#P<0.05。
组别IL-6IL-1βTNF-α假手术组14.23±2.102.40±0.358.68±1.27模型组39.41±4.65*10.61±1.22*26.54±3.12*壮药双路通脑方低剂量组35.80±4.249.28±1.1424.31±2.80壮药双路通脑方中剂量组28.35±3.60#6.73±0.85#19.52±2.24#壮药双路通脑方高剂量组21.47±2.53#4.65±0.62#14.67±1.91#依达拉奉组20.68±2.29#4.28±0.59#13.43±1.65#
3.6 壮药双路通脑方对大鼠脑组织MDA、GSH 水平和SOD 活性的影响 与假手术组比较,模型组大鼠脑组织MDA 水平升高(P<0.05),GSH 水平和SOD 活性降低(P<0.05); 与模型组比较,壮药双路通脑方中、高剂量组和依达拉奉组大鼠脑组织MDA 水平降低(P<0.05),GSH 水平和SOD 活性升高(P<0.05),并呈剂量依赖性,见表5。
表5 各组大鼠脑组织MDA、GSH 水平和SOD 活性比较(±s,n=6)Tab.5 Comparison of MDA and GSH levels,and SOD activity in rat brain tissues of each group (±s,n=6)
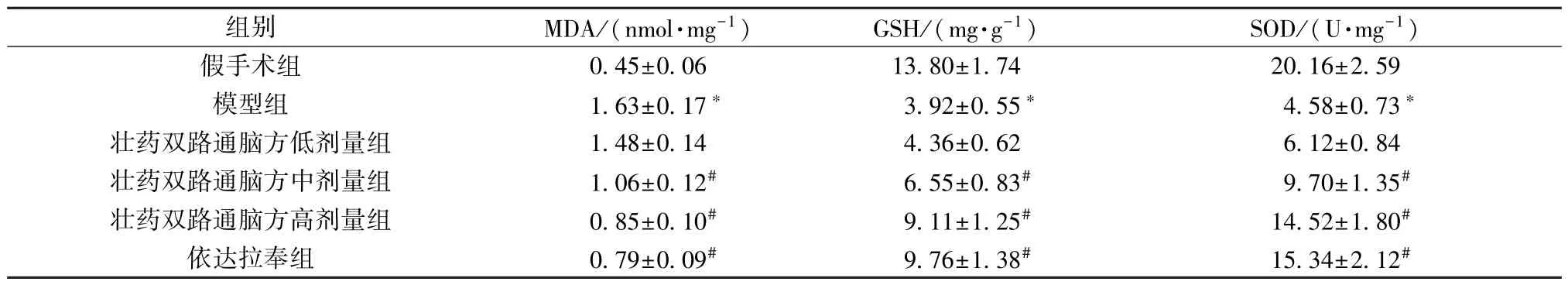
表5 各组大鼠脑组织MDA、GSH 水平和SOD 活性比较(±s,n=6)Tab.5 Comparison of MDA and GSH levels,and SOD activity in rat brain tissues of each group (±s,n=6)
注: 与假手术组比较,*P<0.05; 与模型组比较,#P<0.05。
组别MDA/(nmol·mg-1)GSH/(mg·g-1)SOD/(U·mg-1)假手术组0.45±0.0613.80±1.7420.16±2.59模型组1.63±0.17*3.92±0.55*4.58±0.73*壮药双路通脑方低剂量组1.48±0.144.36±0.626.12±0.84壮药双路通脑方中剂量组1.06±0.12#6.55±0.83#9.70±1.35#壮药双路通脑方高剂量组0.85±0.10#9.11±1.25#14.52±1.80#依达拉奉组0.79±0.09#9.76±1.38#15.34±2.12#
3.7 壮药双路通脑方对大鼠缺血半暗带脑组织Bax、Bcl-2、caspase-3、cleaved-caspase-3 蛋白表达的影响 与假手术组比较,模型组大鼠脑组织Bax蛋白表达和cleaved-caspase-3/caspase-3 比值升高(P<0.05),Bcl-2 蛋白表达降低(P<0.05); 与模型组比较,壮药双路通脑方中、高剂量组和依达拉奉组大鼠脑组织Bax 蛋白表达和cleaved-caspase-3/caspase-3 比值降低(P<0.05),Bcl-2 蛋白表达升高(P<0.05),并呈剂量依赖性,见图4、表6。

图4 各组大鼠缺血半暗带脑组织Bax、Bcl-2、caspase-3、cleaved-caspase-3 蛋白条带图Fig.4 Protein bands of Bax,Bcl-2,caspase-3 and cleaved-caspase-3 in rat ischemic penumbra of each group
表6 各组大鼠缺血半暗带脑组织Bax、Bcl-2、caspase-3、cleaved-caspase-3 蛋白表达比较(±s,n=6)Tab.6 Comparison of protein expressions of Bax,Bcl-2,caspase-3 and cleaved-caspase-3 in rat ischemic penumbra of each group (±s,n=6)
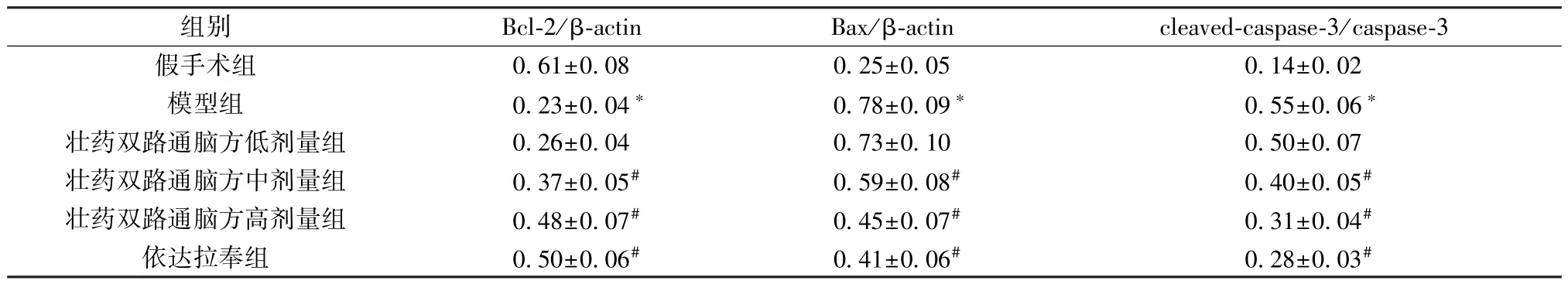
表6 各组大鼠缺血半暗带脑组织Bax、Bcl-2、caspase-3、cleaved-caspase-3 蛋白表达比较(±s,n=6)Tab.6 Comparison of protein expressions of Bax,Bcl-2,caspase-3 and cleaved-caspase-3 in rat ischemic penumbra of each group (±s,n=6)
注: 与假手术组比较,*P<0.05; 与模型组比较,#P<0.05。
组别Bcl-2/β-actinBax/β-actincleaved-caspase-3/caspase-3假手术组0.61±0.080.25±0.050.14±0.02模型组0.23±0.04*0.78±0.09*0.55±0.06*壮药双路通脑方低剂量组0.26±0.040.73±0.100.50±0.07壮药双路通脑方中剂量组0.37±0.05#0.59±0.08#0.40±0.05#壮药双路通脑方高剂量组0.48±0.07#0.45±0.07#0.31±0.04#依达拉奉组0.50±0.06#0.41±0.06#0.28±0.03#
3.8 壮药双路通脑方对大鼠缺血半暗带脑组织TLR4、NF-κB p65、Nrf2、HO-1 蛋白表达的影响与假手术组比较,模型组大鼠脑组织TLR4 蛋白表达和p-NF-κB p65/NF-κB p65 比值升高 (P<0.05),Nrf2、HO-1 蛋白表达降低(P<0.05); 与模型组比较,壮药双路通脑方中、高剂量组和依达拉奉组大鼠脑组织TLR4 蛋白表达和p-NF-κB p65/NF-κB p65 比值降低(P<0.05),Nrf2、HO-1 蛋白表达升高(P<0.05),并呈剂量依赖性,见图5、表7。

图5 各组大鼠缺血半暗带脑组织TLR4、NF-κB p65、Nrf2、HO-1 蛋白条带图Fig.5 Protein bands of TLR4,NF-κB p65,Nrf2 and HO-1 in rat ischemic penumbra of each group
表7 各组大鼠缺血半暗带脑组织TLR4、NF-κB p65、Nrf2、HO-1 蛋白表达比较(±s,n=6)Tab.7 Comparison of protein expressions of LR4,NF-κB p65,Nrf2 and HO-1 in rat ischemic penumbra of each group(±s,n=6)

表7 各组大鼠缺血半暗带脑组织TLR4、NF-κB p65、Nrf2、HO-1 蛋白表达比较(±s,n=6)Tab.7 Comparison of protein expressions of LR4,NF-κB p65,Nrf2 and HO-1 in rat ischemic penumbra of each group(±s,n=6)
注: 与假手术组比较,*P<0.05; 与模型组比较,#P<0.05。
组别TLR4/β-actinp-NF-κB p65/NF-κB p65Nrf2/Lamin B1HO-1/β-actin假手术组0.40±0.030.21±0.040.53±0.070.61±0.08模型组0.92±0.10*0.64±0.08*0.12±0.02*0.20±0.04*壮药双路通脑方低剂量组0.87±0.090.60±0.080.16±0.030.24±0.04壮药双路通脑方中剂量组0.72±0.08#0.48±0.07#0.25±0.04#0.35±0.05#壮药双路通脑方高剂量组0.58±0.07#0.35±0.06#0.37±0.04#0.48±0.06#依达拉奉组0.55±0.07#0.33±0.05#0.39±0.05#0.50±0.07#
4 讨论
壮医认为龙路、火路闭塞不通是缺血性脑卒中发病的根本[18-19]。疏通龙路和火路为壮医治疗缺血性脑卒中的治本之法[20]。壮药双路通脑方具有疏通两路、调治巧坞(大脑) 的功效,已被证实在防治缺血性中风方面有疗效,可改善患者神经功能缺损程度,提高其活动能力和生活质量[9],对缺血性脑卒中的保护作用可能与抑制氧化应激和炎症反应有关。
本研究发现,脑缺血再灌注损伤大鼠脑组织神经元凋亡水平升高,同时炎症因子IL-1β、TNF-α、IL-6 水平升高,SOD 活性和GSH 水平降低,MDA水平升高,表明大鼠脑组织出现氧化应激和神经炎症。经壮药双路通脑方干预后,大鼠的神经功能明显改善,梗死面积和脑损伤明显减轻,神经元凋亡减少; 且壮药双路通脑方可增加大鼠脑组织中SOD 活性和GSH 水平,降低MDA、IL-1β、TNFα、IL-6 水平,表明壮药双路通脑方可通过抑制氧化应激和炎症反应来减轻脑缺血再灌注损伤。
TLR4 在缺血发生期间受到刺激后表达增加,并进一步激活NF-κB 信号通路,诱导炎症介质(如TNF-α、IL-1β、IL-6) 的释放,加重组织损伤[21]。本研究结果显示,脑缺血再灌注损伤诱导TLR4 和NF-κB p65 磷酸化水平升高; 而壮药双路通脑方可降低TLR4 表达、抑制NF-κB p65 的磷酸化,提示壮药双路通脑方对缺血性脑卒中的抗炎作用可能与抑制TLR4/NF-κB 信号通路有关。
Nrf2 信号通路可通过抗氧化应激、抗凋亡、抗炎等途径缓解脑缺血再灌注损伤,为缺血性脑卒中的关键靶点[22]。在正常情况下,Nrf2 以非活性形式存在于细胞质中,维持低水平的Nrf2 调节基因表达。脑缺血再灌注损伤后,Nrf2 从细胞质转移到细胞核,启动下游靶基因HO-1 的转录,并诱导多种内源性抗氧化酶的产生。研究发现,在MCAO/R 大鼠模型中,当Nrf2 核蛋白受到抑制时,Bax 表达升高,Bcl-2 表达降低,细胞凋亡增加[23];且抑制Nrf2/HO-1 通路也会加重氧化应激[24]。本研究发现,壮药双路通脑方以剂量依赖性方式增加核Nrf2 和HO-1 的蛋白表达,并升高Bcl-2 表达,降低cleaved-caspase-3、Bax 表达,提示壮药双路通脑方的神经保护机制可能与激活Nrf2/HO-1 信号通路有关。
综上所述,壮药双路通脑方可抑制脑缺血再灌注损伤大鼠的神经炎症和氧化应激,抑制神经元凋亡,减轻脑损伤,其机制可能与抑制TLR4/NF-κB通路和激活Nrf2/HO-1 通路相关。本研究为壮药双路通脑方作为抗缺血性脑卒中药物提供基础证据,将有助于指导其临床应用。由于壮药双路通脑方的药物组成复杂,仍需进一步的实验验证其抗缺血性脑卒中的机制。

