雪上一枝蒿生物碱可溶性微针制备
陈 瑶,邓铋莉,万 静,2,董娜娜,陈晓兰*,张永萍
(1.贵州中医药大学,贵州 贵阳 550025; 2.毕节医学高等专科学校,贵州 毕节 553302)
雪上一枝蒿为毛茛科乌头属植物短柄乌头AconitumbrachypodumDiels、铁棒锤Aconitum pendulumBusch、宣威乌头AconitumsubrosullatumH.-M.的干燥块根,功效祛风除湿、消炎镇痛,用于治疗风寒湿痹所致筋骨、关节疼痛,疗效显著[1],但其毒性较大。经皮给药为毒性中药常用给药途径,其操作方便,可直接作用于治疗部位,降低进入循环系统的药物浓度,并能随时停药,从而降低毒副作用发生,同时避免了肝脏首过效应,提高了药物生物利用度[2-4],故将雪上一枝蒿制成透皮吸收制剂是较理想的方案。
微针是一种具有微米级尺寸针尖阵列的经皮给药制剂[5],分为固体微针[6]、涂层式微针[7]、空心微针[8]、可溶性微针[9-10]、水凝胶微针[11-13],其中可溶性微针以能生物溶解或降解的高分子材料为基质制备而成,针体刺入皮肤后药物开始释放,基质材料也会在体内自行降解,具有安全、有效、无痛的优势[14]。研究表明,它通过全载药方式来实现药物的有效透皮递送,并能增大载药量[15-16]。本实验制备雪上一枝蒿生物碱可溶性微针,以期为相关经皮给药制剂开发利用提供一定参考。
1 材料
1.1 仪器 PDMS 阴模(针长550 μm,浙江台州微芯医药科技有限公司); TD5A-120 型高速离心机(常州金坛良友仪器有限公司); 101-3AB 型电热鼓风干燥箱(天津市泰斯特仪器有限公司);SH-50N 型推拉力计(乐清市艾德堡仪器有限公司); szx7 型摄影体式显微镜、BX53 型正置生物显微镜(日本奥林巴斯公司); E-1045 型离子溅射装置(日本株式会社日立高新技术那珂事务所);Inspect 型扫描电子显微镜 (美国FEI 公司);AE240 型电子天平(十万分之一)、AUY220 型电子天平(万分之一) [梅特勒-托利多仪器(上海)有限公司]; 安捷伦1260 型高效液相色谱仪(美国安捷伦公司); RQJ-12B 型药物透皮扩散试验仪(上海黄海药检仪器有限公司); RM2016 型病理切片机(德国Leica 公司); R35 型切片刀 (日本Feather 公司); JK-6 型生物组织摊烤片机(武汉俊杰电子有限公司); 载玻片及盖玻片(江苏世泰实验器材有限公司)。
1.2 试剂与药物 雪上一枝蒿甲素对照品(中国食品药品检定研究院,批号110895-200404); 雪上一枝蒿生物碱对照品[自制,生物碱含量>70%(以雪上一枝蒿甲素计) ]。雪上一枝蒿购于云南雪上一枝蒿制药有限公司,经贵州中医药大学钟可副教授鉴定为毛茛科乌头属植物短柄乌头Aconitum brachypodumDiels 的干燥块根。聚乙烯吡咯烷酮K30 (PVP K30,北京索莱宝生物科技有限公司,批号511D031); 聚乙烯吡咯烷酮K90 (PVP K90,批号B01A10S84446)、聚乙烯吡咯烷酮K120(PVP K120,批号G13M11B113099) (上海源叶生物科技有限公司); 硫酸软骨素(CS,西安拉维亚生物科技有限公司,批号20180222)。食用酒精(重庆江川化工有限公司); 苏木素(货号H9627,美国Sigma 公司); 伊红Y (水溶性) (货号71014544)、无水乙醇(货号10009218)、二甲苯(货号10023418)、盐酸(货号10011018)、包埋石蜡 ( 货号 69019361)、中性树胶 ( 货号10004160) 均购自国药集团化学试剂有限公司。甲醇(批号20201224)、乙腈(批号20200507)、三氯甲烷(批号20200402) 均购自国药集团化学试剂有限公司。
1.3 动物 SD 大鼠,体质量250 ~280 g,由长沙市天勤生物技术有限公司提供,动物生产许可证号SCXK (湘) 2019-0014。所有动物实验均遵循贵州中医药大学伦理委员会实验动物管理和使用规定,符合3R 原则,伦理审查编号20210046。
2 方法与结果
2.1 生物碱含量测定 采用HPLC 法。
2.1.1 色谱条件 Agilent 色谱柱(150 mm×4.6 mm,5 μm); 流动相磷酸盐缓冲液(pH =7.3) -乙腈 (5 ∶ 95); 体积流量1.0 mL/min; 柱温35 ℃; 检测波长200 nm; 进样量5 μL。
2.1.2 对照品溶液制备 精密称取雪上一枝蒿甲素对照品0.005 0 g,置于10 mL 量瓶中,甲醇定容,摇匀,制成每1 mL 含0.50 mg 该成分的溶液,即得。
2.1.3 供试品溶液制备 取可溶性微针1 片,精密称定质量,加入80 倍量甲醇超声提取30 min,离心,除去不溶性基质材料,置于10 mL 量瓶中,甲醇定容至刻度,0.22 μm 微孔滤膜过滤,取续滤液,即得。
2.1.4 专属性试验 取对照品、供试品溶液适量,在“2.1.1” 项色谱条件下进样测定,结果见图1。由此可知,雪上一枝蒿甲素色谱峰峰形理想,基质材料对测定无干扰,表明该方法专属性良好。

图1 雪上一枝蒿甲素HPLC 色谱图Fig.1 HPLC chromatograms of bullatine A
2.1.5 线性关系考察 精密吸取对照品溶液适量,甲醇依次稀释至0.031 25、0.062 5、0.125、0.25、0.50 mg/mL,在“2.1.1” 项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y) 进行回归,得方程为Y=10 094X-108.44 (r=0.999 4),在0.031 25 ~0.50 mg/mL范围内线性关系良好。
2.1.6 精密度试验 取对照品溶液适量,同一天内在“2.1.1” 项色谱条件下每1 h 进样测定1 次,连续6 次; 同法隔天测定1 次,连续6 d,测得雪上一枝蒿甲素日内、日间峰面积RSD 分别为0.62%、1.12%,表明仪器精密度良好。
2.1.7 稳定性试验 取供试品溶液适量,于0、2、4、8、12、24 h 在“2.1.1” 项色谱条件下进样测定,测得雪上一枝蒿甲素峰面积RSD 为0.90%,表明溶液在24 h 内稳定性良好。
2.1.8 重复性试验 制备供试品溶液6 份,在“2.1.1” 项色谱条件下进样测定,测得雪上一枝蒿甲素峰面积RSD 为0.71%,表明该方法重复性良好。
2.1.9 加样回收率试验 取6 批样品,制成雪上一枝蒿甲素质量浓度为0.09 mg/mL 的供试品溶液,加入同体积0.09 mg/mL 对照品溶液,过0.22 μm 微孔滤膜,在“2.1.1” 项色谱条件下进样测定,计算回收率。结果,雪上一枝蒿甲素平均加样回收率为102.4%,RSD 为2.03%。
2.2 可溶性微针制备 采用离心法,称取基质材料适量,加入一定体积分数乙醇,在水浴锅上充分搅拌至溶解并呈透明状,加入药物搅拌至完全溶解,注入微针模具中,4 000 r/min 离心20 min,取出,置于35 ℃烘箱中干燥6 h,脱模,即得。
2.3 处方优化
2.3.1 单因素试验
2.3.1.1 评价指标确定
(1) 外观形态。肉眼观察微针背衬是否平整,在体式显微镜下观察微针阵列完整性。
(2) 溶解性。将微针扎在保鲜膜上并使针尖全部穿透,覆盖在装满37 ℃水的烧杯上,于3、5、8、10 min 取下微针,在体式显微镜下观察针尖溶解情况,记录其溶解时间。
(3) 机械强度。将大鼠脱颈椎处死并脱毛,剥离皮肤,去掉皮下脂肪后生理盐水反复冲洗干净,保存在生理盐水中,使用前擦干表面水分,将角质层侧向上放置并固定在泡沫板上,微针用20 N压力垂直作用于皮肤上30 s,立即用1%台盼蓝溶液对微针作用处的皮肤进行染色,30 s 后棉签擦掉多余染液,生理盐水清洗干净,观察并记录皮肤表面染色小孔数量,计算刺孔率,公式为刺孔率=(皮肤上针孔数/微针阵列数) ×100%,其中微针阵列数为400 (即微针阴模阵列数)。
(4) 评价标准。见表1。

表1 指标评价标准Tab.1 Evaluation criteria for indices
2.3.1.2 基质材料筛选 硫酸软骨素是关节炎治疗过程中常用的营养补充剂,其耐受性好,副作用小,药物相互作用少,文献[17] 报道它可用于制备可溶性微针。前期预实验发现,硫酸软骨素与聚乙烯吡咯烷酮按一定比例混合制成的微针成型性良好,并具有一定的穿刺能力,故本实验选择两者作为微针基质材料。
乙醇体积分数越大,对雪上一枝蒿生物碱的溶解度越大。通过前期预实验结合溶剂对基质、药物的溶解情况,本实验选择40%乙醇作为溶剂。
分别称取硫酸软骨素90 mg,PVP K30、PVP K90、PVP K12 各270 mg,加入40%乙醇2.5 mL,按“2.1” 项下方法制备可溶性微针,计算外观形态、刺孔率、针尖溶解时间的综合评分,结果见表2。由此可知,硫酸软骨素与PVP K120 混合制成的微针外观形态好,溶解快,机械强度优。

表2 基质材料筛选结果(分)Tab.2 Results for matrix material screening (score)
2.3.1.3 硫酸软骨素用量筛选 称取270 mg PVP K120,共3 份,分别加入硫酸软骨素60、90、120 mg,再加入40% 乙醇2.5 mL,按“2.1” 项下方法制备可溶性微针,计算外观形态、刺孔率、针尖溶解时间的综合评分,结果见表3。由此可知,硫酸软骨素用量为120 mg 时综合评分最高。
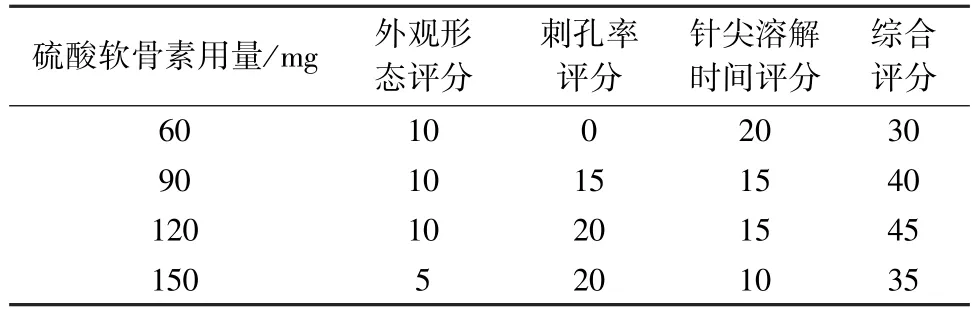
表3 硫酸软骨素用量筛选结果(分)Tab.3 Results for chondroitin sulfate consumption screening (score)
2.3.1.4 PVP K120 用量筛选 称取120 mg 硫酸软骨素,共3 份,分别加入180、270、360 mg PVP K120,再加入40% 乙醇2.5 mL,按“2.1”项下方法制备可溶性微针,计算外观形态、刺孔率、针尖溶解时间的综合评分,结果见表4。由此可知,PVP K120 用量为270 mg 时综合评分最高。

表4 PVP K120 用量筛选结果(分)Tab.4 Results for PVP K120 consumption screening(score)
2.3.1.5 40%乙醇用量筛选 分别称取硫酸软骨素、PVP K120 各3 份,前者用量均为120 mg,后者用量均为270 mg,分别加入40% 乙醇2、2.5、3、3.5 mL,按“2.1” 项下方法制备可溶性微针,计算外观形态、刺孔率、针尖溶解时间的综合评分,结果见表5。由此可知,40% 乙醇用量为2.5 mL 时综合评分最高。
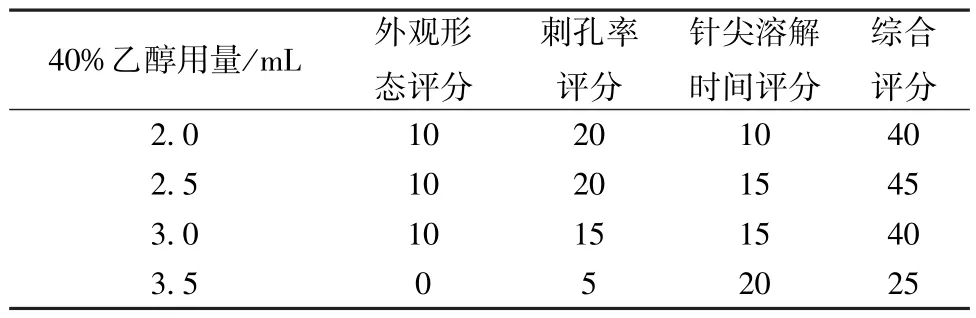
表5 40%乙醇用量筛选结果(分)Tab.5 Results for 40% ethanol consumption screening(score)
2.3.1.6 加药量筛选 称取基质材料3 份,分别加入雪上一枝蒿纯化物15、20、25 mg,按“2.1”项下方法制备可溶性微针,计算外观形态、刺孔率、针尖溶解时间的综合评分,结果见表6。由此可知,不同加药量下综合评分相同,但为25 mg 时离心后有沉淀,而为15、20 mg 时外观形态、溶解性、机械强度均较好,最终确定为20 mg。

表6 加药量筛选结果(分)Tab.6 Results for addition dosage screening (score)
2.3.2 Box-Behnken 响应面法 在单因素试验基础上,以硫酸软骨素用量 (A)、PVP K120 用量(B)、40% 乙醇用量(C) 为影响因素,刺孔率(Y) 为评价指标,Box-Behnken 响应面法优化处方,因素水平见表7,结果见表8。

表7 Box-Behnken 响应面法因素水平Tab.7 Factors and levels for Box-Behnken response surface method
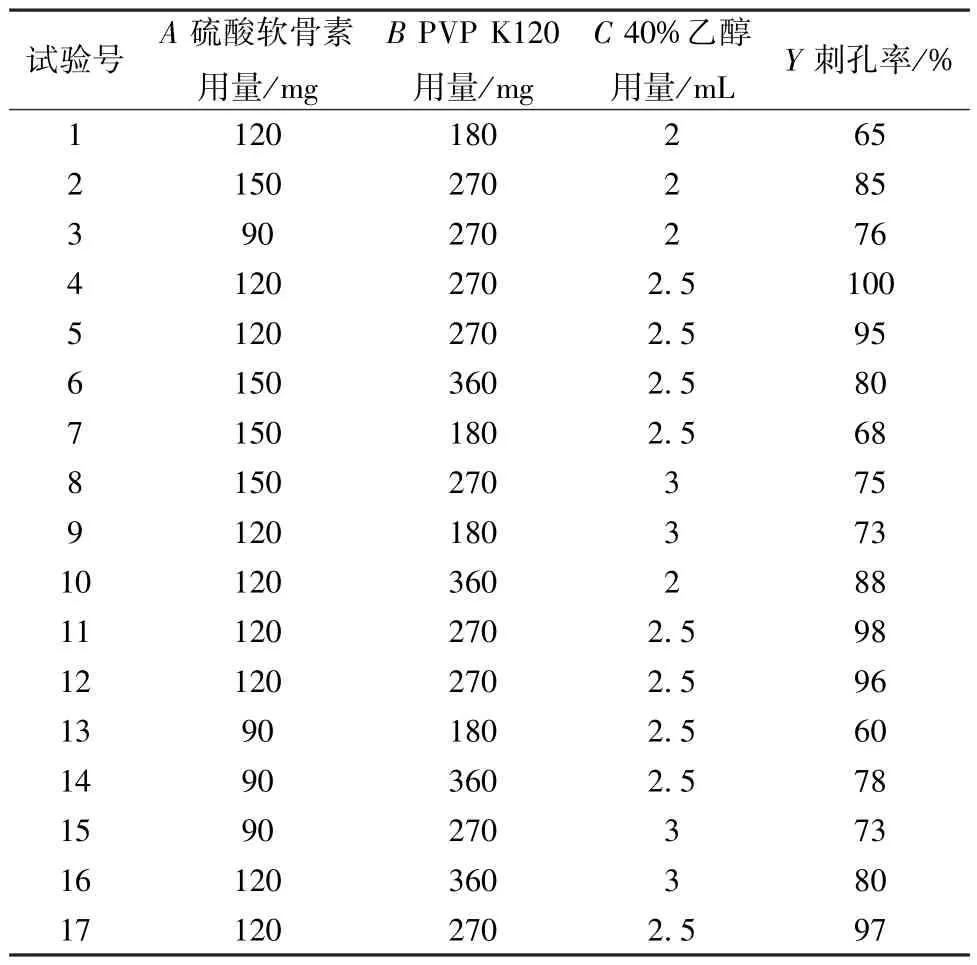
表8 Box-Behnken 响应面法设计与结果Tab.8 Design and results for Box-Behnken response surface method
采用Design Expert 10.0 软件对表8 数据进行拟合,得方程为Y=97.20+2.62A+7.50B-1.63C-1.50AB- 1.75AC- 4.00BC- 12.48A2- 13.22B2-7.48C2,方差分析见表9。由此可知,模型P<0.01,具有高度显著性; 失拟项P>0.05,表明模型能较好地反映综合评分与各影响因素之间的关系; 变异系数为2.78,表明模型较稳定; 决定系数、校正决定系数分别为0.985 3、0.966 4,表明模型拟合程度良好。响应面分析见图2。

表9 方差分析结果Tab.9 Results for analysis of variance
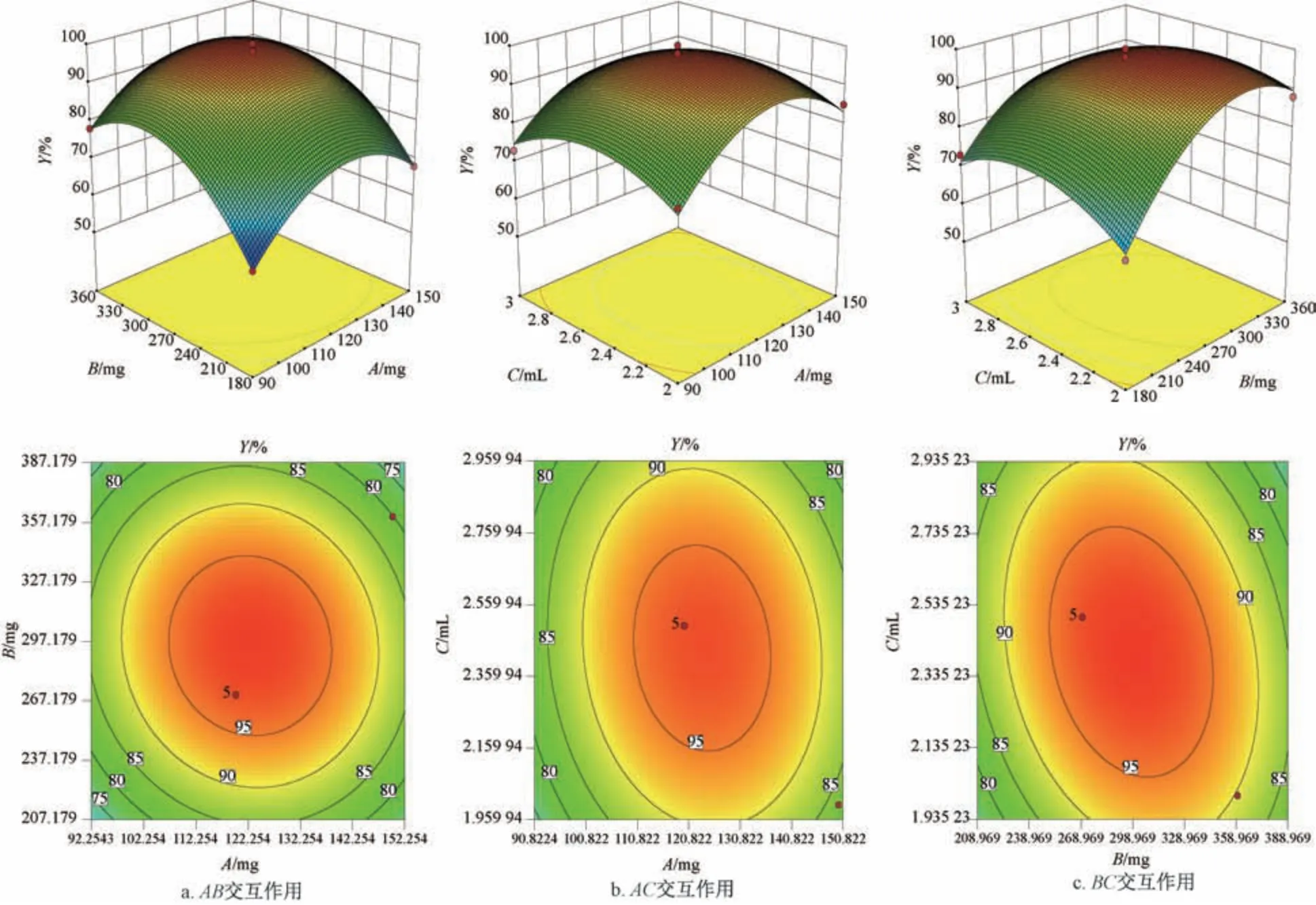
图2 各因素响应面图Fig.2 Response surface plots for various factors
最终确定,最优处方为硫酸软骨素用量123.025 mg,PVP K120 用量297.794 mg,40%乙醇用量2.399 mL,刺孔率为98.954%,结合实际情况,将其修正为硫酸软骨素用量123 mg,PVP K120 用量298 mg,40%乙醇用量2.4 mL。按上述优化处方制备3 批样品,测得刺孔率分别为97%、98%、100%,平均值为98.3%,RSD 为1.3%,表明该工艺稳定可靠,重复性良好。
2.4 可溶性微针表征
2.4.1 形态 用数码相机拍摄按“2.3” 项下最优处方制备的可溶性微针外观形态,并在扫描电子显微镜下观察,结果见图3。由此可知,该制剂为正方形贴片(2.79 cm2),黄色,表面光滑,阵列完整,共有400 颗针,间距为400 μm; 针体呈圆锥形,长度为550 μm,底部直径为300 μm。

图3 雪上一枝蒿生物碱可溶性微针形态Fig.3 Morphology for soluble microneedles of A.brachypodum alkaloids
2.4.2 穿刺性能
2.4.2.1 铝箔穿刺试验 将铝箔平整铺于泡沫上,用大拇指按压铝箔上的微针30 s 后移走,发现能清晰地看见孔洞,见图4A。

图4 雪上一枝蒿生物碱可溶性微针穿刺性能图Fig.4 Images for piercing performance of soluble microneedles of A.brachypodum alkaloids
2.4.2.2 离体大鼠皮肤穿刺试验 按“2.3.1.1”项下方法对穿刺性能进行表征,发现大鼠皮肤表面留下针尖样蓝色印迹,见图4B。
2.4.2.3 离体大鼠皮肤穿刺组织学检查 大鼠以10%水合氯醛麻醉,腹部去毛擦干,将微针以20 N的压力施于脱毛皮肤处,保持30 s 后移除微针,1 min 内立即剥离穿刺后的皮肤,置于4%多聚甲醛中固定24 h,经脱水、浸蜡、包埋、切片、干燥、HE 染色后拍照,发现它成功刺破皮肤角质层后进入表皮层,并且未触及到真皮层神经末梢,能起到无痛给药的效果,见图4C。
2.4.3 含药量测定 取3 批样品,精密称定质量,加80 倍量甲醇超声提取30 min,离心,除去不溶性基质材料,置于10 mL 量瓶中,甲醇定容至刻度,0.22 μm 微孔滤膜过滤,取续滤液,在“2.1.1” 项色谱条件下进样测定,测得雪上一枝蒿甲素平均含量为(0.94±0.025) mg。
2.5 体外透皮试验 参考文献[18] 报道制备雪上一枝蒿生物碱凝胶膏剂,组成为甘油、纯水、NP-700、Al (OH)3、酒石酸 (比例0.647 5 ∶0.171 2 ∶0.144 6 ∶0.016 3 ∶0.006 8),含雪上一枝蒿甲素0.94 mg/g。取1 g 均匀涂布在背衬层上,涂布面积同微针面积一致。
大鼠以10% 水合氯醛麻醉,先用剃毛器剃去大部分鼠毛,再用电动剃须刀剃去剩下鼠毛,取下皮肤,剥离脂肪组织和筋膜,生理盐水反复清洗,滤纸吸干,锡箔纸包裹后置于-80 ℃冰箱中,使用时取出,放入生理盐水中浸泡30 min。
采用改良的Franz 扩散池,以凝胶膏剂组为对照考察可溶性微针体外透皮性能。将1 片微针置于处理好的离体大鼠皮肤上,并施加20 N 的力,1 min后用医用胶带固定,其间需保证皮肤完整性。将皮肤固定在供给池与接受室连接处,角质层朝向供给池,真皮层与接受室连接,向接受室内注入生理盐水6.5 mL,排净气泡以使接收液面与皮肤完全接触; 另设1 组,皮肤不做任何处理,给予等量凝胶膏剂,贴敷在皮肤角质层上侧,可溶性微针组、凝胶膏剂组分别平行3 次。固定供给池和接收室,将扩散池置于磁力搅拌器上,37 ℃恒温水浴搅拌(转速300 r/min),于透皮0、1、2、4、6、8、12、18、24 h 吸取接受液各1.5 mL,置于2 mL PVC 管中,同时补充等体积、等温度生理盐水,取样液用0.22 μm 微孔滤膜过滤,在“2.1.1” 项色谱条件下进样测定,绘制累积渗透曲线,计算累积渗透率,公式为累积渗透率= (Qn/载药量) ×100%,Qn= (Cn×V+∑n-1i=1Ci×V0) /S,其中Qn为第n个取样点药物单位面积累积渗透量,Cn为第n个取样点接收液中药物质量浓度,Ci为第i(i≤n-1) 个取样点接收液中药物质量浓度,V0为取样体积 (1.5 mL),S为药物有效透过面积 (2.8 cm2),V为接收池体积(6.5 mL),结果见图5。

图5 生物碱体外透皮曲线Fig.5 In vitro transdermal curves for alkaloids
由此可知,1 h 内可溶性微针组透过药物量多于凝胶膏剂组,6 h 内累积渗透率大于50%,24 h内达91.4%,而凝胶膏剂组仅为41.8%; 可溶性微针组药物累积渗透量明显高于凝胶膏剂组,表明该制剂可有效刺进皮肤并经皮释药,还能明显提高药物经皮渗透效果。
2.6 模型拟合 分别采用零级、一级、Higuchi 方程对图5 数据进行拟合,结果见表10。由此可知,可溶性微针渗透符合Higuchi 方程,而凝胶膏剂渗透符合零级方程; 两者稳态透皮速率Jss分别为9.27、6.13,表明可溶性微针渗透性更强。

表10 模型拟合结果Tab.10 Results for model fitting
3 讨论
课题组前期查阅文献[19-20] 发现,微针打开的通道能维持4~6 h,并且其背衬层药物可沿该通道继续释放。因此,本实验制备全载药微针以快速建立有效血药浓度,并在一定时间内维持稳定。
离体皮肤渗透结果显示,与凝胶膏剂组比较,可溶性微针组给药1 h 内渗透较快,累积渗透率达22%左右,1 h 后有所减缓,2 h 内累积渗透率达40%左右,之后在2~8、8~24 h 逐步减慢,但这2个时间段都比较平稳; 可溶性微针组6 h 内累积渗透率达50%以上,24 h 内基本释放完全,释药过程符合 Higuchi 方程,累积渗透量达306.79 μg/cm2。由此可知,可溶性微针经皮给药后药物可在较短时间内快速透过皮肤,并且针尖药物释放完后背衬层可继续释药,以期维持一定的药物浓度,从而达到持续治疗的作用。
另外,硫酸软骨素是目前常用的可溶性微针基质材料,已被日本和欧洲批准用于治疗骨性关节炎[21-23]。因此,本实验选择硫酸软骨素作为雪上一枝蒿生物碱可溶性微针的基质,从而达到“药辅合一” 的效果。

