秸秆还田下氮素调控对盐碱地玉米根际土壤细菌群落多样性的影响
李磊 李晓慧 樊丽琴 王旭 吴霞

摘要: 为探明秸秆还田措施下氮素调控水平对盐碱地玉米根际土壤细菌群落多样性的影响,选取2016—2020年连续5年秸秆还田定位试验土壤,建立盆栽试验,设置不施氮(N0)、施氮量180 kg/hm2(N180)、360 kg/hm2(N360)、540 kg/hm2(N540)4个处理,分析不同氮素调控水平下土壤关键理化因子特性及根际土壤微生物群落多样性变化。结果表明,不同氮素调控水平对土壤全盐含量、pH值及有机质含量无显著性影响(P>0.05)。其中,N360处理相比N0处理显著增加速效氮、有效磷及速效钾含量,且增加脲酶、碱性磷酸酶及蔗糖酶的活性。基于高通量测序发现,根际土壤细菌OTU在各处理间大小依次为N180>N0>N540>N360,N180处理相比N0处理提高Chao1指数,而N180、N360、N540处理相比N0处理降低了Shannon指数;群落结构组成显示,N180、N360、N540处理相比N0处理降低门水平下优势菌群变形菌门(Proteobacteria)相对丰度,提高酸杆菌门(Acidobacteria)G6分属及芽单胞菌属(Gemmatimonas)、亚硝化球菌属(Nitrososphaera)相对丰度;冗余分析得出土壤有效磷与细菌群落间关系密切。综上,秸秆还田措施下,施氮量 360 kg/hm2 处理提高土壤速效养分含量、酶活性,而施氮量180 kg/hm2有助于增加根际土壤细菌OTU,同时能提高土壤细菌物种总数,改善土壤群落结构。
关键词: 盐碱地;氮素;土壤;速效养分;酶;细菌群落;群落结构;生物多样性
中图分类号:S513.06;S154.3 文献标志码:A
文章编号:1002-1302(2024)02-0221-07
充分开发作为我国后备耕地资源的盐碱地,对保障粮食安全意义非凡。宁夏地处西北内陆,位于黄河上游下段,近年来,随着灌溉农业快速发展,土壤次生盐渍化现在愈加明显[1]。据统计,宁夏灌区盐渍退化型耕地面积为17.67万hm2,占全区总耕地面积的13.7%[2]。盐渍化最基本的特点就是土壤盐碱并存、营养元素缺少、土壤结构崩解。现有的改良措施中,秸秆还田措施不仅投入成本低,实现了农业固体废弃物资源化利用,而且自身富含碳源,还田后在增加土壤碳汇的同时,改善土壤微生物活动,对于土壤结构重塑具有明显的效应。此外,还田措施下,氮肥的投入往往显得尤为重要,合理的氮源供应不仅调节微生物活动,同时降低农田生态系统氮素淋溶风险[3-5]。
土壤微生物作为生态系统中分解者,可有效分解有机物质,释放营养物质,供作物利用,并形成腐殖质,改善土壤的结构和耕性[6-7]。土壤细菌在微生物中数量最多、分布最广,它在调节农田养分循环和作物生产力方面发挥了重大作用。因其微而小,所以极易受土壤环境直接影响,从而导致群落结构和优势菌群发生明显变化。在众多土壤环境因素中,施肥成为影响其最关键的因素之一[8-10]。汪海静等的研究表明,施肥可通过土壤养分库容来直接影响细菌微生物群落结构及其多样性[11];Zhao等通过建立小麦—玉米轮作种植制度,发现该种模式下农田生态系统土壤中细菌微生物丰度在增施氮肥处理下明显提高[12];Fiere等的研究表明,施氮对于细菌多样性没有显著性影响,但会对细菌群落组成产生明显差异性[13];Zeng等的研究表明,增施氮肥反而会降低土壤细菌微生物群落丰度[14]。
综上所述,氮素对于土壤细菌微生物群落多样性变化影响很大,结果也有所差异。近年来,宁夏银北盐碱地秸秆还田工作中,对于氮肥施用量缺乏明确的理论依据。因此,本试验于2021年采集2016—2020年宁夏平罗县黄渠桥真通润村粉碎秸秆定位试验的土壤,建立盆栽试验,开展不同氮素调控水平下细菌微生物多样性研究,以期筛选适宜微生物活动且提高养分库容扩增的最佳氮素调控水平,探明影响细菌群落多样性最关键土壤理化因子,本研究结果为盐碱地科学施肥、氮肥减施目标提供理论依据。
1 材料与方法
1.1 研究区、供试土壤概况
研究区位于宁夏平罗县黄渠桥镇通润村(106.643 8°E,39.023 8°N)。该地区属于大陆性气候,春旱多风,平均风速 2 m/s,盛行西北风或北风,年均降水量 200 mm左右,主要集中在6—9月,年均蒸发量接近2 000 mm,无霜期为171 d。
本试验采用盆栽试验,在农户庭院中开展。土壤选自2016—2020年连续5年粉碎秸秆还田定位试验土壤。2021年10月采集耕层(0~25 cm)土壤测定基本理化性质,结果显示该试验区土壤 pH值为8.35,显碱性,全盐含量为 2.62 g/kg,属硫酸盐-氯化物盐渍土,有机质含量为18.02 g/kg,处于4级缺乏水平;速效氮含量为 55.21 mg/kg,处于5级极缺乏水平;速效钾含量为 225.21 mg/kg,处于1级极丰富水平;有效磷含量为11.12 mg/kg,处于3级丰富水平;沙粒含量为 14.26%,粉粒为 62.62%,黏粒为 23.12%,土壤质地为粉沙质黏壤土。
1.2 试验设计
本试验在粉碎秸秆还田基础上开展氮素调控水平研究,指示作物为青贮玉米登海青贮393品种。供试土壤风干、研磨、过2 mm筛备用,花盆采用瓷质材料,直径45 cm、高度30 cm。基于2016—2018年粉碎秸秆还田试验筛选最佳还田量为 6 000 kg/hm2[15]。花盆内装土20 g/盆并施入15 g/盆秸秆,混匀,秸秆来自农户2021年自然风干的玉米秸秆, 施入前进行人工粉碎,粉碎机粉碎至3~5 cm小段,按照质量比100 ∶ 1 配施秸秆腐熟剂,另外增施氮素 150 kg/hm2 调节 C/N 为 25 ∶ 1, 然后充分灌溉沤熟。
采用单因素多水平随机区组设计,分别设置常规施肥减氮3/3(N0)、常规施肥减氮2/3(N180)、常规施肥减氮1/3(N360)、常规施肥不减氮(N540)。其中,常规施肥施氮量为540 kg/hm2;磷素来源于过磷酸钙,施用量为750 kg/hm2;钾素来源于硫酸钾,施用量为75 kg/hm2;磷钾肥全部基施,氮肥40%基施,剩余的60%分别在玉米拔节期、抽雄期追施,肥料水溶后施入,4月中旬完成播种。试验设置16个花盆,每个处理4次重复, 花盆四周用土簇拥。灌溉水采用黄河水(矿化度为1.05 g/L, pH值为7.72),額外设置装有时域反射仪(TDR)配套聚乙烯管的花盆,按时监测土壤水分变化,依据土壤田间持水量65%~90%原则,结合玉米需水规律与土壤水分变化,及时补水。
1.3 测定项目及方法
1.3.1 样品采集
土壤样品:2021年9月采集土壤背景值,2022年9月采集花盆土壤样品用于土壤养分及细菌群落多样性分析。将取出的整株玉米根系置于晒筐中,无菌条件下采用抖落法采集根际土壤。4个花盆样品均匀混成1个样品,置于样品冻存管,用干冰保存带回实验室,置于-80 ℃冰箱中保存,用于提取DNA。抖落下的土样用塑封袋带回实验室,一部分测定土壤pH值及全盐、有机质、速效氮、有效磷、速效钾含量;另一部分保存在4 ℃冰箱中,用于酶活性测定。
1.3.2 土壤基本理化性质测定
土壤pH值用pH计测定(水土质量比2.5 ∶ 1);土壤全盐含量与水样矿化度采用DDS-11电导率仪测定,全盐含量由电导率与含盐量关系式反推求出;有机质含量采用重铬酸钾-浓硫酸加热法测定,速效氮含量采用碱解扩散法测定;速效磷含量用0.5 mol/L碳酸氢钠浸提-钼锑抗比色法,速效钾含量用1 mol/L醋酸铵溶液浸提-火焰光度计法测定[16]。
1.3.3 土壤酶活性测定
采用磷酸苯二钠比色法测定碱性磷酸酶活性;用靛酚蓝比色法测定脲酶活性;用3,5-二硝基水杨酸比色法蔗测定蔗糖酶活性;用高锰酸钾滴定法测定过氧化氢酶活性[17] 。
1.3.4 细菌微生物多样性测定
细菌微生物多样性测序交由上海天昊生物科技有限公司完成。具体测序流程如下:基因组DNA质量检测、样本进行目的区域检测扩增、各样本添加特异性标签序列、文库进行定量及混合、文库质量检测、Illumina上机测序。其中,扩增引物序列:Primer F=Illumina adapter sequence 1+5′- G T G C C A G C M G C C G C G G -3′;Primer R=Illumina adapter sequence 2+5′- C C G T C A A T T C M T T T R A G T T T -3′。
1.4 数据分析与处理
1.4.1 多样性指数计算
Chao1用于估计样本中物种总数,数值越大,代表物种越多。Shannon、Simpson用来估算样本中微生物的多样性指数,Shannon值越大,说明群落多样性越高;Simpson指数值越大,说明群落多样性越低。
Chao1=Sobs+ n1(n1-1) 2(n2+1) ; (1)
Shannon=∑ Sobs i=1 ni N ln ni N ; (2)
Simpson= ∑ Sobs i=1 ni(ni-1) N(N-1) 。 (3)
式中:Sobs表示实际测量处的操作分类单元(OTU)数量;ni表示第i个OTU含有的序列数量;N表示所有的序列数;n1表示只含有1条序列的OTU数;n2表示只含有2条序列的OTU数。
1.4.2 数据处理分析
试验数据以Excel 2003软件进行整理,同时利用SPSS 17.0软件描述统计特征值进行数据分析。用方差分析(ANOVA)和最小显著性检验(LSD)做数据差异显著性检验(α=0.05,n=5)。用Origin 9.0软件绘图。
2 结果与分析
2.1 氮素调控对土壤养分含量及酶活性的影响
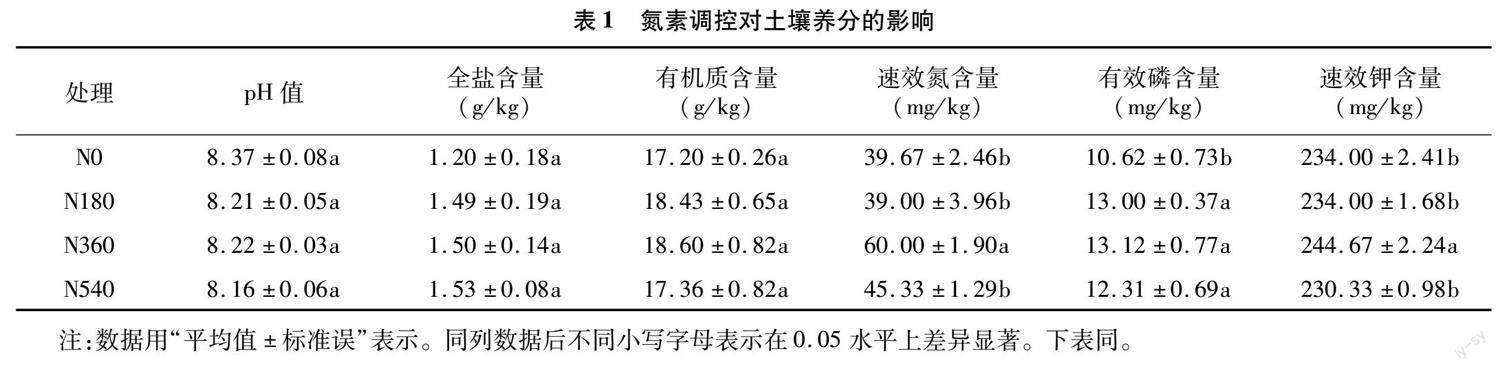
对土壤养分库容进行分析,结果如表1所示。不同氮素调控水平对土壤pH值、全盐及有机质含量影响不大,各处理间无显著性差异(P>0.05),速效氮含量在N0、N180、N540处理间无显著性差异(P>0.05),N360处理显著增加速效氮含量相比N0、N180、N540处理分别显著增加51.25%、53.84%、32.36%;有效磷含量在N180、N360、 N540处理间无显著性差异(P>0.05),相比N0处理分别显著增加22.41%、23.54%、15.91%;N360处理的速效钾含量相比N0、N180、N540处理分别显著增加4.56%、4.56%、6.23%。由此可见,施氮量 360 kg/hm2 有助于增加土壤速效养分。
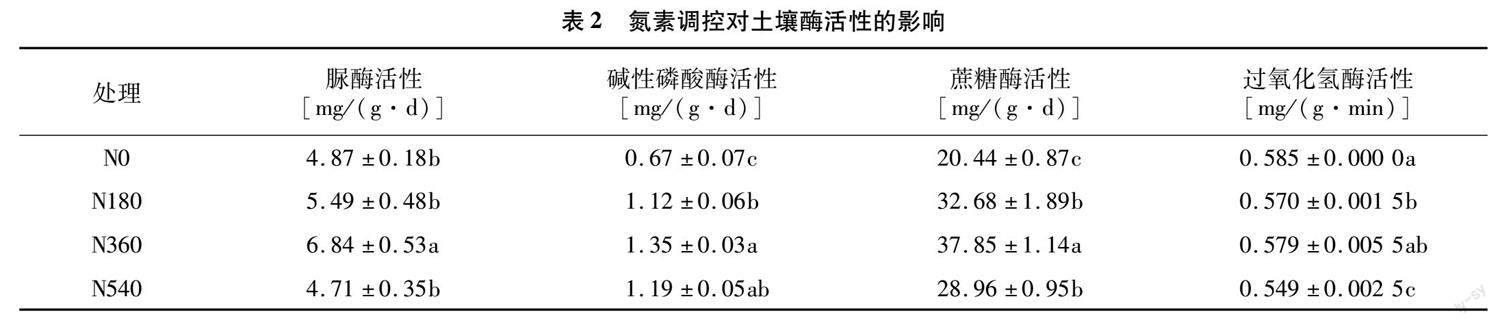
土壤酶为土壤生物催化剂,其活性对土壤质量评价具有重要作用。氮素调控水平下,土壤酶活性在各处理间存在显著性差异(P<0.05)。其中,N360处理的脲酶活性相比N0、N180、N540处理分别显著增加40.45%、24.59%、45.22%;碱性磷酸酶活性在N360处理下最高,其次为N540处理,而N0处理显著最低;蔗糖酶活性在N360处理下最高,相比N0、N180、N540处理分别显著增加85.18%、15.82%、30.70%;过氧化氢酶活性在N180、N540处理下显著降低,分别比N0处理显著降低2.56%、6.15%(表2)。由此可见,氮素调控水平对土壤酶活性影响较大,适量氮素有助于提高土壤酶活性,而过量氮素反而会降低土壤酶活性。
2.2 氮素调控对土壤细菌OTU数的影响
OTU是为便于分析而人为设置的分类单元标志,以 97%的相似性对序列进行聚类。本研究基于OTU丰度,通过Venn图(图1)可视化展示,发现N0、N180、N360、N540处理下OTU数分别为4 025、4 056、3 729、3 780个,4个处理共有832个OTU数。由此可见,N180处理相比NO会增加土壤细菌OTU数目,而N360、N540处理会降低土壤细菌OTU数目。共有OTU数表明各处理间细菌群落有一定的相似性和差异性。
2.3 氮素调控对土壤细菌群落结构组成的影响
测序结果(图2、图3)显示,门水平下变形菌门(Proteobacteria)相对丰度最大,为25.91%~35.24%,属于优势菌群;其次为绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)。不同氮素调控水平对优势菌群相对丰度影响较大。其中,N180、N360、N540处理相比N0处理显著降低变形菌门相对丰度,而总体提高了绿弯菌门与酸杆菌门相对丰度。为进一步细化分析细菌群落结构间的差异,在属水平开展分析,共检出425个属。其中,N180、N360、N540处理相比N0处理降低了unassigned菌属相对丰度,提高了酸杆菌门(Acidobacteria)GP6分属相对丰度,增幅分别为9.35%、18.42%、32.27%;此外,N180、N360、N540處理相比N0处理增加了芽单胞菌属(Gemmatimonas)相对丰度,增幅分别为18.01%、12.46%、32.53%。
2.4 氮素调控对土壤细菌多样性指数的影响
总体而言,氮素不同调控水平对土壤细菌群落多样性指数影响不大,各处理间无显著性差异(P>0.05)。但随着氮素调控水平增加,Chao1指数表现为先增加后降低趋势。其中, N180处理提高Chao1指数,相比N0处理增加了1.92%,而N360、N540处理分别比N0处理降低3.02%、2.15%;与N0处理相比,N180处理下Shannon指数几乎没变化,而N360、N540处理下Shannon指数有所降低;N180、N360、N540处理相比N0处理均增加了Simpson指数(图4)。由此可见,施氮量180 kg/hm2会增加土壤细菌物种总数,而过量会造成物种总数降低。另外,施氮量180 kg/hm2对土壤细菌群落多样性影响不大,而施氮量360、540 kg/hm2会降低土壤细菌群落多样性。
2.5 氮素调控下对土壤环境因子与样本/菌群RDA分析
门水平下,通过冗余分析(redundancyanalysis,RDA)探索了主要环境因子与物种群落之间的关系,结果如图5所示。第1个主成分(RDA1)对细菌群落总变异的解释率为61.97%,而第2个主成分(RDA2)对细菌群落总变异的解释率为17.50%,累积解释率为79.47%。其中,环境因子中有效磷(AP)含量对细菌群落物种丰富度影响最大,与变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)的相对丰度间存在负相关关系。为进一步挖掘主要环境因子,在属水平下,第1个主成分(RDA1)对细菌群落总变异的解释率37.69%,而第2个主成分(RDA2)对细菌群落总变异的解释率28.74%,累积解释率为66.43%。环境因子中有效磷含量对细菌群落物种丰富度影响最大,与芽单胞菌属(Gemmatimonas)、酸杆菌门(Acidobacteria) G4、G6分属、亚硝化球菌属(Nitrososphaera)的相对丰度间存在正相关关系。
3 讨论
3.1 氮素调控对土壤养分及酶活性的影响
氮素在土壤中移动性强,对作物生长发育及产量提升有很明显限制效应[18]。在秸秆还田措施下,氮素调控对于促进微生物活动、 秸秆腐解、养分释放、土壤养分库容起到重要作用。土壤速效养分作为植物可快速吸收利用的营养物质,极易受到氮素调控水平的影响。本试验研究表明,施氮量360 kg/hm2 处理有助于提高土壤速效氮、有效磷及速效钾含量,而施氮量540 kg/hm2处理会降低土壤速效养分含量。这与秦宇坤等的研究结果[19-21]相一致,因为适宜的施氮量与秸秆碳形成良好的微生物环境,加速秸秆养分释放,快速形成根际缓效供应的养分库[22]。
土壤酶活性对土壤环境十分敏感[23]。本试验研究表明,在秸秆还田措施下,施氮量360 kg/hm2处理有助于提高土壤脲酶、碱性磷酸酶、蔗糖酶活性,这与郭天财等的研究结果[24-27]相一致。可能是因为适宜氮素供应促进了植物新陈代谢进程,根际分泌物增加,微生物活动加快,秸秆腐解率增大,能为土壤提供含氮、磷酶促基质,有利于土壤酶活性增强。另外,本试验研究表明,氮素不利于土壤过氧化氢酶活性提升,施氮量540 kg/hm2处理显著降低了过氧化氢酶活性,这与王帅兵等的研究结果[28-29]有所不一致。可能是因为过氧化氢酶对盐碱胁迫较为敏感。同时,过氧化氢酶一般与土壤有机质有密切关系,高氮对土壤有机质有降低趋势,抑制了好氧微生物活动,从而导致过氧化氢酶活性降低[30]。
3.2 氮素调控对土壤细菌多样性的影响
土壤细菌微生物对于物质交换与能量流动起到关键性作用,在土壤健康保育过程中扮演重要角色[31]。Copley认为,土壤环境中的微生物功能及群落多样性对于生态学发展至关重要[32]。土壤微生物大体分3类,即细菌、放线菌及真菌。其中,细菌与土壤接触表面积最大,数量巨大,是土壤代谢最重要的生物类群[33]。细菌不仅参与土壤有机质的转化,同时也参与土壤养分循环利用。在众多施肥措施中,氮素作为植物最基本的养分供给,其施用量对细菌微生物多样性有显著影响[34]。本研究结果表明,施氮量180 kg/hm2处理下土壤细菌OTU数最多,同时该处理相比不施氮肥处理,施氮量360、540 kg/hm2处理均会提高细菌Chao1指数。另外,施氮量180 kg/hm2处理对土壤细菌群落多样性影响不大,而施氮量540 kg/hm2处理会降低细菌Shannon指数。这与Malhi等的研究结果[35-36]基本一致,可能是因为高氮与秸秆碳会导致微生物发生自溶及微生物代谢失衡,最终会影响细菌微生物活动,降低群落多样性。
氮素調控水平对细菌群落组成也影响较大。本研究基于高通量测序发现,土壤细菌主要菌门中变形菌门相对丰度最大,而秸秆还田措施下施氮处理会降低该菌门相对丰度,增加绿弯菌门与酸杆菌门相对丰度,这一结果与Beauregard等的研究结果[37-38]不一致。可能因为与土壤养分及土壤pH值有关,变形菌门属于富营养细菌,本试验过量施用氮素会降低土壤速效养分,无法为微生物活动提供充足的营养物质,从而导致变形菌门相对丰度有所降低。众多研究表明,土壤绿弯菌门、酸杆菌门的相对丰度与土壤 pH 值呈显著负相关[39-41],而本试验也证明了这一点(图5)。施氮降低了土壤pH值(表1),从而在一定程度上提高了土壤绿弯菌门、酸杆菌门的相对丰度。
此外,本试验结果还表明,有效磷含量与门、属水平下微生物群落结构相对丰度关系密切,尤其与芽单胞菌属,酸杆菌门G6、G7分属,亚硝化球菌属间存在正相关关系。芽单胞菌属具有分解有机质、解磷活钾功效;酸杆菌门G6、G7分属有助于腐解纤维,加快秸秆矿化速率;而亚硝化球菌属与自然界生物脱氮息息相关,对于降低氮素污染起到积极作用[42-43]。
4 结论
在秸秆还田措施下,施氮量360 kg/hm2处理有助于提高土壤速效氮、有效磷与速效钾含量及脲酶、碱性磷酸酶与蔗糖酶的活性。测序结果表明,施氮量180 kg/hm2处理有助于提高土壤细菌OTU数、Chao1指数和物种总数。群落结构组成显示,施氮处理均会降低优势菌群变形菌门以及酸杆菌门G6分属、芽单胞菌属、亚硝化球菌属的相对丰度,且各处理间无显著性差异。冗余分析结果表明,有效磷含量与土壤细菌群落组成关系密切,与酸杆菌门G6分属及芽单胞菌属、亚硝化球菌属的相对丰度呈正相关。因此,在盐碱地施肥过程中应适当增施磷肥提高土壤有效磷含量,进而促进微生物活动。
参考文献:
[1] 周 华,盛秀红,刘 勇. 宁夏灌区土壤盐渍化变化趋势及治理[J]. 中国农业综合开发,2020(6):31-33.
[2]王 玮,陈 亮,周 斌. 宁夏退化耕地治理初探[J]. 中国农业综合开发,2021(11):41-44.
[3]李 磊,王 晶,朱志明,等. 氮肥减施与有机肥/秸秆配施对盐碱地土壤肥力指标及玉米产量的影响[J]. 土壤通报,2020,51(4):928-935.
[4]翟明振,胡恒宇,宁堂原,等. 盐碱地玉米产量及土壤硝态氮对深松耕作和秸秆还田的响应[J]. 植物营养与肥料学报,2020,26(1):64-73.
[5]萨如拉,杨恒山,范 富,等. 玉米秸秆还田对盐碱地土壤细菌多样性的影响[J]. 玉米科学,2017,25(2):106-111.
[6]孙建波,李淑霞,李春强,等. 有机无机肥配施对香蕉田土壤细菌群落数量和结构的影响[J]. 福建农业学报,2022,37(11):1476-1482.
[7]郑敏娜,梁秀芝,韩志顺,等. 不同改良措施对盐碱土土壤细菌群落多样性的影响[J]. 草地学报,2021,29(6):1200-1209.
[8]王国丽,张晓丽,张晓霞,等. 施用功能微生物菌剂对重度盐碱地向日葵生长及土壤微生物的影响[J]. 中国土壤与肥料,2021(5):133-139.
[9]林耀奔,杨建辉,叶艳妹. 盐碱地不同土地利用方式下土壤细菌群落结构多样性差异分析[J]. 环境科学学报,2019,39(4):1266-1273.
[10] 李 明,马 飞,陈晓娟,等. 不同土地利用方式对宁夏盐渍化土壤细菌群落的影响[J]. 西北植物学报,2021,41(12):2153-2162.
[11]汪海静. 土壤微生物多样性的主要影响因素[J]. 环境与发展,2011,23(1):90-91,118.
[12]Zhao S C,Qiu S J,Cao C Y,et al. Responses of soil properties,microbial community and crop yields to various rates of nitrogen fertilization in a wheat-maize cropping system in north-central China[J]. Agriculture,Ecosystems & Environment,2014,194:29-37.
[13]Fierer N,Bradford M A,Jackson R B.Toward an ecological classification of soil bacteria[J]. Ecology,2007,88(6):1354-1364.
[14]Zeng J,Liu X J,Song L,et al. Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition[J]. Soil Biology and Biochemistry,2016,92:41-49.
[15]李 磊,樊丽琴,吴 霞,等. 秸秆还田对盐碱地土壤物理性质、酶活性及油葵产量的影响[J]. 西北农业学报,2019,28(12):1997-2004.
[16]鲍士旦. 土壤农化分析[M]. 3版.北京:中国农业出版社,2000.
[17]关松荫. 土壤酶及其研究法[M]. 北京:农业出版社,1986.
[18]张 磊,孔丽丽,侯云鹏,等. 实现黑土玉米高产和养分高效的控释氮肥与尿素掺混比例[J]. 植物營养与肥料学报,2022,28(12):2201-2213.
[19]秦宇坤,李鹏程,郑苍松,等. 施氮量对低肥力棉田土壤氮素及棉花养分吸收利用影响[J]. 棉花学报,2019,31(3):242-253.
[20]李金婷,韦锦坚,韦持章,等. 茶树/大豆间作体系氮素对茶叶品质成分及其土壤养分的影响[J]. 华北农学报,2021,36(增刊1):282-288.
[21]柴 颖. 氮磷肥配施对土壤速效养分及玉米产量的影响[D]. 石河子:石河子大学,2015.
[22]王 楠,姚 凯,赵志祎,等. 氮素不同形态配比对白浆土养分性状的调控[J]. 江苏农业科学,2017,45(21):301-304.
[23]孔雪静. 地膜覆盖和秸秆还田对玉米地与土壤氮素转化相关的土壤酶活性影响研究[D]. 兰州:兰州大学,2016.
[24]郭天财,宋 晓,马冬云,等. 施氮量对冬小麦根际土壤酶活性的影响[J]. 应用生态学报,2008,19(1):110-114.
[25]Deng S P,Tabatabai M A.Effect of tillage and residue management on enzyme activities in soils:Ⅲ. Phosphatases and arylsulfatase[J]. Biology and Fertility of Soils,1997,24(2):141-146.
[26]梁国鹏,Albert H A,吴会军,等. 施氮量对夏玉米根际和非根际土壤酶活性及氮含量的影响[J]. 应用生态学报,2016,27(6):1917-1924.
[27]杜泽云,陶思敏,娄运生,等. 施用生物炭和硅肥对增温稻田土壤酶活性的影响[J]. 江苏农业科学,2023,51(1):225-231.
[28]王帅兵,孟会生,武 欣,等. 不同形态氮肥配施固氮菌对复垦土壤酶活性及氮素形态的影响[J]. 灌溉排水学报,2022,41(11):45-49,77.
[29]高金虎,孫占祥,冯良山,等. 秸秆与氮肥配施对辽西旱区土壤酶活性与土壤养分的影响[J]. 生态环境学报,2012,21(4):677-681.
[30]杨 瑒,靳学慧,周 燕,等. 施氮量对寒区盐碱地马铃薯生育期土壤微生物数量和酶活性的影响[J]. 中国土壤与肥料,2014(3):32-37.
[31]傅声雷. 土壤生物多样性的研究概况与发展趋势[J]. 生物多样性,2007,15(2):109-115.
[32]Copley J. Ecology goes underground[J]. Nature,2000,406(6795):452-454.
[33]Gans J,Wolinsky M,Dunbar J. Computational improvements reveal great bacterial diversity and high metal toxicity in soil[J]. Science,2005,309(5739):1387-1390.
[34]Malhi S S,Nyborg M,Goddard T,et al. Long-term tillage,straw management and N fertilization effects on quantity and quality of organic C and N in a Black Chernozem soil[J]. Nutrient Cycling in Agroecosystems,2011,90(2):227-241.
[35]王保莉,岑 剑,武传东,等. 过量施肥下氮素形态对旱地土壤细菌多样性的影响[J]. 农业环境科学学报,2011,30(7):1351-1356.
[36]宋亚娜,林 艳,陈子强. 氮肥水平对稻田细菌群落及N2O排放的影响[J]. 中国生态农业学报,2017,25(9):1266-1275.
[37]Beauregard M S,Hamel C,Atul-Nayyar,et al. Long-term phosphorus fertilization impacts soil fungal and bacterial diversity but not AM fungal community in alfalfa[J]. Microbial Ecology,2010,59(2):379-389.
[38]Ramirez K S,Craine J M,Fierer N.Consistent effects of nitrogen amendments on soil microbial communities and processes across biomes[J]. Global Change Biology,2012,18(6):1918-1927.
[39]王光华,刘俊杰,于镇华,等. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报,2016,32(2):14-20.
[40]Jones R T,Robeson M S,Lauber C L,et al. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses[J]. The ISME Journal,2009,3(4):442-453.
[41]Mnnist M K,Tiirola M,Hggblom M M. Bacterial communities in Arctic fjelds of Finnish Lapland are stable but highly pH- dependent[J]. FEMS Microbiology Ecology,2007,59(2):452-465.
[42]钟 融,王培如,孙培杰,等. 长年耕作对北方旱作麦田土壤细菌群落结构及理化性质的影响[J]. 环境科学,2023,44(10):5800-5812.
[43]李文兴,郑曼曼,王 超,等. 亚硝化球菌属(Nitrososphaera)可能是酸性土壤硝化作用的重要驱动者[J]. 土壤,2021,53(1):13-20.
收 稿日期:2023-03-05
基金项目:宁夏自治区农业高质量发展和生态保护科技创新示范项目(编号:NGSB-2021-11-03);宁夏自然科学基金(编号:2021AAC03272)。
作者简介:李 磊(1991─),男,宁夏彭阳人,博士研究生,研究实习员,主要从事盐碱地改良利用及废弃物资源化利用。E-mail:lilei867@163.com。
通信作者:樊丽琴,硕士,副研究员,主要从事盐碱地改良与利用研究。 E-mail:fanlqnx@126.com。

