OPG过表达的ADSC对大鼠牙槽后槽骨缺损的修复作用
尹鹏 季于琪
[摘要]目的:探究骨保護素(Osteoprotegerin,OPG)过表达的脂肪间充质干细胞(Adipose-derived stem cell,ADSC)对大鼠牙槽后槽骨缺损修复的影响。方法:选择SD雄性大鼠38只,其中6只用于获得ADSC及ADSC OPG过表达转染,鉴定转染情况并观察不同ADSC的形态、成骨分化、成脂分化及增殖能力;其中8只作为对照组,另外24只建立牙槽后槽骨缺损大鼠模型,随机分为模型组、正常ADSC组和OPG过表达的ADSC组。6周后,Micro-CT扫描观察骨缺损愈合情况;苏木素-伊红(Hematoxylin-eosin,HE)染色观察骨缺损组织病理改变;免疫组化分析组织中碱性磷酸酶(Alkaline phosphatase,ALP)、骨钙素(Osteocalcin,OCN)的表达;Western blot分析组织中OPG/核因子-κB受体活化因子配体(Receptor activator of nuclear factor-κB ligand,RANKL)/核因子-κB受体活化因子(Receptor activator of nuclear factor-κB,RANK)通路蛋白表达。结果:携带空载体与OPG过表达慢病毒的转染效率分别为75.23%和79.08%;两种ADSC均为长梭形;OPG过表达ADSC中的OPG蛋白表达水平、增殖能力、成骨能力明显高于正常ADSC,成脂能力明显低于正常ADSC(P<0.05);与对照组相比,模型组的牙槽后槽骨缺损体积、RANKL、RANK蛋白表达水平明显升高,Lane-Sandhu组织学评分、ALP、OCN阳性表达率、OPG蛋白表达水平明显降低(P<0.05);与模型组相比,正常ADSC组获得与上述相反的结果;OPG过表达的ADSC组上述指标的变化幅度较正常ADSC组更显著。结论:OPG过表达的ADSC能够促进大鼠牙槽后槽骨缺损的修复。
[关键词]脂肪间充质干细胞;骨保护素;牙槽后槽骨缺损;大鼠;成脂分化能力;成骨分化能力
[中图分类号]R781.42 [文献标志码]A [文章编号]1008-6455(2024)03-0017-05
The Osteogenesis of ADSC with OPG Overexpression Has A Great Effect on the Posterior Alveolar Bone Defect
YIN Peng,JI Yuqi
(Department of Stomatology,Leshan People's Hospital,Leshan 614000,Sichuan,China)
Abstract: Objective To investigate the effect of adipose-derived stem cell (ADSC) overexpressed with osteoprotegerin (OPG) on the repair of posterior alveolar bone defects in rats. Methods Thirty-eight male SD rats were selected, of which 6 were used to obtain the overexpression of ADSC and ADSC OPG. The transfection was identified and the morphology,osteogenic differentiation,adipogenic differentiation and proliferation of different ADSC were observed. Among them, 8 rats were used as control group, and 24 rats with alveolar bone defect were randomly divided into model group, normal ADSC group and OPG overexpression ADSC group. Six weeks later, Micro-CT scan was used to observe the healing of bone defect in rats. The histopathological changes of bone defects were observed by hematoxylin-eosin (HE) staining. The expression of alkaline phosphatase (ALP) and osteocalcin (OCN) in the tissue was analyzed by immunohistochemistry. The expression of OPG/ receptor activator of nuclear factor-κB ligand (RANKL) / Receptor activator of nuclear factor-κB (RANK) pathway was analyzed by Western blot. Results The transfection efficiency of empty vector and OPG overexpression lentivirus was 75.23% and 79.08%, respectively. Both kinds of ADSC were fusiform. The expression level of OPG protein, proliferation ability and osteogenic ability in OPG overexpressed ADSC were significantly higher than those in normal ADSC, while the adipogenic ability was significantly lower than that in normal ADSC (P<0.05). Compared with the control group, the volume of posterior alveolar bone defect, the expression of RANKL and RANK protein in the model group increased significantly, while the histological score of Lane-Sandhu, the positive expression rate of ALP and OCN and the expression level of OPG protein decreased significantly in the model group (P<0.05). Compared with the model group, the normal ADSC group achieved the opposite results. The changes of the above indexes in the ADSC group with overexpression of OPG were more significant than those in the normal ADSC group. Conclusion ADSC overexpressed by OPG can promote the repair of alveolar bone defect in rats.
Key words: adipose-derived stem cell; osteoprotegerin; posterior alveolar bone defect; rats; adipogenic differentiation ability; osteogenic differentiation ability
口腔科骨代谢性疾病可导致大面积牙槽骨缺损,自体骨移植是目前治疗无法自我修复骨缺损的首选方案,但存在供区骨量受限、增加患者机体损伤等问题[1]。组织工程学的兴起和应用解决了上述不足,其中,干细胞是研究的重点[2-3]。骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSC)和ADSC是目前应用于口腔骨再生医学中的主要非牙源性干细胞,且ADSC是良好的种子细胞[4]。但单纯ADSC还不能达到理想的骨缺损修复目的。研究表明[5],通過基因工程技术对干细胞进行修饰,能够提高对骨缺损的修复效果。OPG主要由骨髓基质细胞和成骨细胞合成并分泌,属于肿瘤坏死因子超家族成员。有研究证实[6],OPG修饰的BMSC能够抑制破骨细胞活性,提高骨质疏松大鼠的骨密度。但目前鲜见关于通过OPG修饰的ADSC对骨缺损修复的影响的研究。本研究探讨OPG过表达的ADSC对大鼠牙槽后槽骨缺损修复的影响,为下一步的临床应用提供研究基础。
1 材料和方法
1.1 材料
1.1.1 实验动物:体重为(220±20)g的4月龄雄性SD大鼠38只,购自北京维通利华实验动物技术有限公司。喂养3 d,正常饮食、饮水。本研究经乐山市人民医院实验动物伦理委员会审核、批准(批准号:L1329-18)。
1.1.2 主要试剂及仪器:DMEM培养基、胎牛血清(美国Gibco公司);胰蛋白酶(美国Hyclone公司);pmirGLO表达载体(美国Promega公司);LipofectamineTM2000试剂盒(美国Thermo Fisher Scientific公司);吉姆萨染液、油红O染色试剂盒、BCA蛋白质测定试剂盒(上海碧云天);茜素红染液(北京Solarbio公司);碱性磷酸酶(Alkaline phosphatase,ALP)抗体、骨钙素(Osteocalcin,OCN)抗体、OPG抗体、RANKL抗体、RANK抗体(美国Abcam公司);3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)(上海康郎生物科技有限公司)。SZ51型光学显微镜(日本Olympus公司);IX73型倒置显微镜(日本Olympus公司);Micro-CT扫描系统(比利时Bruker公司)。
1.2 方法
1.2.1 ADSC的提取、分离培养及传代:颈椎脱臼处死6只大鼠,获取2 g腹部脂肪组织,PBS清洗,剪刀剪碎并置于离心管中,加入其2倍体积的0.075%的Ⅰ型胶原蛋白酶,37℃水浴震荡消化30 min,加入等体积的DMEM培养基(含10%胎牛血清),1 500 rpm离心15 min并弃去上清,用DMEM培养基重悬细胞沉淀并经细胞筛过滤。调整细胞浓度至1×106个/毫升,接种至装有DMEM培养基(含10%胎牛血清)的培养皿中,置于37℃、5% CO2的培养箱中培养,24 h后观察细胞形态,3 d换液1次,当细胞生长达80%~85%融合时进行消化传代,取第3代细胞用于实验。
1.2.2 OPG过表达ADSC的转染、筛选及验证:取第3代ADSC,用DMEM培养基重悬,以1×104个/孔的细胞数量接种于96孔板中,参照文献[7]并按照慢病毒转染说明书,将带有表达绿色荧光的空载体慢病毒液和OPG过表达载体慢病毒液加入96孔板中与ADSC混合,分别为正常ADSC和OPG过表达的ADSC。培养箱中培养24 h后,荧光显微镜观察细胞形态及绿色荧光强度,当转染率>70%时即为转染成功。Western blot分析进一步验证转染情况。
1.2.3 ADSC形态观察及增殖、分化能力的检测
1.2.3.1 细胞的形态观察:取对数生长期的细胞,胰酶消化,细胞涂片,甲醛固定,吉姆萨染色,PBS浸泡30 s,去离子水洗涤,晾干后在显微镜下观察(40×)并拍照。
1.2.3.2 细胞增殖能力的检测:取第3代ADSC,接种于6孔板中,细胞密度为6×104个/毫升,设置3个副孔,分别于细胞培养的第1、2、3、4、5、6、7天取3个副孔中的细胞,PBS洗涤,胰酶消化,10%血清培养液终止消化,显微镜下观察计数,每孔重复观察计数3次取平均值。
1.2.3.3 ADSC成骨分化能力的检测:取第3代细胞接种于6孔板中,密度为1×105个/ml,加入DMEM培养液培养,细胞融合至80%后,更换为成骨诱导液(胎牛血清10 ml+双抗1 ml+DMEM培养基89 ml+抗坏血酸50μmol/L+地塞米松100 nmol/L+β-甘油磷酸钠10 mmol/L)继续培养21 d,期间每3 d换液一次,采用茜素红染色法检测钙沉积情况。
1.2.3.4 ADSC成脂分化能力的检测:按上述成骨分化能力检测中的方法,将细胞培养至融合80%后,更换为成脂诱导液(胎牛血清10 ml+双抗1 ml+DMEM培养基89 ml+吲哚美辛0.2 mmol/L+地塞米松1μmol/L+胰岛素10μg/ml+IBMX 0.5 mmol/ml),每3 d换液一次,培养21 d后,采用油红O染色法检测脂肪囊泡的形成情况。
1.2.4 ADSC种植于明胶海绵:将大小为2 mm×2 mm×2 mm的无菌明胶海绵置于48孔板内,分别将正常ADSC与OPG过表达的ADSC接种于明胶海绵上,每孔1×105个细胞,体外培养3 d后进行后续实验。
1.2.5 大鼠分组及牙槽后槽骨缺损大鼠模型的制备
1.2.5.1 分组:将32只雄性SD大鼠随机分为对照组、模型组、正常ADSC组、OPG过表达的ADSC组,每组8只。每组中的2只大鼠用于Micro-CT扫描和病理学观察,3只用于免疫组化实验,3只用于Western blot实验。
1.2.5.2 牙槽后槽骨缺损大鼠模型的制备:模型组、正常ADSC组、OPG过表达的ADSC组大鼠按40 mg/kg的剂量腹腔注射2%的异戊巴比妥进行麻醉,术区消毒后,无菌条件下手术暴露大鼠牙槽后槽骨,使用牙科钻于上颌两侧后槽牙位置各造一个直径2 mm、深2 mm的圆柱形缺损[8]。模型组、正常ADSC组、OPG过表达的ADSC组大鼠双侧缺损内分别植入明胶海绵、明胶海绵与正常ADSC的复合体、明胶海绵与OPG过表达的ADSC的复合体;对照组大鼠未进行牙槽后槽骨缺损处理,不植入明膠海绵。
1.2.6 Micro-CT扫描观察各组大鼠牙槽后槽骨缺损区的修复情况:各组大鼠牙槽后槽骨缺损区植入明胶海绵6周后,麻醉并固定大鼠,采用Micro-CT对各组大鼠缺损区进行扫描,观察骨缺损区的愈合情况。
1.2.7 大鼠牙槽后槽骨缺损区组织病理学观察及评价:植入明胶海绵6周后,处死大鼠,分离获得手术区牙槽后槽骨标本,多聚甲醛固定,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片,脱蜡,水化,HE染色,脱水,二甲苯透明,中性树脂封片,显微镜下观察。采用Lane-Sandhu组织学评分[9]评价各组大鼠牙槽后槽骨缺损修复情况,包括连接、松质骨、皮质骨3个评价项目,每个项目0~4分,总分0~12分,评分越高提示骨缺损愈合情况越好。
1.2.8 免疫组化分析大鼠牙槽后槽骨缺损组织中成骨相关蛋白的表达:大鼠手术区牙槽后槽骨组织标本切片于65℃烘箱中烘烤过夜,二甲苯浸泡脱蜡,逆浓度梯度乙醇复水,去离子水洗涤,抗原高压修复,滴加3%的H2O2溶液,PBS洗涤,分别加ALP、OCN一抗,4℃孵育过夜,PBS洗涤,滴加二抗,37℃条件下孵育10 min,PBS洗涤,滴加二氨基联苯胺(Diaminobenzidine,DAB)溶液,显微镜下观察并控制染色时间,PBS洗涤,苏木素复染,0.5%氨水返蓝,脱水,透明,封片,电子显微镜下观察。
1.2.9 Western blot分析大鼠牙槽后槽骨缺损组织中OPG/RANKL/RANK通路蛋白的表达:RIPA缓冲液提取大鼠缺损牙槽后槽骨组织中的总蛋白,使用BCA蛋白质测定试剂盒测量蛋白质浓度。电泳,转膜,5%脱脂牛奶封闭,分别添加抗OPG、RANKL、RANK一抗,4℃下孵育过夜,加入辣根过氧化物酶偶联的二抗,37℃下孵育2 h,β-actin作内参。使用Gel Pro Analyzer 4.0对图像进行灰度识别。
1.3 统计学分析:采用SPSS 22.0进行统计学分析,作图软件采用GraphPad Prism 5.0。计量资料以x?±s表示,两组间比较采用独立样本t检验。P<0.05表明差异有统计学意义。
2 结果
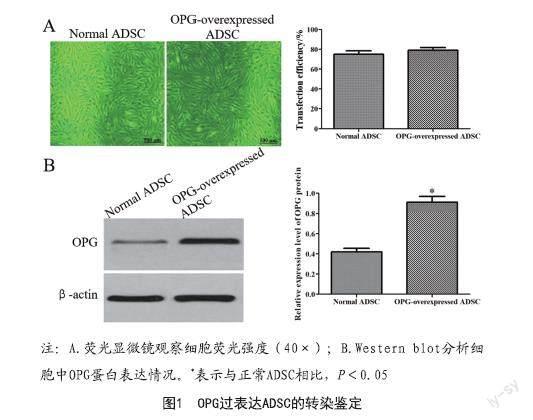
2.1 OPG过表达ADSC的转染鉴定:荧光显微镜观察发现,携带空载体与OPG过表达慢病毒的转染效率分别为75.23%和79.08%,见图1A。Western blot分析结果显示,OPG过表达的ADSC中OPG蛋白表达水平明显高于正常ADSC(P<0.05),见图1B。
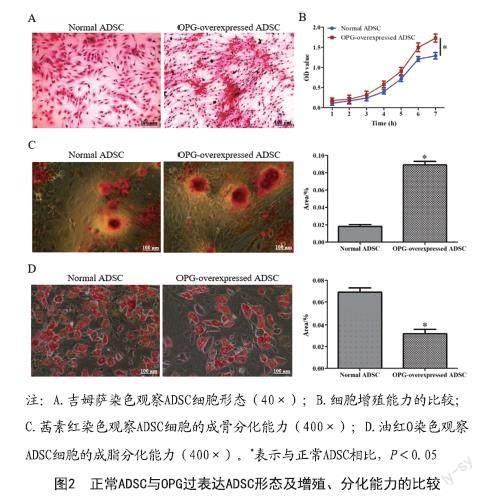
2.2 正常ADSC与OPG过表达的ADSC形态及增殖、分化能力的比较:正常ADSC与OPG过表达的ADSC均为纤维细胞样长梭形,细胞核明显,核质清晰;与正常ADSC相比,OPG过表达的ADSC增殖能力、成骨分化能力明显增强,成脂分化能力明显减弱,差异具有统计学意义(P<0.05)。见图2。
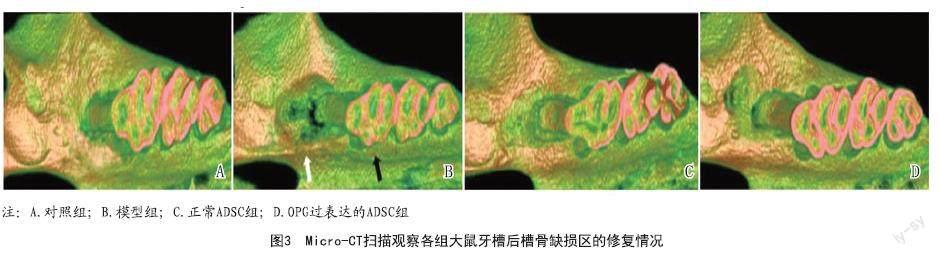
2.3 Micro-CT扫描观察各组大鼠牙槽后槽骨缺损区的修复情况:与对照组相比,模型组牙槽后槽骨缺损体积明显增加,与模型组相比,正常ADSC组的牙槽后槽骨缺损体积明显减小,OPG过表达的ADSC组的牙槽后槽骨缺损体积较正常ADSC组明显减小。见图3。
2.4 各组大鼠牙槽后槽骨缺损区组织病理染色结果的观察:HE染色结果显示,对照组上颌骨组织中的新生骨、新生血管及成骨细胞较为多见;模型组新生骨数量较少,可见大量的纤维结缔组织;与模型组相比,正常ADSC组可见明显的新生骨生成,但结构较为紊乱,且仍以编织骨为主,并附着大量的纤维组织,OPG过表达的ADSC组可见大量新生骨和部分新生血管,新生骨周围存在大量的成骨细胞,但新生骨结构仍较紊乱。与对照组相比,模型组的Lane-Sandhu组织学评分明显降低,与模型组相比,正常ADSC组的Lane-Sandhu组织学评分明显升高,OPG过表达的ADSC组的Lane-Sandhu组织学评分较正常ADSC组明显升高,差异均具有统计学意义(P<0.05)。见图4。
2.5 各组大鼠牙槽后槽骨中成骨相关蛋白表达水平的比较:与对照组相比,模型组大鼠牙槽后槽骨中的ALP、OCN蛋白阳性表达率明显降低,与模型组相比,正常ADSC组的ALP、OCN蛋白阳性表达率明显升高,与正常ADSC组相比,OPG过表达ADSC组的ALP、OCN蛋白阳性表达率明显升高,差异均具有统计学意义(P<0.05)。见图5。
2.6 各组大鼠牙槽后槽骨中OPG/RANKL/RANK通路蛋白表达水平的比较:与对照组相比,模型组的OPG蛋白表达水平明显下降,RANKL、RANK蛋白表达水平明显升高,与模型组相比,正常ADSC组的OPG蛋白表达水平明显升高,RANKL、RANK蛋白表达水平明显下降,与正常ADSC组相比,OPG过表达ADSC组的OPG蛋白表达水平明显升高,RANKL、RANK蛋白表达水平明显下降,差异均具有统计学意义(P<0.05)。见图6。
3 讨论
随着组织工程学的发展,干细胞移植修复骨缺损已成为目前医学界研究的热点,避免了自体骨移植来源不足及异体骨移植和骨替代材料移植受到种间差异限制等问题[10-11]。ADSC作为理想的种子细胞,具有多向分化潜能,通过移植至骨缺损组织并分化为成骨细胞发挥骨缺损修复的作用,但修复效果有限[5]。OPG能够抑制破骨细胞增殖活化,促进破骨细胞凋亡[12]。有研究发现[13],骨形态发生蛋白2过表达能够提高ADSC的增殖和成骨分化能力,促进颅骨大段骨缺损组织的愈合。还有研究证实[14],OPG修饰的牙周膜干细胞有利于其成骨分化,促进新西兰兔牙槽骨组织的再生修复。但目前关于OPG是否会增强提高ADSC的增殖及成骨分化的能力尚未明确。
在本研究中,OPG过表达ADSC中的OPG蛋白表达水平明显升高,表明ADSC中OPG过表达转染成功。此外,OPG过表达ADSC的增殖能力及成骨分化能力明显增强,成脂分化能力明显减弱,表明OPG过表达能够促进ADSC的增殖和成骨分化。目前关于通过OPG修饰的ADSC对骨缺损愈合的影响也尚未阐明。Song J等[15]的研究表明,凝血酶抑制剂通过上调BMSC中Wnt的表达,促进细胞增殖,并诱导BMSC的成骨分化,抑制牙周病模型小鼠的牙槽骨丢失,促进骨缺损的修复。在本研究中,牙槽后槽骨缺损模型大鼠骨缺损部位分别植入明胶海绵与正常ADSC的复合体、明胶海绵与OPG过表达ADSC的复合体6周后,骨缺损体积均明显减小,组织病理染色结果显示骨缺损区组织的成骨细胞数量及新生骨数量明显增加,且应用OPG过表达ADSC的改善效果更显著,表明OPG过表达ADSC能够促进大鼠牙槽后槽骨缺损组织的愈合。
成骨细胞和破骨细胞平衡被打破是牙槽后槽骨缺损及骨缺损后难以自主愈合的重要原因[16]。ALP、OCN与骨钙化相关,分别是成骨细胞分化成熟的早期标志和晚期标志物[17-18]。裘吉雨等[19]的研究结果显示,骨形成蛋白9过表达的人牙周膜干细胞能够明显增强大鼠牙周缺损区ALP、OCN的活性,增强干细胞的成骨分化能力,促进新骨形成,修复牙槽骨缺损。在本研究中,正常ADSC组与OPG过表达的ADSC组大鼠骨缺损区牙槽后槽骨组织中的ALP、OCN阳性表达率较模型组均明显增加,表明ADSC能够促进大鼠牙槽后槽骨缺损区新骨的形成,OPG过表达的ADSC组大鼠骨缺损组织中的ALP、OCN阳性表达率更高,提示OPG过表达能够促进ADSC成骨细胞分化,有利于骨缺损愈合。OPG是RANK的假性受体,竞争性阻断RANKL与RANK的结合,从而抑制骨吸收和骨破坏。OPG/RANKL/RANK是调节成骨与破骨偶联的信号通路[20]。在本研究中,正常ADSC组与OPG过表达的ADSC组大鼠骨缺损区牙槽后槽骨组织中的OPG蛋白表达水平较模型组明显升高,RANKL、RANK蛋白表达水平较模型组明显下降,且OPG过表达的ADSC组的改善作用更明显,表明OPG过表达的ADSC可能通过调节OPG/RANKL/RANK信号通路对大鼠缺损组织起到促进成骨和抑制破骨的作用。
综上所述,OPG过表达能够增强ADSC的增殖和成骨分化能力,抑制ADSC的成脂分化能力,OPG过表达的ADSC能够促进大鼠牙槽后槽骨缺损組织的愈合及新生骨形成,上调ALP、OCN成骨相关蛋白的表达,其作用机制可能与调节OPG/RANKL/RANK信号通路有关。
[参考文献]
[1]Chatelet M,Afota F,Savoldelli C.Review of bone graft and implant survival rate: A comparison between autogenous bone block versus guided bone regeneration[J].J Stomatol Oral Maxillofac Surg,2022,123(2):222-227.
[2]Chen L,Luo W,Wang Y,et al.Directional homing of glycosylation-modified bone marrow mesenchymal stem cells for bone defect repair[J].J Nanobiotechnology,2021,19(1):228-242.
[3]晋红敏.自体角膜缘干细胞移植术治疗翼状胬肉疗效分析[J].中国美容医学,2022,31(7):84-88.
[4]Di Stefano A B,Montesano L,Belmonte B,et al.Human Spheroids from adipose-derived stem cells induce calvarial bone production in a xenogeneic rabbit model[J].Ann Plast Surg,2021,86(6):714-720.
[5]Lu T,Peng W,Liang Y,et al.PTEN-silencing combined with ChABC-overexpression in adipose-derived stem cells promotes functional recovery of spinal cord injury in rats[J].Biochem Biophys Res Commun,2020,532(3):420-426.
[6]柏小金,黄文良,柏帆,等.骨保护素基因修饰的骨髓间充质干细胞治疗大鼠骨质疏松[J].中国老年学杂志,2019,39(13):3245-3249.
[7]Yu T,Chu S,Liu X,et al.Extracellular vesicles derived from EphB2-overexpressing bone marrow mesenchymal stem cells ameliorate DSS-induced colitis by modulating immune balance[J].Stem Cell Res Ther,2021,12(1):181-194.
[8]Boda S K,Wang H,John J V,et al.Dual delivery of alendronate and E7-BMP-2 peptide via calcium chelation to mineralized nanofiber fragments for alveolar bone regeneration[J].ACS Biomater Sci Eng,2020,6(4):2368-2375.
[9]张严,冯俊铭,谢磊,等.补肾方联合骨膜原位成骨治疗肾虚型大鼠股骨骨缺损的机制[J].中华中医药杂志,2021,36(9):5526-5531.
[10]Alonso-Alonso M L,García-Posadas L,Diebold Y.Extracellular vesicles from human adipose-derived mesenchymal stem cells: a review of common cargos[J].Stem Cell Rev Rep,2022,18(3):854-901.
[11]Bispo D S C,Jesus C S H,Correia M,et al.NMR metabolomics assessment of osteogenic differentiation of adipose-tissue-derived mesenchymal stem cells[J].J Proteome Res,2022,21(3):654-670.
[12]Gómez-Vaquero C,Martín I,Zacarías A,et al.Relation of the serum levels of dkk-1 and osteoprotegerin with bone mass in tightly controlled rheumatoid arthritis[J].Curr Rheumatol Rev,2021,17(1):101-108.
[13]Hsu M N,Yu F J,Chang Y H,et al.CRISPR interference-mediated noggin knockdown promotes BMP2-induced osteogenesis and calvarial bone healing[J].Biomaterials,2020,252:120094.
[14]Su F,Liu S S,Ma J L,et al.Enhancement of periodontal tissue regeneration by transplantation of osteoprotegerin-engineered periodontal ligament stem cells[J].Stem Cell Res Ther,2015,6(1):22-35.
[15]Song J,Jiang N,Gan X,et al.Thrombin inhibitor argatroban modulates bone marrow stromal cells behaviors and promotes osteogenesis through canonical Wnt signaling[J].Life Sci,2021,269:119073.
[16]Ha S H,Choung P H.MSM promotes human periodontal ligament stem cells differentiation to osteoblast and bone regeneration[J].Biochem Biophys Res Commun,2020,528(1):160-167.
[17]Liu F,Liang Y,Lin X.MiR-151b inhibits osteoblast differentiation via downregulating Msx2[J].Connect Tissue Res,2022,63(2):112-123.
[18]Bai Y,Zhang Q,Chen Q,et al.Conditional knockout of the PDK-1 gene in osteoblasts affects osteoblast differentiation and bone formation[J].J Cell Physiol,2021,236(7):5432-5445.
[19]裘吉雨,英司奇,劉湘,等.BMP9转染的hPDLSCs与HA-TCP支架复合体促进牙槽骨再生的实验研究[J].重庆医学,2020,49(17):2849-2856.
[20]Yang B,Li S,Chen Z,et al.Amyloid β peptide promotes bone formation by regulating Wnt/β-catenin signaling and the OPG/RANKL/RANK system[J].FASEB J,2020,34(3):3583-3593.
[收稿日期]2022-10-31
本文引用格式:尹鹏,季于琪.OPG过表达的ADSC对大鼠牙槽后槽骨缺损的修复作用[J].中国美容医学,2023,33(3):17-21,25.

