微生物发酵法合成虾青素的研究进展
周强,周大伟,孙敬翔,王靖楠,姜万奎,章文明,2,蒋羽佳,2,信丰学,2,姜岷,2
(1 南京工业大学生物与制药工程学院,材料化学工程国家重点实验室,江苏 南京 211816; 2 南京工业大学,江苏先进生物与化学制造协同创新中心(SICAM),江苏 南京 210009)
虾青素(astaxanthin)是一种橙红色的酮式类胡萝卜素,分子式为C40H52O4,化学名为3,3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素[1-2]。虾青素不溶于水,具脂溶性,易溶于苯、氯仿、丙酮和二硫化碳等有机溶剂,微溶于甲醇、乙醇等极性较大的有机溶剂[3]。虾青素是由8个异戊二烯单位组成的四萜烯类,以共轭双键连接,在共轭双键的末端存在不饱和的羟基和酮基[4]。因此,虾青素存在着不同的构型(图1),包括:左旋(3S,3'S),右旋(3R,3'R)和内消旋(3S,3'R)[5]。其中(3S,3'S)异构体是自然界中最常见的虾青素构型,也是抗氧化活性最高的构型,其次是(3R,3'R)和(3S,3'R)构型[6]。
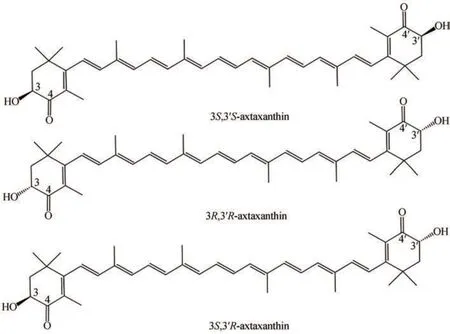
图1 虾青素的三种构型Fig. 1 Configurations of astaxanthin
虾青素应用价值非常高,其长共轭多烯烃链能够猝灭单线态氧,清除自由基,提高细胞的活性,对人体的脂质体起到保护作用,因此在一定程度上起到提高免疫力、抗衰老等效果。有研究显示,虾青素的抗氧化能力是维生素C的6000倍,是自然界报道中最强的抗氧化剂[7-9]。同时它可以预防大部分的氧化应激和相关的炎症,包括高血压、癌症、肥胖、心血管疾病、炎症性疾病、骨骼病、皮肤病等,因此可作为多靶点药物制剂[10]。例如,Lignell等[11]研究表明口服含虾青素的药物能够明显提升人体的肌肉力量以及运动耐力。虾青素还是天然的着色剂,以不同的构型存在于不同的物种中,赋予机体独特的颜色。鲑鱼肉质所呈现出的红色往往就给人一种视觉上的享受,使人轻易判断出食物的新鲜度以及风味。此外,虾青素还可以用于家禽饲料的添加,有研究指出在饲料中添加10 mg/kg的天然虾青素可以有效在肉鸭体内沉积,使活鸭的喙、掌呈现出健康的金黄色,同时也可提高肌肉脂质的氧化稳定性,使其营养价值更高[12]。虾青素还对环境植物起着保护作用,如虾青素喷雾剂可以增加葡萄叶的光合作用,提高葡萄叶的抗逆性,改变葡萄叶的色泽。因此,目前虾青素在医疗、化妆品、食品、饲料添加剂、保健品、农业等领域的应用与日俱增(图2)[13-14]。2017年全球类胡萝卜素市场估值为15亿美元,2022年已达到20亿美元[15]。而作为第二大类胡萝卜素的虾青素,它的全球市场价值预计到2027年将增长到近34亿美元[16]。
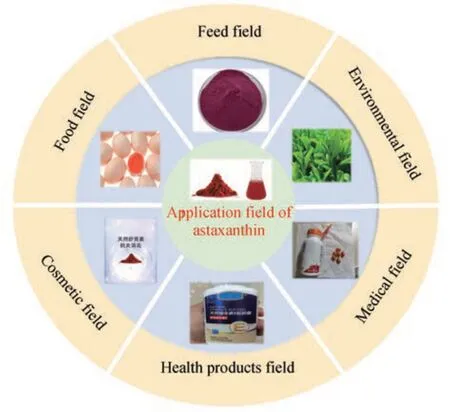
图2 虾青素的应用领域Fig. 2 Applications of astaxanthin
目前,生产虾青素的方法主要包括天然提取法、化学合成法以及微生物发酵法。天然提取法是从龙虾、螃蟹等甲壳类废弃物中提取虾青素,但产量极低、过程复杂、成本高昂,且提取过程易受污染,在经济上不可行[17-18]。化学合成法生产周期较长且过程复杂[19],合成的产物是多种构型混合的虾青素并且还积累多种副产物[20],在生物体内吸收利用率低于天然提取的虾青素,因此不被批准用于人类使用[19]。
随着合成生物学技术的不断发展,使用微生物发酵生产天然产物展现出巨大潜力[21-23]。利用微生物生产的虾青素具有构型明确、环境友好、副产物少等优点[16],因此,这是一种极具前景的虾青素生产方法[18,24]。目前用于发酵合成虾青素的微生物包括藻类、细菌、酵母等[25]。本文通过论述雨生红球藻(Haematococcus pluvialis)、大肠杆菌(Escherichia coli)、红法夫酵母(Xanthophyllomyces dendrorhous)、解脂耶氏酵母(Yarrowia lipolytica)等微生物生产虾青素的最新进展,总结了用以提高虾青素产量、降低成本的虾青素高产菌株的筛选与代谢工程改造策略。
1 虾青素的生物合成路径
虾青素的生物合成一般可分为3个阶段[10]:
第一阶段为中心碳代谢,生物体利用葡萄糖等碳源经糖酵解途径(Embden-Meyerhof-Parnas,EMP)生成丙酮酸(pyruvate)、乙酰辅酶A(acyl-CoA)等,它们作为萜类物质合成的前体物流向甲羟戊酸途径(mevalonate pathway, MVA)和甲基赤四醇4-磷酸途径(methylerythritol phosphate,MEP)途径。
MVA和MEP是虾青素合成途径中的第二阶段(图3)。MVA途径不仅可以提供萜类合成所需要的前体物,而且还可以提供细胞生长必需物质的前体物。其从乙酰辅酶A出发,经6步酶促反应生成异戊烯焦磷酸酯(isopentenylpyrophosphate,IPP),再通过异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI)将IPP异构化成二甲基烯丙基焦磷酸酯(dimethylallylpyrophosphate,DMAPP),最后以IPP和DMAPP为前体合成萜类物质的前体物。而MEP途径是另一条合成天然萜类物质的前体供应途径,广泛存在于细菌、真菌、植物和藻类中。该途径从丙酮酸出发,经7步酶促反应生成DMAPP,然后通过IDI将DMAPP异构化成IPP,最后以IPP和DMAPP为前体合成萜类物质的前体物。

图3 微生物合成虾青素的代谢途径Fig. 3 Metabolic pathways for astaxanthin synthesis by microorganisms
第三阶段为虾青素合成阶段,IPP和DMAPP在法尼基二磷酸合酶(fanicky diphosphate synthase)ispA的作用下生成香叶基焦磷酸(geranylgeranyl pyrophosphate,GPP)。GPP继续在ispA的作用下生成法尼基焦磷酸(farnesyl pyrophosphate,FPP),FPP在香叶基香叶基二磷酸合酶(geranylgeranyl diphosphate synthase)CrtE的作用下生成香叶基二磷酸(geranylgeranyl diphosphate,GGPP),GGPP在八氢番茄红素合酶/环化酶(phytoene synthase,lycopene cyclase)CrtYB和八氢番茄红素去饱和酶(phytoene desaturase)CrtI的作用下生成番茄红素,番茄红素在CrtYB的作用下生成β-胡萝卜素。β-胡萝卜素与虾青素的结构差异在于碳链两端环上的羟基与羰基的不同。因此,将β-胡萝卜素转化为虾青素的过程就是在β-胡萝卜素分子环上的两端补充羟基与羰基的过程。但在不同生物体内的合成路径会有所差异,例如在泛菌中,主要通过β-胡萝卜素酮醇酶(β-carotenoid ketolase)CrtW和β-胡萝卜素羟化酶(β-carotene hydroxylase)CrtZ来合成虾青素;在雨生红球藻中,主要通过β-胡萝卜素酮醇酶(β-carotenoid ketolase,BKT)和β-胡萝卜素羟化酶(β-carotene hydroxylase)CrtR来合成虾青素;在红法夫酵母中,主要通过CrtR和CrtS来合成虾青素;在其他一些工程酵母中,一般也都是通过表达β-胡萝卜素酮醇酶和β-胡萝卜素羟化酶来合成虾青素;夏侧金盏花是目前唯一可以生产虾青素的植物,它通过表达类胡萝卜素4-羟基-β-环-4-脱氢酶(carotenoids 4-hydroxyβ-cyclo-4-dehydrogenase,HBFD)和类胡萝卜素-β-环-4-脱氢酶(carotenoids-β-cyclo-4-dehydrogenase,CBFD)来合成虾青素。
2 虾青素合成底盘细胞
目前,通过发酵过程调控和代谢工程改造菌种仍是常用的提高微生物合成虾青素的策略。如:①通过发酵条件的优化提高微生物虾青素产量;②通过强化代谢路径中的MVA和MEP来提高前体物质的供应量;③筛选表达不同来源的关键基因;④模块化工程连接表达基因,增加其拷贝数;⑤定位不同亚细胞器等。
2.1 藻类
自然界中许多藻类都可以生产虾青素,如雨生红球藻、衣藻(Chlamydomonas)、伞藻(Acetabularia)、裸藻(Euglena)等[26]。雨生红球藻是一种淡水单细胞绿藻,其虾青素含量可达到细胞干重的5%,是虾青素生产的主要藻类,同时通过雨生红球藻生产的虾青素是抗氧化能力最强的左旋(3S,3'S)构型[27]。但是,雨生红球藻的生长周期长、培养条件要求高、需要光照,且虾青素存在于厚壁孢子中,提取率低、成本高、连续性差[19,28]。
雨生红球藻生产虾青素的高昂成本限制了其大规模应用,因此,迫切需要开发新的工艺,以实现通过降低生产成本和增加雨生红球藻中虾青素的含量来满足商业化应用的目的。雨生红球藻的生长需要光,但由于光生物反应器内部的光强分布和混合不均,藻类会受到光暗周期的影响,从而影响到生物量以及次级代谢物的产生。Ranjbar等[29]设计出气升式光生物反应器,相较于传统生物反应器,其液体循环呈现出更规则的流型,从而使反应器中光暗循环周期更稳定、液体混合更均匀,增加次级代谢物的产生,明显提升了雨生红球藻中虾青素的产量。
除上述策略以外,通过添加一些外源物质也是提升虾青素产量的可行方案。王想等[30]发现添加rac-GR24(一种合成的植物激素类似物)可有效增加雨生红球藻产生的生物量以及虾青素的积累量。rac-GR24能够提高植物的光合作用和增加碳水化合物合成中CO2的利用率,从而增加生物量的积累。同时它还促进NADPH和过氧化酶的过量生产,从而减轻活性氧造成的损害。此外,rac-GR24处理雨生红球藻还改变了脂肪酸生物合成以及虾青素酯化途径的活性,从而使虾青素的积累量增加。
由于藻类坚硬厚实的细胞壁增加了细胞的机械抗性和化学抗性,提取虾青素是藻类生产虾青素的最大挑战。传统的提取方法并不适用藻类虾青素的提取,因此黄文灿等[31]提出了一种利用可切换亲水性溶剂从雨生红球藻中提取虾青素的新方法。二甲氨基环己烷(DMCHA)作为一种可切换亲水性溶剂,具有低挥发性和低溶解性。利用它,无需蒸馏,只需同时加入水和CO2,就可使雨生红球藻中虾青素的萃取率达87.2%。
雨生红球藻富含天然虾青素、不饱和脂肪酸等,具有很高的研究利用价值[32]。同时国内外市场对天然虾青素的需求量日益上涨,其开发潜力巨大。但仍存在几个问题需探索解决:①雨生红球藻合成虾青素的中间代谢物转化、关键酶的表达调控需要进一步深入探索;②雨生红球藻由于细胞壁结构复杂,导致提取收率低,未来仍需开发新的提取工艺以降低生产成本。
2.2 酵母
自然界中天然生产虾青素的酵母主要有红法夫酵母、黏红酵母(Rhodotorula rubra)、海洋红酵母(R. benthica)以及深红酵母(R. glutinis)等。随着合成生物学的发展,基于基因工程构建的工程酵母也可以生产虾青素,如解脂耶氏酵母、酿酒酵母(Saccharomyces cerevisiae)、马克斯克鲁维酵母(Kluyveromyces marxianus)。相对于藻类等微生物而言,酵母生产虾青素的底物来源广泛、生长速度快、发酵周期短以及具有相对成熟的基因修饰工具。因此,酵母是目前虾青素工业化生产的最有潜力的底盘细胞之一。
2.2.1 红法夫酵母
红法夫酵母被认为是除雨生红球藻外,自然界中最适合生产虾青素的微生物[33-34]。其可利用多种糖作为碳源发酵合成虾青素[35],且细胞生长速度快,生长周期短,能够实现高密度培养,可显著降低生产成本[34,36]。同时生产的虾青素为右旋(3R,3'R)构型,易被人体吸收。因此,红法夫酵母成为合成虾青素理想的底盘细胞之一。表1为红法夫酵母产虾青素的最新进展。
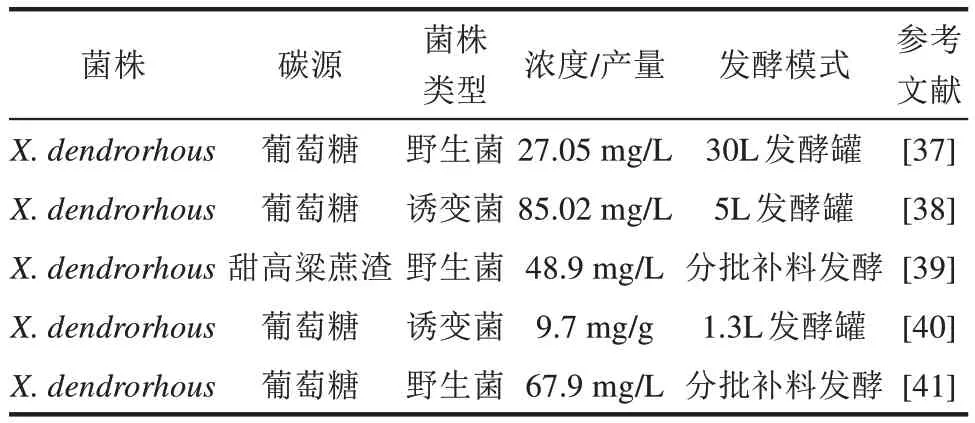
表1 红法夫酵母产虾青素进展Table 1 Progress in astaxanthin production by X. dendrorhous
发酵条件的优化是最容易、最直接的提高虾青素产量的方式。其中pH对红法夫酵母的细胞生长和虾青素积累均有影响。有研究表明,红法夫酵母细胞生长的最适初始pH为6.0,虾青素形成的最适pH为4.0,虾青素积累的最适pH为5.0[37]。因此,通过利用变pH的调控策略,红法夫酵母的虾青素产量比恒定pH发酵提高了24.1%。虾青素合成路径复杂,需要多种不同的底物和前体物参与,所以发酵过程中某些物质的添加也会促进虾青素的生物合成。例如,杨浩易等[42]以红法夫酵母为底盘细胞,发现嘌呤、嘧啶、氨基酸合成和糖酵解途径的下调均有助于虾青素的生物合成,脂质代谢途径的上调有助于虾青素的积累。原钒酸钠的加入可抑制氨基酸代谢途径,使虾青素产量增加19.2%;褪黑素的加入可促进脂质代谢,使虾青素产量增加30.3%。通过代谢通量分析,茹毅等[41]发现乙醇可以提高红法夫酵母细胞代谢中丙酮酸、乙酰辅酶A的含量,使流向虾青素合成途径的通量提高2.3倍,进而促进虾青素的合成。同时,对虾青素合成途径中α-酮戊二酸和5-磷酸核酮糖代谢节点进行调控,发现在培养基中加入0.5 g/L的α-酮戊二酸,可使红法夫酵母细胞生长量提高0.4 g/L。在培养基中加入3 g/L谷氨酸,虾青素的产量提高到67.9 mg/L,是对照组通量的1.7倍。
众所周知,酵母具有很强的代谢能力,不仅可以利用单糖、二糖、多糖、有机酸等小分子物质,还可以利用简单的氮源以及复杂的有机混合物。使用工业废料中的廉价底物可以有效降低虾青素生产的成本,如甘蔗渣、甜高粱蔗渣(sweet sorghumbagasse,SSB)等。庄媛等[38]对红法夫酵母菌株进行了常温及紫外线诱变研究,选育得到的突变株经在22 ℃和220 r/min下发酵甘蔗渣水解液96 h后,类胡萝卜素浓度达到88.57 mg/L;进一步采用超声波和纤维素酶破碎细胞壁后,虾青素得率达96.01%。Stoklosa等[39]以甜高粱蔗渣为碳源培养红法夫酵母生产虾青素,但由于SSB中的酚类化合物对红法夫酵母会产生抑制作用,于是通过活性炭和漆酶处理SSB来缓解其对红法夫酵母的抑制作用,最终使菌体的细胞干重从15.6 g/L提高到23.6 g/L,虾青素产量从9.55 mg/L提高到48.9 mg/L。
在合成生物学中,最常见的手段还是通过诱变以及代谢工程改造来提升目标产物的含量。Gassel等[40]通过随机诱变得到一株虾青素含量高的红法夫酵母,在其基础上,通过表达番茄红素环化酶基因crtYB以及虾青素合成基因ASY,进一步提高虾青素合成的通量,最后通过发酵罐放大实验,虾青素最大含量达到9.7 mg/g DCW。另外一项研究中指出,麦角甾醇的合成途径会反馈抑制MVA途径。因此,通过删除参与麦角甾醇合成的基因来改善萜类物质生产是一个有效的策略。Yomamoto等[43]依次删除编码与麦角甾醇生物合成相关的C-22甾醇去饱和酶的双CYP61基因后,通过发酵验证,重组红发夫酵母的虾青素产量提高了1.4倍。
虽然红法夫酵母是天然生产虾青素的底盘细胞之一,但野生型红法夫酵母产量低,且容易退化,实现大规模工业化生产仍存在一定的挑战。因此选育虾青素高产菌株就成了目前研究的首要目标。未来,通过诱变选育高产菌株、代谢工程改造,并结合培养基配方优化、发酵条件优化可进一步提高虾青素产量。
2.2.2 酿酒酵母
酿酒酵母是第一个进行全基因组测序的真核微生物,其遗传操作简便、基因表达调控机理清楚且高密度发酵技术成熟,特别是近年来一系列适用于酿酒酵母途径组装工具的开发,使得酿酒酵母成为合成生物学研究的理想底盘细胞[44]。但是和许多工程酵母一样,野生型酿酒酵母不能合成虾青素,需要通过基因工程改造,引入虾青素合成的关键基因,才能实现虾青素的合成,且合成的虾青素多为左旋(3S,3'S)构型。表2为酿酒酵母产虾青素的最新进展。

表2 酿酒酵母产虾青素进展Table 2 Progress in astaxanthin production by S. cerevisiae
不同物种的crtZ和crtW对酿酒酵母合成虾青素有显著的影响,因此外源合成虾青素基因和底盘细胞的匹配性尤为重要。王瑞兆等[45]对不同物种的crtZ和crtW在酿酒酵母进行组合表达,从30个组合中选择了来自泡囊短波单胞菌(Brevundimonas vesicularis)的crtW和来自产碱杆菌(Alcaligenes)的crtZ,得到的工程菌株SyBESc118076中虾青素产量高达81.0 mg/L。筛选关键基因的突变体也是提高虾青素产量的有效方法。例如,融合酶的构建可有效降低中间代谢物积累,在利用linker将crtW和crtZ融合的基础上,通过定向进化获得9个虾青素产量提高的融合突变体。组合这些显性突变体得到了高产虾青素的酿酒酵母菌株L95S+1206L,其虾青素含量是对照菌株的3.8倍[49-50]。为提高β-胡萝卜素向虾青素转化的效率,周萍萍等[46]通过定向协同进化获得crtZ和crtW的酿酒酵母优越突变体,同时引入基于Gal4M9的温度响应调节系统[51],将虾青素的合成与细胞生长进行解耦,即:第一阶段的温度保持在30 ℃,使细胞快速生长;当细胞生长进入对数中期,将培养温度改变为24 ℃,促进虾青素的合成;最后,通过两阶段高密度发酵合成了235 mg/L的虾青素。
由于虾青素是脂溶性的,这恰恰与酿酒酵母等模式微生物对脂类的有限储存能力相冲突[52],因此可以通过促进脂质合成来扩大脂滴,为虾青素的合成提供更多的储存空间,以提高虾青素的含量。于是李明等利用三功能CRISPR系统筛选了与脂质代谢相关的基因文库[47,53],通过适度上调opi3和hrd1的表达水平来促进脂质的合成,在平衡crtZ和crtW的表达后,使虾青素含量提高到10.21 mg/g DCW。最后,通过脂质合成的空间调控和温度响应的时间调控相结合,在补料分批发酵中合成了446.4 mg/L虾青素。
2.2.3 解脂耶氏酵母
解脂耶氏酵母是目前研究最多、应用最广泛的非常规酵母之一,通过解脂耶氏酵母生产的虾青素多为左旋(3S,3'S)构型。与常规酵母酿酒酵母相比,解脂耶氏酵母具有多种独特的生化和代谢特征。它是典型的二型性酵母,其作为一种好氧菌,基本不产生对细胞有毒害作用的乙醇[54];且胞内具有高效的乙酰辅酶A代谢通路和较高的三羧酸循环通量,脂质的积累量可达77%,这使其成为有机酸、脂质及其衍生物工业生产的理想选择[55-57]。此外,解脂耶氏酵母可以在较低pH值和较高的渗透压条件下生长,并且可以利用多种碳源、蛋白质和疏水性底物,如糖类、烃类、醇类、脂类等,因此其对生长环境要求不严格,可在各种环境条件下生长,具有良好的工业应用前景[58]。表3为解脂耶氏酵母产虾青素的最新进展。

表3 解脂耶氏酵母产虾青素进展Table 3 Progress in astaxanthin production by Y. lipolytica
不同来源的虾青素合成基因依然是影响解脂耶氏酵母中虾青素产量的关键因素。Kildegaard等[59]在一株高产β-胡萝卜素的解脂耶氏酵母菌株基础上,表达来自副球菌(Paracoccussp. N81106)的crtW和来自泛菌(P. ananatis)的crtZ,同时对相关基因的拷贝数进行优化,得到了3.5 mg/g DCW(54.6 mg/L)的虾青素;另一项研究表达3对不同来源的crtW和crtZ,指出来自雨生红球藻的HpCrtW和HpCrtZ转化β-胡萝卜素为虾青素的活性最强[65]。通过对RIAD-RIDD短肽对相关基因进行模块化组装[62],同时增加拷贝数到20后,在补料分批培养条件下,重组解脂耶氏酵母的虾青素产量达3.3 g/L,是迄今为止在微生物底盘中合成虾青素的最高水平。
在微生物中生产高附加值化学品的代谢调控手段大多是使用细胞质作为反应容器[66],然而,酶和底物的隔离以及代谢串扰经常阻碍细胞质中目标化合物的有效合成。真核细胞中细胞器的区域化为打破这一瓶颈提供了解决思路。例如,马勇烁等[60]通过将虾青素合成途径定位于内质网与过氧化物酶体,不仅加速了β-胡萝卜素向虾青素的转化,同时显著减少了类胡萝卜素中间体的积累,使虾青素产量提高141倍,在补料分批发酵中可合成858 mg/L的虾青素。
虾青素是一种脂溶性的萜类化合物,其强疏水性导致生物利用度较低。通过加入外源油相可以促进虾青素的溶解并防止晶体的形成,以此来增加虾青素的产量。Yuzbasheva等[61]通过模块化工程途径和两种关键酶的融合技术,构建了一株虾青素产量为587.3 mg/L的重组解脂耶氏酵母菌株,在添加油覆盖层的情况下,虾青素产量可提高到973.4 mg/L。糖基化也可以显著增加虾青素的水溶性,从而提高其生物利用度、光稳定性和生物活性[67-68]。陈靖等[63]通过在解脂耶氏酵母中表达来自夏侧金盏花的类胡萝卜素4-羟基-β-环-4-脱氢酶(HBFD)和类胡萝卜素-β-环4-脱氢酶(CBFD)基因,构建了一株植物来源的虾青素合成菌株,虾青素产量达到3.46 mg/L。在此基础上,通过表达来自菠萝泛菌(P. ananatisATCC 19321)的玉米黄素糖基化酶(CrtX)基因,成功构建了糖基化虾青素合成途径,其产量达到1.47 mg/L,是迄今为止报道的微生物生产糖基化虾青素的最高产量。
2.2.4 马克斯克鲁维酵母
近年来,马克斯克鲁维酵母广泛用于天然产物的合成。相比于其他传统酵母,其拥有以下几个优势:马克斯克鲁维酵母可以通过提供过量碳源提高菌体产量[69];一些马克斯克鲁维酵母耐高温,能在25~52 ℃的温度下发酵[70];具有适当的糖基化和较强的信号肽,与酿酒酵母相比具有较高的分泌能力[71]。
目前,基于代谢工程手段,马克斯克鲁维酵母已被用作底盘细胞合成虾青素,且合成的虾青素多为左旋(3S,3'S)构型。例如,林语聚等[72]通过在马克斯克鲁维酵母中构建虾青素异源合成路径,实现了利用葡萄糖合成虾青素。他们将来自雨生红球藻的Hpchyb和bkt基因整合到马克斯克鲁维酵母的基因组上,并增加其拷贝数,获得4株改造菌。为了进一步提高产量,对Hpchyb基因进行了定点突变,以提高酶效率和防止泛素化引起的异源蛋白降解,最终实现了在5 L发酵罐中合成9972 μg/g DCW虾青素。另外一项研究中,通过使用木糖诱导型启动子和温度调控系统,可实现将细胞生长与产物合成解耦;进一步通过对代谢路径以及发酵条件进行优化,虾青素产量达到56.8 mg/L[73]。虽然有关马克斯克鲁维酵母用作底盘细胞生产虾青素的报道较少,但其拥有的独特优势,为微生物发酵合成虾青素提供了新的技术选择。
2.2.5 其他酵母
除上述典型的工程酵母外,还有一些报道相对较少的生产虾青素的酵母,如黏红酵母、海洋红酵母等。黏红酵母作为一种含油脂的红酵母,主要用于生产β-胡萝卜素。有团队通过诱变筛选获得一株产虾青素的黏红酵母RG-31,最后通过优化发酵条件,虾青素含量达到7.41 μg/mL。海洋红酵母是海洋中自然存在的一种单细胞酵母,有较好的耐盐性,生产以虾青素为主的类胡萝卜素。一株高产类胡萝卜素的海洋深红酵母菌株S8,通过紫外诱变获得菌株ST5,并通过发酵条件优化,虾青素含量可达520 μg/g。
2.3 细菌
由于细菌合成虾青素的产量较低,因此国内外研究虾青素主要集中在藻类和真菌,对细菌合成虾青素的研究相对较少。尽管大多数细菌的虾青素含量远低于一些藻类及真菌,但通过在细菌中引入合成虾青素的相关基因[20],可以极大地提升虾青素的产量。同时相比于真菌和藻类,利用细菌发酵更容易提取虾青素,可大大简化后续的提取工艺。尤其是革兰氏阴性细菌,细胞壁薄易破碎,方便提取胞内的虾青素。因此,通过细菌发酵生产虾青素,可以大幅度降低虾青素的生产成本,对未来的工业化生产有重要意义。
2.3.1 大肠杆菌
大肠杆菌是一种革兰氏阴性、兼性厌氧细菌,培养方便、操作简单、成本低廉,且分子遗传改造工具成熟,已成为代谢工程和合成生物学的最佳宿主之一。它作为一种非类胡萝卜素产生菌株,能够通过MEP途径合成萜类化合物的前体IPP和DMAPP。在野生型的大肠杆菌中,其体内能够生成FPP合成酶,这种酶可以将IPP和DMAPP进行缩合反应,生成GPP和FPP,但缺乏将FPP转化为最终虾青素的酶类。因此通过向大肠杆菌引入外源的虾青素合成模块,就能较容易实现大肠杆菌合成虾青素,且合成的虾青素多为左旋(3S,3'S)构型。表4为大肠杆菌产虾青素的最新进展。

表4 大肠杆菌产虾青素进展Table 4 Progress in astaxanthin production by E. coli
虾青素代谢合成途径中关键基因的确定,为构建虾青素高产工程菌提供了可能。Jeong等[75]利用来自库克菌(Kocuria gwangallensis)MEP途径的dxs、ispC、ispD、ispE、ispF、ispG、ispH和idi和转化虾青素合成的相关基因(crtI、crtE、crtYB、crtW、crtZ)在大肠杆菌中进行共表达以增加虾青素的产量。这种含有非甲羟戊酸途径基因的工程大肠杆菌能够合成1100 μg/g DCW的虾青素。类异戊二烯途径中lytB、ispA和idi基因对IPP、DMAPP、FPP的合成必不可少,但由于大肠杆菌本身合成的这些前体物仅能满足自身生长,无法流向虾青素合成路径,所以造成虾青素产量过低。因此Lee等[76]在携带虾青素合成基因(crtI、crtE、crtYB、crtW、crtZ)的大肠杆菌中过表达lytB、ispA和idi,最终工程大肠杆菌合成1200 μg/g DCW的虾青素。筛选不同来源的crtW和crtZ依然是提升虾青素产量的常规方案之一。例如,鲁骞等[78]通过比较不同来源crtW和crtZ,认为来自短波单胞菌(Brevundimonassp. SD212)的crtW和来自泛菌的crtZ是生产虾青素的最佳组合。通过平衡crtW和crtZ的表达活性后,构建了一株既不携带质粒也不携带抗生素标记的大肠杆菌ASTA-1,在不添加诱导剂的情况下,重组菌株合成的虾青素占类胡萝卜素含量的96.6%,其含量达7.4 mg/g DCW。而吴元庆等[79]筛选9个不同来源的crtZ和crtW,并分别将其导入到高产β-胡萝卜素的工程大肠杆菌中,其虾青素含量达0.49~8.07 mg/L。随后,利用优化的肽连接物将crtZ与crtW进行融合,进一步增加了虾青素的产量,使虾青素产量增加了127.6%。李顺等[80]通过选用GadE启动子在大肠杆菌表达来自雨生红球藻的HpCHY基因和来自莱茵衣藻(Chlamydomonas)的CrBKT基因,最终工程菌株能够合成24.16 mg/L虾青素,比原始菌株增加了40倍。由此可见,选取合适的虾青素合成基因元件,会显著影响虾青素的表达含量。
增加关键基因的拷贝数是一种提升虾青素产量的简单、直接和有效的方式。例如,在大肠杆菌中,通过增加crtYB的拷贝数消除虾青素积累不足的瓶颈,同时通过调节操纵子的表达,最终在补料分批发酵条件下,虾青素的产量达到1.18 g/L[20]。李迪等[82]首先对crtW进行随机突变以提高其从β-胡萝卜素转化为虾青素的活性,再通过Cre-loxP的方法增加crtW和crtZ的拷贝数,构建出一株高产虾青素的大肠杆菌,最后通过补料分批发酵,虾青素产量达到0.88 g/L[84]。张梦等[83]发现来自马氏副球菌(Paracoccussp.PC1)的crtZ和来自泛菌的crtZ共表达可以提高虾青素以及中间体的积累量,最终构建具有两个拷贝数的PAcrtZ和一个拷贝数的PCcrtZ工程大肠杆菌菌株,经过70 h的补料分批发酵,虾青素产量达到1.82 g/L。
此外,也可通过非常规技术手段来提升虾青素代谢通路的策略,从而达到提高虾青素产量的目标。例如,通过在表达虾青素合成基因(crtI、crtE、crtYB、crtW、crtZ)的大肠杆菌中共表达伴侣基因ApcpnA和ApcpnB,最终工程菌能够生产890 μg/g DCW的虾青素[74]。Lemuth等[77]构建了第一个无质粒的大肠杆菌,通过γ-Red重组技术将虾青素生物合成途径的基因稳定整合到大肠杆菌染色体中,使该通路只指向虾青素合成。最终虾青素的含量达1.4 mg/g DCW[85]。基于形态学和氧化应激工程也是提高大肠杆菌虾青素合成的有效策略。如删除与形态、膜相关的基因,可以获得更大、更长的细胞,从而增加虾青素的积累。氧化应激是指细胞内活性氧产生与抗氧化之间存在不平衡,从而导致细胞损伤。因此删除氧化应激相关基因能够增加细胞内活性氧水平,达到保护细胞的目的[81]。同时温度升高后,细胞形态依然会发生变化,活性氧水平也将更高,所以通过建立温度敏感质粒的互补表达系统,最终能使这株大肠杆菌的虾青素含量提高至11.92 mg/g DCW。此外,酶定位策略也可以用来提升工程大肠杆菌中虾青素的产量。例如,叶丽君等[86-88]利用大肠杆菌定位标签将β-胡萝卜素裂解双加氧酶PhCCD1定位到不同的细胞室,发现其催化效率的最佳位置是在膜上,最终将CrtW和CrtZ通过GlpF蛋白融合定位到大肠杆菌细胞膜上后,虾青素产量增加了215.4%。
2.3.2 副球菌
副球菌(Paracoccussp.)是一种好氧、革兰氏阴性菌,其胞内含有虾青素以及其他稀有的类胡萝卜素,然而关于副球菌合成虾青素的研究论文还很少[89-90]。天然类胡萝卜素通常以E构型存在,人和动物对其利用率较低,而“Z-异构化”是提高其生物利用率的有效手段[91-93]。例如,Honda等[94]以副球菌为底盘细胞,在亚临界水条件下(将水加热至沸点以上,临界点以下,并控制系统压力使水保持为液态)异构化虾青素等类胡萝卜素,发现在加温加压条件下添加乙醇,“Z-异构化”的效率明显提升,最后,通过30 min的亚临界水处理,在抑制胡萝卜素降解的同时,获得了“Z-异构化”比例50%以上的虾青素。
适当调控培养基的组分以及发酵过程中的参数是提高虾青素产量的有效策略。在培养基中添加三羧酸中间体可增强前体供应量;还可通过添加虾青素合成关键酶的辅因子(硫酸亚铁、抗坏血酸、NADPH、ATP和2-氧戊二酸)以提升关键酶的活性,从而提高虾青素的积累。如在以副球菌为底盘细胞生产虾青素时,通过添加5 mmol/L的苹果酸盐和1 mmol/L的硫酸亚铁,可以提高Crt酶的活性,使虾青素的产量从177 μg/L增加到3750 μg/L[95]。虽然细菌自身合成虾青素与藻类和酵母相比产量较低,但这为后续的工程菌株的构建、改造提供了可供选择的基因元件。
2.3.3 其他细菌
能够生产虾青素的细菌相对较少,且产量相对较低,研究最多的就是大肠杆菌作为底盘细胞。除此以外,如乳酸分枝杆菌(Mycobacterium lacticola)和短杆菌(Bevibacterium)也都可以生产虾青素。但乳酸分支杆菌只在烃类培养基上生产虾青素,在营养培养基上并不生产虾青素。而短杆菌在石油里生长,发酵结束,菌体生物量仅有3 g/L,虾青素含量则更低。
综上所述,大肠杆菌是目前细菌中生产虾青素的理想底盘细胞。
3 虾青素的提取工艺
虾青素是胞内产物,因此从微生物中提取虾青素分为两个步骤:细胞的破坏和虾青素的收集。相较于细菌,藻类和酵母的细胞壁坚韧且厚实,不易破碎,给产物的提取带来了很大的困难。因此虾青素的提取重点在于细胞的破壁处理[96]。
传统的破壁处理方法主要有物理法、化学法、酶法等[97]。物理处理方法有机械破碎、超声波破碎和超临界流体萃取等。机械破碎操作简单,通过机械搅拌将细胞壁撕裂,从而释放细胞内的虾青素。但是机械破碎可能会引起部分位置温度过高,从而对虾青素造成一定的破坏;超声波破碎虽可以有效破除溶质中的细胞壁,但随着超声波作用强度以及作用时间的增加,产生的强氧化性自由基增多,从而导致虾青素的提取率下降,并且其还会产生一定的噪声污染[98]。超临界流体萃取是近年来各类藻产品提取中最有效的萃取方法,与传统液体溶剂相比,其具有一些专有的物理化学特性,如高扩散率、高压缩性、低表面张力、低黏度,易穿透细胞壁,提高产品提取效率。
化学法主要包括有机溶剂萃取法、酸碱处理法、二甲基亚砜法等。虾青素为脂溶性天然产物,因此有机溶剂的选择要考虑到虾青素是否可溶以及溶剂的极性。例如,邢涛等[99]以乙酸乙酯作为有机溶剂,从雨生红球藻中提取虾青素,最终其得率为98.51%。虽然利用有机溶剂提取虾青素得率较高,但不足之处是许多溶剂具有毒性,可能对虾青素产生破坏作用。酸碱处理法破壁会用到大量的酸碱试剂,不仅可能会造成对虾青素的破坏,还会对环境造成相应的污染。二甲基亚砜作为一种既溶于水又溶于有机溶剂的极性溶剂,成为实验室常用的破壁溶剂,能够快速高效地破碎菌体的细胞壁,并且不会对虾青素造成太大的影响[100],同时与丙酮以合适的比例混合,能够较为完全地提取虾青素[101]。
酶法提取虾青素具有条件温和、能耗小、耗时短等优点,它不仅可以快速高效地破除细胞壁,将胞内虾青素释放出来,而且可以抑制细胞的活性,从而防止胞内物质发生变性[102]。因此酶法提取的虾青素相比于其他方法获得的虾青素更加稳定。例如,β-葡聚糖酶能够水解细胞壁中的β-葡聚糖,可以避免虾青素溢出菌体减少损失[100]。但酶法需要大量的酶,这无疑增加了生产成本,同时由于酶的本质是蛋白质,易发生变性,因此并不适用于大规模虾青素提取处理。
由于虾青素是一种强抗氧化剂,如果长期暴露在空气中,空气中的氧气会与虾青素发生氧化反应,使其失去抗氧化能力。因此无氧(充氮)提取工艺也是目前工业生产上不可获取的步骤之一。该方法就是通过采用惰性气体或氮气填充,为有机溶剂萃取提供一个无氧环境,用以保护其活性,使虾青素的抗氧化活性显著提高。
4 总结与展望
由于虾青素在食品、医药和化妆品等领域的广泛应用,市场对虾青素的需求将可预见地增加。目前,化学合成法仍是虾青素生产的主要途径,但由于化学合成虾青素的局限性,世界各国对化学法合成虾青素的管理越来越严格。然而直接从自然资源中提取的虾青素远远不能满足消费者的需求。因此,通过微生物发酵生产虾青素为虾青素的工业化生产提供了有前景的选择。酵母由于底物谱宽、易于生长培养、发酵周期短以及具有相对成熟的基因修饰工具等优点,是最具发展潜力的底盘细胞。其中,红法夫酵母能够天然生产虾青素,生长速度快,可以利用多种碳源;解脂耶氏酵母具有较高的乙酰辅酶A通量以及三羧酸循环代谢通路,能够在较低pH和较高的渗透压下生长;酿酒酵母遗传操作简便、基因表达调控机理清楚且高密度发酵技术成熟;马克斯克鲁维酵母能够耐高温,具有适当的糖基化和较强的信号肽。
随着合成生物学、蛋白质工程、代谢工程和发酵工程的快速发展,许多微生物已被用作底盘细胞来生产虾青素。但尽管虾青素的生物合成已经取得了重大突破,却仍存在挑战:
第一,能够天然生产虾青素的微生物,如红法夫酵母、雨生红球藻依然存在产量低、培养条件严格、成本高等问题。为了解决这个问题,今后的研究方向应集中在高产菌株的培育和筛选、培养条件的优化上,以提高产量、降低成本。
第二,由于虾青素合成代谢通路复杂,因此通过代谢工程改造模式生物如大肠杆菌、解脂耶氏酵母、酿酒酵母等依然存在产量低等问题。对此,可通过如下策略提高底盘细胞合成虾青素的效率(图4):①对MVA代谢途径进行优化改造,如截短的tHMG(在N端截短500个氨基酸)被证明是MVA途径的关键基因,它可以有效地防止自身被降解,从而增加类胡萝卜素的产量;②更换不同强度的启动子,提高代谢路径中的催化匹配性,如在β-胡萝卜素生物合成的基因中,强启动子PTEF取代其他弱启动子显著提高了解脂耶氏酵母中β-胡萝卜素的产量[103];③增加关键基因的拷贝数,提高限速步骤的代谢通量,如当crtYB的拷贝数从1增加到4的时候,β-胡萝卜素产量增加了76%[104];④使用不同的连接子或者短肽,对关键基因进行模块化组装,提高碳代谢通量,以此来提高虾青素的效价;⑤定位于不同的亚细胞器中,提高虾青素的储存空间,类胡萝卜素一般储存在细胞膜中,会降低细胞膜的流动性,造成细胞的死亡,将类胡萝卜素的代谢路径定位于亚细胞器中,可以减少代谢紊乱,同时也可以扩大类胡萝卜素在细胞内的储存空间,减少其对细胞的毒性,如真核细胞中高尔基体、线粒体、过氧化物酶体具有独特的物理环境,可为类胡萝卜素的合成提供有利的条件;⑥发酵条件优化是最常规也是最有效提升虾青素产量的方式,例如,培养基中不同的碳源氮源、不同的碳氮比、pH值的优化、温度的调控等。
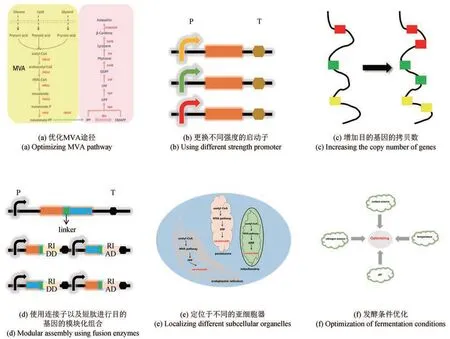
图4 虾青素产量提高策略Fig. 4 Strategies for increasing astaxanthin production
同时值得我们关注的是,即使通过生物合成的虾青素应用价值远超过化学法合成的,但其应用还是受到许多国家的法律法规所限制。如虾青素长时间加热会产生致癌物质,美国FDA禁止虾青素用作食品添加剂;法国明确规定虾青素只能用于特定的保健品和化妆品中。因此,通过微生物发酵生产虾青素还有很长一段路要走。

