人工调控受体聚集的化学合成生物学策略及应用
袁燕燕,陈慧芳,杨思慧,王洪辉,聂舟
(湖南大学,化学生物传感与化学计量学国家重点实验室,化学化工学院,生物学院,生物大分子化学生物学湖南省重点实验室,湖南 长沙 410082)
细胞膜受体是一种重要的膜蛋白,能够介导细胞内外环境之间的信号传递。受体通过其胞外结构感知胞外化学或物理刺激,随后将这一信号通过跨膜结构域传递并放大信号至细胞内,导致细胞做出相应的决策。在生理条件下,受体信号激活的稳态控制在细胞增殖、干细胞分化、伤口修复和免疫激活等生物学过程中发挥重要作用[1]。同时,膜蛋白受体的基因突变可能引起异常激活或抑制的细胞信号通路,参与癌症、糖尿病和动脉硬化等多种疾病的病理发生过程[2]。基于此,细胞膜受体已被广泛认为是免疫调节和癌症治疗的重要靶点。
细胞膜受体聚集是调控细胞信号转导的关键分子过程[3]。包括受体酪氨酸激酶(receptor tyrosine kinases, RTK)、整合素受体和免疫细胞受体(T cell receptor, TCR)在内的多种受体家族在受到细胞外刺激后,会经历从自由扩散的单体到流动性较低的纳米簇,再到高阶低聚物的转变[4]。最新研究表明,由多价分子之间弱相互作用驱动的液-液相分离(liquid-liquid phase separation,LLPS)可能是细胞膜受体组装成簇的一般物理化学机制[5-6]。在生理系统中,液-液相分离可以浓缩特定的蛋白质和核酸集合,形成生物分子缩合物,最终通过增加蛋白质结合亲和力和调节局部生物化学环境,来调控细胞内信号转导。因此,细胞表面受体聚集是精准识别细胞外信号和启动内部信号级联反应的关键分子机制。鉴于受体聚集介导的细胞功能与健康和疾病的广泛相关性,研究人员一直致力于探究细胞受体信号传递和激活的物理和化学机制,并基于相关科学机理开发多样的分子工程策略,用于操纵受体聚集激活和相关细胞功能(图1)。

图1 受体聚集调节下游信号Fig.1 Regulation of the downstream signaling by cell surface receptor clustering
在生理机制中,配体-受体相互作用是受体聚集激活的关键触发事件。信号配体作为细胞信号转导的第一信使,是传递环境刺激给细胞的关键生物化学物质。受体的天然蛋白配体主要包括细胞因子、生长因子和细胞外基质蛋白等[7-9]。这些信号配体通过旁分泌、内分泌和神经传导机制对靶受体发出刺激信号。细胞膜界面上发生的配体-受体的多价相互作用通过与细胞膜的流动性结合,促进细胞表面受体的重排和共定位,从而控制下游生物学效应。然而,天然配体存在多效性,可能与不同受体结合引起细胞信号,从而容易引起非靶向毒性等副作用,同时,基于天然配体的策略难以对细胞信号进行人工编程。因此,亟需开发基于理性设计的定制细胞受体聚集激活分子工程工具,使受体能够自主感知用户指定的刺激信号,实现对细胞的功能和命运精确调控。
随着合成生物学和细胞工程学的发展,基于基因工程的合成受体平台和嵌合受体已经成为一种有效的分子工程手段,已广泛用于实现对定制受体激活和下游信号转导的合成控制。Lim等[10]通过DNA重组技术,全新重构受体的细胞外传感器模块和细胞内转录模块,实现了对Notch信号途径的控制。他们通过合成Notch(synthetic Notch receptor, synNotch)途径可以在不同的哺乳动物细胞类型中驱动用户定义的生物学功能。Roybal等[11]近期报道了一种系统性策略,从头开始重新设计synNotch受体,开发了一类合成膜内蛋白水解受体(synthetic intramembrane proteolysis receptor,SNIPR)。这些受体是完全人源化且具有可定制的传感和转录能力,有效降低了原始synNotch受体免疫原性的风险,进一步拓展了合成受体在细胞疗法中的应用。
通过基因编码构建的合成受体,研究人员已经实现对新功能细胞的人工操纵,为医学带来了全新变革,揭示了一种实现精准和个性化细胞治疗的新途径。然而,基于合成受体的改造策略仍然存在一些固有挑战。例如,遗传改造可能会干扰体内其他内源性生物过程,而且难以保证受体的稳定表达以及嵌合蛋白结构的正确折叠[12]。此外,对独特的蛋白质模块进行基因编码,使其能够对用户定义的物理刺激(如光、磁场和热变化)产生响应仍然存在巨大的困难。为了弥补基因工程构建合成受体策略的不足,研究人员一直致力于开发非遗传调控受体聚集的新方法,集中解决以下三方面的问题:①精确控制受体聚集的纳米级分辨率,以控制细胞黏附、增殖、迁移和分化等细胞功能;②时空分辨的可控受体激活,以解析细胞信号转导的时间和空间复杂性;③高细胞选择性的受体聚集,以提高复杂环境中的靶向操控细胞的精确度。针对上述目标,多种模块化的分子工程策略已经被开发出来精准操控受体的聚集和激活,实现精准定制的细胞功能和命运。
1 受体聚集调控的功能元件
在合成生物学的大框架内,化学合成生物学方法为我们研究生命活动提供了一系列新颖有趣的视角。化学合成生物学涉及合成新生物大分子结构(如蛋白质和核酸)和最小生命形式(如半合成最小细胞)[13-14],旨在运用化学思维、理论、方法和技术手段研究生命现象和生命过程,并精准地识别、修饰和调控生命体系中的分子。与传统合成生物学的依赖于基因工程技术不同,化学合成生物学策略更强调化学分子结构和化学反应程序的理性设计和模块化操控原则。近年来,化学合成生物学充分发挥化学、生物学和医学的跨学科优势,为开发具有智能设计、易用性和高生物相容性的人工受体激活工程策略提供了重要功能元件和交叉融合技术。目前,基于化学合成生物学的受体聚集分子调控元件可以分为以下四个主要类型:①特异识别和结合受体的识别元件;②可编程的空间组织元件;③可重构的动态激活元件;④选择性受体操控元件。本文对这些不同功能元件的常用工具、设计原则和开发策略进行了归纳和总结(图2)。
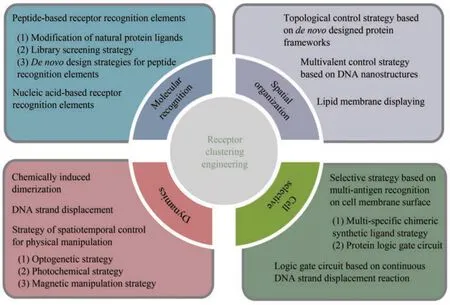
图2 受体聚集工程中的调控元件Fig. 2 Modules in the receptor clustering engineering
1.1 受体识别分子元件
人工受体激活的元件工程主要依赖于细胞表面受体的含量,因此开发能够特异识别和结合受体的识别元件是进行细胞受体操作的先决条件。目前,已经有多种成熟的识别元件可供选择,包括基于多肽类如抗体、工程化多肽和环肽等的受体识别元件,以及基于核酸类的特异性适配体识别元件。随着各种筛选技术的不断发展,受体识别元件的资源也变得越来越丰富,使人们可以更有效地制定受体聚集策略。
1.1.1 基于多肽类的受体识别元件
(1)天然蛋白配体改造策略
对蛋白质配体进行工程改造是一种直观而实用的方法,可得到具有改进或新功能的受体识别元件。改造配体可以产生与天然配体诱导的生物输出相似或不同的生物输出。目前,改造配体的研究主要集中于通过调整受体-配体复合物的稳定性、结合亲和力和/或几何形状等方式来获得具有调节下游信号输出和靶向特定细胞的新型结合配体[15-17]。改造配体的一般策略是通过定向进化实现的,这个过程包括随机诱变和/或基因重组生成多样化的变体库,进行多轮筛选,直到得到具有所需分子性质的突变体[18]。与自然进化以生存和繁殖为目标不同,定向进化采用更高的突变率和重组率去筛选所需生物功能。目前,应用该策略已经鉴定出了白细胞介素-2(interleukin-2, IL-2)[19]、干细胞因子(stem cell factor, SCF)[20]和促红细胞生成素(erythropoietin, EPO)[21]等细胞因子的合成突变体,这些突变体对其受体具有部分和偏倚的信号特性。改造配体根据其功能可以分为受体激动剂、拮抗剂或抑制剂,并且可以用作药物候选物以及研究复杂细胞功能的分子机制的化学工具。
(2)文库筛选策略
大多数天然配体都是由DNA序列编码的功能蛋白。随着各种蛋白质/多肽合成技术日趋成熟,人们已经筛选出了多种能够跟受体高亲和力结合的蛋白质/多肽。其中,单克隆抗体以其高度特异性、高亲和力和高稳定性成为靶向细胞表面受体的一种特别优越的识别元件。已有一系列针对RTK、人表皮生长因子受体-2(human epidermal growth factor receptor 2, HER2)和表皮生长因子受体(epidermal growth factor receptor, EGFR)的抗体在临床中进行了研究,有望运用于疾病治疗[22]。抗体筛选技术中,杂交瘤技术较为成熟。该技术首先将小鼠产生抗体的B淋巴细胞与骨髓瘤细胞融合,形成杂交瘤细胞,进而对其进行筛选和分离,鉴定并获得可产生单抗的细胞系[23]。尽管该技术可以生产大量单克隆抗体,但耗时长、样本消耗大和操作步骤烦琐限制了其使用。在20世纪80年代中期,各种抗体分子工程技术得到广泛应用,如噬菌体抗体库、核糖体抗体库、酵母表面展示和转基因小鼠,这些技术也成功地应用于单克隆抗体的筛选[24]。随着时间的推移,这些技术逐步推动了嵌合和人源化单克隆抗体的发展[25],从而显著提高了抗体的靶向效率并降低了其免疫原性。
近年来,工程多肽已成为一类极具潜力的受体识别分子元件,具有媲美抗体的选择性和亲和力,且尺寸较小,易于生产和修饰。氨基酸配方或化学修饰延长半衰期技术的突破,极大地促进了工程多肽在生物应用方面的发展。通过体内或体外展示技术,工程多肽配体的分子筛选取得了许多进展。例如,通过噬菌体展示和mRNA展示,研究者们已经筛选得到多种具有亚微摩尔亲和力的工程多肽配体[26],这些配体对靶标受体具有优异的亲和力和特异性。这些方法可以针对不同类型的受体进行设计和优化,实现更加精准的调控。此外,这些多肽配体可以直接靶向细胞表面受体,实现特异性治疗,也可以作为药物载体,搭载其他药物分子,提高药物的靶向性和生物利用度。
与线性的工程多肽相比,环状肽由于其可调控的刚性、稳定性和药代动力学特性近期受到特别关注。为了得到具有高亲和力的环肽配体,目前已经发展出多种筛选方法。与基于细胞表面展示的技术相比,随机非标准肽集成发现(random nonstandard peptides integrated discovery, RaPID)系统具有快速高效、可定制、适用于多种靶标、筛选范围广等特点[27]。该系统使用灵活的体外翻译系统制备随机肽库,并通过mRNA展示技术将表达的多肽与其同源mRNA融合构建肽-mRNA融合文库,最终筛选高亲和力的大环肽。此外,该系统还可用于大环肽的后修饰及功能分析,为开发更加有效的环肽药物提供了新思路。通过RaPID系统,Takagi等[28]已经从由1012个序列组成的随机序列库中筛选获得了针对各种靶蛋白的大环肽结合剂。
(3)多肽识别元件从头设计策略
定向进化技术以天然存在的蛋白质为基础,通过基因突变的方法产生新的结合蛋白变体。虽然这种方法功能强大,但难以改变起始蛋白的整体形状,通常只能对采样蛋白序列空间进行微调[29]。相对而言,基于计算生物学的从头蛋白质设计策略可以根据所需功能及精确几何形状裁剪出无限数量的蛋白质,得到具有预定结构和功能的全新设计配体,而且通常具有更优越的热变性和稳定性[30]。目前,蛋白从头设计的主要方法是基于Rosetta算法[31-32]。该算法通过参数化改变现有结构模板之间的相对几何形状来构建新的骨架,以设计螺旋束[33-34]或重复蛋白质[35]或通过从现有结构组装肽片段构建新的主干。基于Rosetta算法的从头设计往往需要在一定程度上依赖已知蛋白质的结构作为模板,然后通过改变其侧链和序列来实现特定的功能和结构。近期,研究报道了一种名为SCUBA(for side chain-unknown backbone arrangement)的统计模型,为无模板蛋白质设计工作提供了新的可能性[36]。它将侧链排列与主链的几何形状联系起来,从而可在主链结构空间中搜索侧链排列。通过这种方法,人们可以探索任意蛋白质主链结构,然后在此基础上填充序列,大大提高了从头设计蛋白质的结构多样性,同时也使蛋白质设计更加灵活。Baker等[37]已经从靶标结构开始从头设计了针对酪氨酸激酶(tyrosine kinase, TrkA)、血小板衍生生长因子受体(platelet-derived growth factor receptor, PDGFR)、EGFR、胰岛素受体(insulin receptor, IR)等受体的蛋白识别元件,结合亲和力最高能够达到860 nmol/L。进一步,Baker等[38]还开发了一种用于从头设计与目标蛋白表面高亲和力结合的环状多肽的通用计算方法“锚”扩展(anchor extension)。该方法利用已知能够与目标表面结合的分子中的一个特定官能团作为锚点,进一步通过引入额外的不同类型的相互作用来增强环肽与目标之间的结合力,从而实现灵活而高效的环肽设计。基于“锚”扩展方法,研究人员从头设计了组蛋白去乙酰化酶2(histone deacetylase-2, HDAC2)和组蛋白去乙酰化酶6(histone deacetylase-6, HDAC6)的结合配体。这些配体具有与许多酶抑制剂相媲美的高亲和力,并且在体外和体内都表现出很好的生物活性。
1.1.2 基于核酸类的受体识别元件
核酸适配体一直被视为抗体的合成替代物,可用作核酸纳米结构中的分子识别基序。各种类型的适配体已作为识别元件在生物分析中发挥重要作用。与抗体相比,适配体更加稳定,对还原条件和热变性更具有抵抗力。典型的适配体短于40个核苷酸,易于化学合成和高质量生产。短的寡核苷酸链通过折叠成独特的三级构象,使适配体能够通过包裹或配合目标分子的表面结构与目标分子相互作用[39]。核酸适配体的获得可以通过“指数富集配体系统进化”(systematic evolution of ligands by exponential enrichment, SELEX)技术进行筛选。这种技术利用受体的重组胞外结构域为配体,通过随机单链DNA文库进行筛选[40]。在此过程中,特异性的DNA序列与目标蛋白共同孵育富集,并在体外通过聚合酶链式反应进行扩增。经过多轮筛选和扩增,最终能够获得与目标受体具有高亲和力的适配体序列[41]。
另一种新兴的核酸适配体筛选方法是细胞SELEX技术。与蛋白SELEX技术不同,该适配体和受体在生理条件下相互作用并富集,使得筛选出的适配体能够更好地适应复杂的细胞环境。在这种策略中,研究人员直接使用单链DNA文库对受体过表达的活细胞进行筛选,经过几轮筛选和扩增,筛选出的适配体可以通过质谱等技术进行鉴定,从而确定其与目标分子的结合情况[42]。通过在生理条件下进行筛选,能够更好地模拟细胞内的环境,提高适配体的特异性和亲和力。因此,细胞SELEX技术在研究细胞和分子相互作用方面具有广阔的应用前景。
通过蛋白SELEX和细胞SELEX技术,目前已经成功筛选获得大量具有特异性识别细胞表面受体(RTK[43]、整合素[44]和TCR[45])的核酸适配体。基于单链核酸的分子特性,这些特异性和高亲和力结合受体的适配体元件具有多种优点,例如容易合成、高稳定性、容易定制化等,为基于核酸分子的受体聚集控制工程策略提供了优秀的分子识别模块。
1.2 受体聚集的空间组织元件
受体的拓扑结构分布对受体信号激活至关重要,理想的受体操作工程应该能够以纳米级分辨率精确控制受体的空间排列,并具有高度的可编程性。因此,需要开发可编程的受体空间组织元件,从而灵活控制细胞表面受体聚集的纳米尺度空间组织,使其执行复杂和协调的功能。目前,常用的四种策略包括:基于从头设计蛋白框架的拓扑控制策略,通过从头设计蛋白框架,精确地控制蛋白质分子的结构和构象,使其能够精准地识别目标受体;基于DNA纳米结构的多价控制策略,利用双链DNA纳米结构的特异性识别能力,通过控制受体在DNA结构表面上的分布实现对受体的空间控制;基于流动脂膜展示的工程策略,利用脂质流动膜上修饰的特异性配体的空间排列,精确控制受体分布;基于水凝胶的立体空间控制策略,通过与特定水凝胶支架排布的配体空间相互作用控制受体聚集激活(表1)。
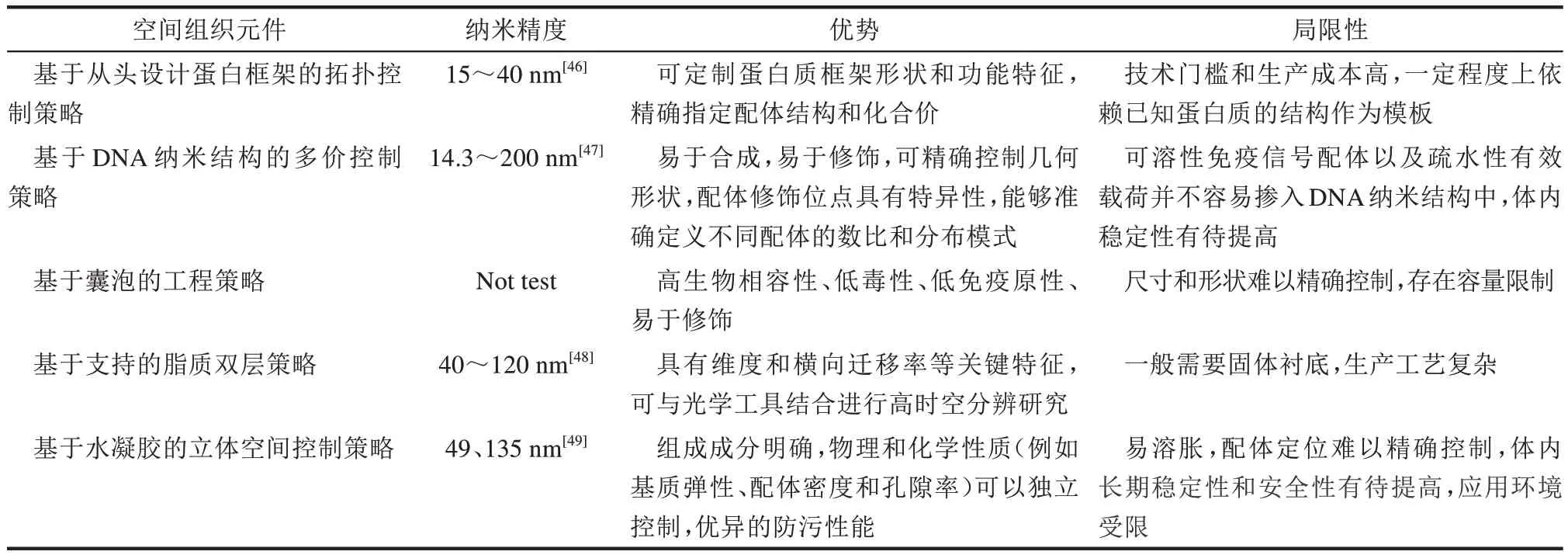
表1 受体聚集空间组织元件的纳米精度比较Table 1 Comparison for the spatial organization elements of cell surface receptors at of nanometer scale
1.2.1 基于从头设计蛋白框架的拓扑控制策略
虽然许多人工蛋白质/多肽可以直接作为替代细胞因子配体,但普遍缺乏对单体之间精确几何结构或距离的灵活控制。随着蛋白质从头设计技术的发展,人们能够将多个蛋白质域组合在一起,通过控制它们之间的相对位置和角度,或通过设计蛋白质分子间的相互作用,使之形成特定的二维、三维结构,实现对受体空间分布的精确控制。
Baker和Garcia等[50]基于蛋白质结合支架技术(designed ankyrin repeat protein scaffold, DARPin)创造了一个自组装的、刚性连接的二聚体支架。该支架能够精确控制二聚体复合物中受体胞外结构域的相对方向。通过DARPin激动剂的角度和距离参数的系统变化,他们成功实现了在造血的特定阶段诱导红细胞生成素受体(erythropoietin receptor, EPOR)信号部分和偏向激动。近期,Baker等[46]报道了一种蛋白笼策略,构建了精确几何形状和组成的多价位抗体型蛋白质纳米颗粒[图3(a)]。该策略通过将抗体Fc结合蛋白、单体螺旋连接体和环状低聚物三种类型的“构件”蛋白硬性融合,成功地创建了包括二面体、四面体、八面体和二十面体在内的8个抗体纳米笼结构。与游离抗体或Fc融合蛋白相比,这些针对细胞表面受体的抗体纳米笼表现出增强的受体聚集信号转导。
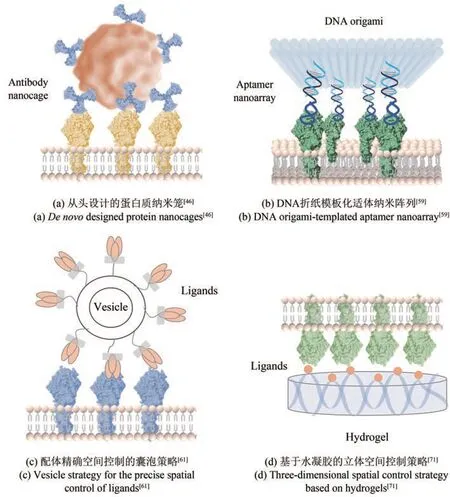
图3 受体聚集的空间组织元件Fig. 3 Spatial organization elements of cell surface receptor clustering
1.2.2 基于DNA纳米结构的多价控制策略
DNA分子具有Watson-Crick碱基配对特异性和可预测性,使其成为一种强大的可编程分子材料,用于设计高空间分辨率的纳米结构[51]。DNA杂交双链的碱基配对序列依赖性和高选择性杂交赋予它精确的编码特性。因此,DNA分子的自组装特性能够以高度可控、可寻址和功能化的方式制造DNA纳米结构。基于DNA架构的多价控制和尺寸控制已成为空间组织元件设计的一种更加简单易行的方法。由于每个寡核苷酸链在纳米结构中的位置都是通过设计已知的,因此可以修改特定的单条链,使纳米结构具有特定的功能[52]。这一特征使得DNA纳米结构能够充当具有特定价态、间距和化学计量比的生物分子的空间图案,从而精确地重编程细胞表面受体的纳米级分布和几何形状。
受遗传重组过程中的天然可移动Holliday连接的启发,1982年Seeman[53]首次使用不可移动的四臂连接构建DNA复合体,并设计了具有双交叉的刚性DNA块以及多臂基序。此外,利用不同的DNA“瓦片”作为构建块可以制造更多复杂的DNA纳米结构,包括一维纳米管、二维阵列,甚至三维结构[54]。同时,DNA折纸策略利用病毒DNA M13mp18(一种含有7249个核苷酸的单链DNA)以及数百条短链,形成具有明确形状的离散纳米结构,如正方形、三角形和立方体[55]。值得注意的是,Yin等[56]提出了单链瓦片自组装策略(single-stranded tile, SST),并从含有四个域的单链DNA“瓦片”中构建了复杂的二维DNA晶格。此外,DNA纳米结构构建方法还被扩展到具有任意三维形状的各种复杂离散结构,例如球壳和纳米管等[57]。
通过将可控数量的所需识别元件定制的DNA链插入DNA纳米结构中,不仅可以准确量化配体的数量,还可以人为定义不同配体的数比和分布模式,以实现纳米级受体的化学计量和空间控制[58]。基于DNA折纸结构,研究者们已经开发了具有精确ephrin-A5配体定位的“纳米卡尺”[47]以及具有可定义的化学计量、化合价适配体的DNA折纸模板适体纳米阵列(DNA origami-templated aptamer nanoarray, DOTA)[59][图3(b)],成功实现了对EphA2受体、肝细胞生长因子受体(Met)空间聚集控制。这些工作表明,基于DNA纳米结构的配体展示非常有希望以定制的纳米尺度分辨率调节受体,从而提高我们对配体-受体介导的信号通路机制的理解。
1.2.3 基于流动脂膜展示的工程策略
基于流动脂膜界面展示的工程策略也是一种常用的方法。流动脂膜包括天然或人工产生的囊泡以及支持的脂质双层(supported lipid bilayer,SLB)。囊泡是生物活性分子的重要载体,具有高生物相容性、低毒性、低免疫原性等独特优势,常用于基因和药物递送领域[60],被广泛认为是下一代治疗载体。值得注意的是,囊泡还具有易于表面工程化的优势。通过在囊泡表面修饰特异性配体,不仅可以实现靶向特定细胞或器官,还能用于促进靶标细胞膜受体的聚集[图3(c)],调控细胞信号传递和细胞表型[61]。研究者通常使用转染、逆转录病毒或慢病毒感染细胞,为囊泡配备靶向肽或抗体,进而实现其对特异性受体的靶向结合和激活。例如Kuroda等[62]将PDGFR的跨膜结构域,融合了与EGFR靶向肽的序列,从而使囊泡可与EGFR受体特异性结合。相对而言,化学修饰是更加简单而有效的方法,可以通过共价键、PEG衍生物、点击化学技术和利用连接酶等修饰将配体或药物锚定在囊泡表面[63]。相比于遗传修饰方法仅能在囊泡展示蛋白质或肽,化学修饰技术适用于所有类型的分子,例如核酸适配体[64],更具有广泛的应用范围。
由于囊泡的尺寸和形状难以精确控制,研究者还开发了人工SLB策略,它是在平面玻璃基板上自组装的仿生磷脂膜。作为一个简单的细胞膜模型系统,SLB不仅囊括了细胞膜的关键特征,如维度和横向迁移率。通过先进的光学工具,研究者还可以对细胞膜表面的反应进行高时空分辨率的探究[65]。研究者通过掺入功能化脂质的可控部分来对SLB组成进行修饰,进而精确控制在界面处固定多种配体和受体,实现对细胞膜受体聚集分子过程的解析[66]。例如,研究人员已经应用SLB策略探究了人乳腺癌细胞的膜受体EphA2与修饰ephrin-A1配体的SLB的相互作用过程和生物学意义[67]。最近,Wind等[48]通过在SLB平台上合理控制修饰配体簇的金纳米粒子的几何定位,揭示了配体分布的横向和纵向几何距离对TCR聚集激活的控制。该方法不仅能够研究受体-配体相互作用,还能指导与配体密度和细胞免疫相关的细胞行为。
1.2.4 基于水凝胶的立体空间控制策略
水凝胶是通过共价键或非共价相互作用形成的三维交联分子网络,组成成分明确,并且可以独立调节基质弹性、配体密度和孔隙率等物理和化学性质[68]。因此,水凝胶已成为一种新兴的工具,可用于影响立体空间内的细胞受体聚集状态,操控细胞命运和行为。研究表明,整合素受体(例如α3β1[69])、细胞膜结合糖蛋白(例如CD44[70])和受体酪氨酸激酶(例如DDR1[71])等可以与特定水凝胶支架排布的配体空间相互作用,控制神经细胞或者肝脏上皮样细胞的命运[图3(d)]。进一步,Bian等[72]构建了基于纳米凝胶的刺激响应动态调节器,研究了两种模型配体的近端共表达对干细胞受体激活的潜在协同作用。此外,基于水凝胶的受体空间控制策略可以有效分离基质刚度和表面化学的影响。Ding等[49]将Arg-Gly-Asp(RGD)肽以明确的纳米阵列形式共价结合到聚乙二醇水凝胶表面,独立考察了细胞黏附配体的基质刚度和纳米级空间组织对受体激活诱导的干细胞分化的影响,结果显示基质刚度和细胞黏附配体的空间分布都是干细胞微环境中独立且有效的重要调节剂。
1.3 受体聚集动态控制策略
配体诱导的受体激活是一个高度动态和有序的分子过程。开发可重构的动态激活控制元件,能够通过用户定义方式可逆地控制受体的状态。为了实现对受体聚集形成的动态调节,研究者们发展了多种方法,包括化学诱导二聚(chemically induced dimerization, CID)和基于DNA链取代反应的时间控制模块。这些策略可以通过控制化学反应的时间和空间位置,实现受体聚集的动态调控。此外,物理操作技术,如光调控、磁场调控和电场调控等方法也可用于时空分辨的受体操控。
1.3.1 化学诱导二聚策略
化学诱导二聚系统(CID)已经成为了一种细胞工程的重要的工具,被用于高度亚细胞定位和高度时间分辨的目标分子操纵[73]。该技术为在有限区域内动态激活特定受体信号分子提供了有效路径,也为研究特定生物学过程创造了新的可能性。在一个典型的CID系统中,添加化学二聚体后,诱导的二聚体可以通过增加某个细胞亚结构中蛋白质的有效浓度,使两个先前分散的蛋白质化学诱导接近[74]。这个过程可以用于激活或控制生物事件,例如细胞的增殖、分化和死亡。1993年,Crabtree等[75]提出了由小分子引发的化学诱导二聚的概念,当FKBP与小分子配体结合后,FKBP通过二聚将其所连接的蛋白质聚集在一起。为了减少非靶向效应和改善生物相容性,研究者们已经开发出多种正交蛋白/小分子对,大大扩展了小分子响应的化学诱导二聚工具包[76],如Lim等[77]使用了FKBP结构域和FKBP-雷帕霉素结合结构域(FRB*)的T2089L突变体,成功控制了合成嵌合抗原受体(chimeric antigen receptor, CAR)的聚集[图4(a)]。此外,CID系统的反应时间通常在几秒钟到几分钟之间,这种快速响应特性使得CID技术被广泛应用于细胞信号转导、基因转录和蛋白质定位等生物过程。最新的研究显示,在同一细胞区域内可以同时整合多个CID系统,用于多个受体响应不同输入信号分子的调节操控[73]。
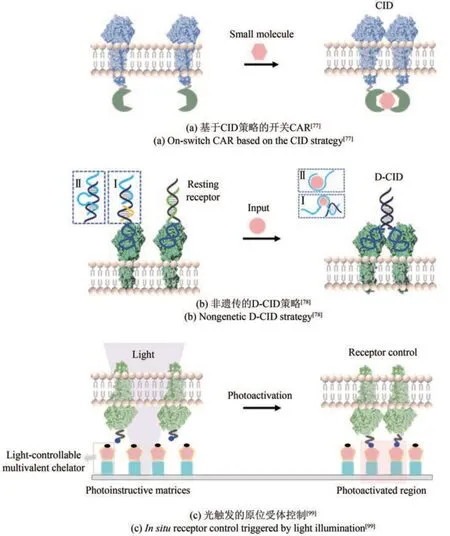
图4 受体聚集动态控制策略Fig. 4 Dynamic control strategies for cell surface receptor clustering
化学诱导二聚策略在调控受体方面具有巨大潜力。然而,目前大多数基于CID系统的受体操控仍需要利用基因工程技术重组嵌合蛋白受体。本文作者课题组[78]首次提出了一种非遗传的DNA介导化学诱导二聚化(DNA-mediated chemically induced dimerization, D-CID)策略,实现了小分子诱导的细胞受体激活[图4(b)]。该策略使用DNA适配体和DNA酶作为动态模块,在细胞表面构建DNA纳米器件功能化的嵌合受体,并通过触发DNA链置换以进行受体二聚化并实现化学响应。这种方法不需要基因工程,相对于传统CID方法更简单实用。同时,D-CID的模块化设计具有优异的灵活性,可定制响应不同小分子的细胞行为。该策略对现有CID体系进行了进一步拓展,有望成为基于细胞的治疗和再生医学中智能调节细胞行为的新途径。
1.3.2 基于DNA链取代反应的动态控制元件
DNA链取代反应是实现动态控制最常用的策略之一。通过多层DNA杂交以及链取代反应的可控控制,目前已经构建了许多核酸化学反应网络,用于实现各种功能。DNA链取代反应本质上是一个由自由能差异驱动的DNA重新杂交的过程。典型的链取代反应是由立足点介导的,反应从立足点开始,长的单链DNA置换出一条或多条短的预杂交DNA单链,重新互补配对形成更稳定的双螺旋结构[79]。通过改变立足点的空间位置、序列长度和碱基组成,链置换反应的速率可以在超过6个数量级的范围内变化[80]。
另一种链取代方法是基于构型熵差异特性。如果反应中产物的数量大于反应物的数量,由于构型熵的增加,则链取代反应依旧可以向前驱动[80]。另一种有效方法是构建浓度不平衡体系。例如:邻近诱导的链取代反应[81],其原理是通过亲和力相互作用使多个DNA序列相互接近,从而使竞争序列的局部浓度大幅度增加,驱动链取代反应发生,最终产生可检测的DNA序列或信号。邻近诱导的DNA链取代经常被用作产生靶标依赖的检测信号和/或减少靶标无关背景的关键机制。
基于DNA分子的可预测性、可设计性和可编程性,多个链取代反应可以组合成级联,从而构建更为复杂的DNA回路,并且通过轻微改变输入和输出DNA链就能实现反应高度可控[82]。基于动态DNA链取代反应,研究者们已经成功使用从简单的双链DNA互补配对[83]到复杂的DNA杂交链式反应(hybridization chain reaction, HCR)组装[84]、可逆构象开关[85]等动态DNA回路,对蛋白酪氨酸激酶7(protein tyrosine kinase 7, PTK 7)、Met、CD20、TCR等多种细胞表面受体聚集进行了调控。因此,DNA链取代反应为受体聚集提供大量动态控制模块,实现了可逆受体聚集的精准控制。
1.3.3 时空分辨控制的物理操控方法
为了将细胞受体激活相关的形态变化与复杂的生物过程联系起来,通常需要使用高时空分辨率的动态纳米工具来控制所涉及的生物分子。由于非侵入性、高时空分辨率和低毒副作用的优势,近年来,物理操控方法(如光、电、超声波或磁场)在受体聚集调控方面取得了蓬勃发展。这些方法可以通过控制外部物理场的强度、频率、位置和时间等参数,实现对受体的精确调控,从而探索细胞信号传递和生物学过程的机制。
基于光的化学反应可在极短时间内发生,并且可以以剂量依赖的方式实现时间和空间的精确调节。近年来,基于光反应的工具已经成为实时调节细胞过程的有效手段,催生了光遗传学和光化学系统等光学技术。光遗传学通过蛋白质工程将基因编码的光敏蛋白定向地表达在特定的细胞类型或亚细胞结构中。改造后的光传感器和光开关能够吸收300~800 nm范围内发射的光子,使相关的发色团异构化并诱导蛋白质的整体构象变化,从而将用户定义的光刺激转换为定制的功能输出[86]。最经典的光敏蛋白是微生物通道视紫红质蛋白-2(channelrhodopsin-2, ChR2),研究人员在2005年首次将其用于控制神经元活动[87]。此外,研究人员已经发现越来越多基因编码的光敏蛋白,并将相关光遗传学工具模块详细归纳在OptoBase网络数据库中[88]。随着光敏蛋白工具包的不断拓展,光遗传学技术已经被广泛用于对感兴趣的蛋白质进行可编程的操作,包括光诱导的蛋白质多聚化、蛋白质-蛋白质异源二聚化、蛋白构象转换和蛋白靶标解离等[89]。
光化学方法具有体积小、对反应改动需求小以及适配不同生物系统的优点,已被广泛用于寡核苷酸[90]、蛋白质/多肽[91],小分子(如细胞信号分子[92]、荧光剂[93]和二聚体化学诱导剂[94])等各种生物分子的光调控。这种技术的关键元件是笼状基团[95-96]。这些基团能够暂时阻断活性分子与生物伴侣的相互作用,并且以非常高的时空分辨率进行光解,从而局部释放生物活性分子。此外,光活化工具已经与细胞器靶向结合,有助于在预先确定的位置研究各类细胞信号事件。使用模块化的“点击”方法还能直接将笼状基团组连接到靶向支架,克服了为每个细胞器合成特定的笼状化合物的局限性[97-98]。利用光化学策略,生物学家们已经实现了对细胞信号转导通路中的关键受体分子的精准调控[99][图4(c)]。
磁场近年来已经成为一种新型的具有时空分辨率的细胞受体调控工具。磁场可以对顺磁性粒子施加力的作用,但在其他方面却是生物惰性的。同时,磁刺激能够穿透深处的组织,进而对生物体内各种过程实现非侵入式的动态探测。基于磁性材料的细胞功能远程激活需要三个主要组成部分:磁场、磁性致动器[例如,磁纳米粒子(单核或簇)或铁蛋白]以及在细胞水平激活的靶分子[100]。在控制细胞功能方面,磁性致动器通常以机械激活或热刺激两种方式发挥作用。例如许多研究都使用了磁性微粒子和技术(如磁镊子或牵引力显微镜)探究机械线索对生物过程的影响[101]。磁性致动器也能用于磁热刺激,激活与温度敏感蛋白相连的细胞内通路[102]。通过精确地调制磁刺激的各种参数,可以对样品施加广泛的力,从而实现对细胞和组织的非接触式时空控制。总的来说,磁刺激可以通过远程的、无创的方式刺激生物体内的目标区域,从而为动态控制细胞表面受体聚集状态提供了新的途径。
1.4 细胞选择性受体聚集元件
针对复杂的细胞环境,有必要开发细胞选择性受体激活元件,缩小目标细胞亚群的范围,从而提高细胞靶向控制的精度。近年来,多种新颖的分子工程元件已经被开发出来用于提高受体激活的细胞选择性。基于细胞膜表面多抗原识别的选择性策略通过识别特定的细胞标志物组合来实现特异性识别和响应。基于连续DNA链取代反应的逻辑门控回路则通过精确的DNA分子序列,在细胞膜表面实现特定的逻辑运算,从而定制细胞受体信号响应,提高选择性。
1.4.1 基于细胞膜表面多抗原识别的选择性策略
(1)多特异性嵌合人工配体策略
通过抗体将免疫调节有效载荷精准输送到肿瘤部位是增加细胞因子治疗效用的常用方法之一。基于抗体的特异性结合,这种方法可以将免疫调节剂针对性地运输到肿瘤组织,从而减少对健康组织的不良影响。为了提高配体的靶向选择性,研究者们开发了抗体-细胞因子融合策略。该策略通过蛋白质工程将信号配体与细胞特异性表面抗原相融合,实现细胞特异性调控。Reisfeld等的研究开发了抗体与白细胞介素、干扰素和肿瘤坏死因子(tumor necrosis factor, TNF)等多种有效载荷的融合策略[103]。这些融合构建体在体内全身给药后,可以选择性靶向人肿瘤部位。此外,Neri等[104]还报道了双细胞因子-抗体融合策略。他们将协同细胞因子组合白细胞介素-2/白细胞介素-12(IL-2/IL-12)以多种构型与抗体(或抗体的Fc部分)进行连接,成功实现更高的肿瘤特异性靶向。
近期,Garcia等[105]报道了一种用于生成双特异性抗体激动剂的模块化策略。该方法首先使用靶向不同受体或靶向同一受体不同表位的小型抗体结构域模块化“混合和匹配”创建二聚体配体库,随后,通过高通量筛选得到多样化的细胞因子替代激动剂。由于配体库仅限于与靶标受体有生物化学验证结合的模块,该方法可以得到具有明确活性归属的配体,并且,该方法还可以人为定制自然界不存在的异二聚体。这使得它有望成为生成多特异性配体的通用化学平台,提高受体聚集工程的细胞选择性。
(2)蛋白质逻辑门控回路
多特异性嵌合人工配体策略旨在通过同时接触多个目标实现选择性,但该方法需要微调单个受体结合的亲和力,以减少背景信号。蛋白质从头设计和蛋白质工程的快速发展允许人们在细胞表面构建调节任意蛋白质-蛋白质相互作用的逻辑门,从而通过表面标志物的组合直接对细胞通路进行选择性控制。
Baker等[106]从头构建了氢键网络介导的特异性蛋白质异二聚体,并通过竞争性结合的方式成功设计了两输入和三输入的蛋白质逻辑门。进一步,该研究小组从头设计了一种名为Co-LOCKR(colocalization-dependent protein switches)的共定位依赖性蛋白质开关[107][图5(a)]。该开关由“笼”蛋白、“锁”蛋白和效应器蛋白三部分组成。最初,“笼”蛋白通过“闩”结构域将功能肽隔离,只有配套的“笼”蛋白与“锁”蛋白通过靶向结构域共定位在表面上时才会产生相互作用,引起构象变化,激活Co-LOCKR并结合相关效应器蛋白。该方法能够在细胞表面执行与门、或门、非门逻辑运算,从而通过不同的结合相互作用进行细胞选择。近期,他们报道了一种新设计的IL-2模拟物(Neo-2/15),该模拟物可分裂成两个片段,组合后通过激活IL-2Rβ和IL-2Rγ来实现免疫刺激功能[108]。将这些片段分别融合到靶向HER2和EGFR受体的相关抗原上时,分裂片段能够表现出共定位依赖性的激活,并将IL-2Rβγ高选择性地募集到双阳性HER2+/EGFR+细胞表面。

图5 受体簇的细胞选择性人工激活Fig. 5 Cell-selective artificial activation of the receptor clusters
基于蛋白质从头设计的逻辑门回路往往涉及到复杂的多蛋白质系统。相比之下,直接设计单个蛋白质能够实现更简单、更严密的逻辑调节和靶向控制。Dokholyan等[109]开发了直接集成两个正交、两个输入逻辑门作为调节开关的单个蛋白质系统。通过结合化学遗传学和光遗传学方法,他们成功建立了一个双输入逻辑或门,用于控制黏着斑激酶的激活。这项工作揭示了通过两个输入和一个功能位点的变构连接,单个蛋白质可以直接被编程为以功能位点为输出的蛋白质逻辑门,从而实现蛋白质功能的精细化调控。
1.4.2 基于连续DNA链取代反应的逻辑门控回路
基于细胞膜表面多抗原识别的选择性策略往往需要大量的蛋白质工程。而DNA分子可以通过直接插入或结合细胞膜上的分子,方便地装配到细胞表面,为设计细胞表面逻辑门控回路提供了更为便捷的途径。DNA智能逻辑运算基于严格的Watson-Crick碱基互补配对原理,通过连续DNA链取代反应组合形成智能运算电路来执行各种算法和任务。将几个逻辑门组合在一起还可以构建执行更高级别功能的多层数字电路,如平方根和1位全加法器电路[110]。近年来,已经报道了许多基于DNA的逻辑系统,这些系统大多包含两个独立的组件:负责逻辑功能的寡核苷酸和负责监测逻辑器件状态的外在报告者。这些组件在系统中紧密结合,从而实现复杂的逻辑运算和信息处理功能。2006年,Seelig等[111]使用单链DNA作为输入和输出成功构建了基于链置换的各种DNA数字逻辑电路,如与门、或门、非门、信号复位操作、信号放大、反馈和级联数字逻辑电路等,为DNA计算在生物技术和生物工程中的应用开辟了道路。自此以后,基于DNA的逻辑门控回路已经越来越多地用于控制生物相关过程。
通过利用DNA的智能逻辑运算能力,研究者们已经成功地构建了各种核酸分子设备,用于选择性调控细胞行为和功能。这些设备可以应用于多个领域,例如癌细胞分离[112-113]、蛋白质二聚化可视化[114]和探索细胞间相互作用[115]。本文作者课题组[116]基于细胞表面受体上的DNA逻辑门,成功构建了一种能够特异性识别多种蛋白组分的“扫描-解锁”智能DNA分子自动机(“scan and unlock” DNA automaton system, SUDA)。该系统由一个DNA锁定元件(用于保持蛋白质配体不活跃),多个DNA识别元件(用于标记特定细胞表面蛋白质),以及一个基于DNA的“扫描和解锁”动态元件组成。通过智能的布尔逻辑运算,该机器能够精确分析细胞膜表面的多种蛋白组分,最终实现从五种类型的细胞中精准激活靶细胞的受体信号通路[图5(b)]。
2 受体聚集调控的工程策略
近年来,化学合成生物学的研究聚焦于构建人工生物系统,并应用于生物医学、生物工程、材料科学等多个领域。其中,人工操控受体聚集和信号激活是化学合成生物学中的重要研究方向之一。研究人员通过研究不同的功能模块,已经开发出多种可用于实现受体聚集和信号激活的元件。为了更好地实现受体调控,研究人员基于化学合成生物学原理提出了多种受体调控的元件工程策略。这些策略包括基于相分离的受体激活元件工程、空间组装激活工程、响应性聚集激活工程、时空分辨调控工程和细胞选择性激活工程。通过整合多种优势功能元件,这些工程策略可以有效地实现受体调控,并为人工生物系统的构建提供了重要的技术支持。
2.1 基于相分离的受体激活元件工程
研究表明,许多内源性细胞膜受体通过多价驱动的液-液相分离(liquid-liquid phase separation,LLPS)进行激活调节[5]。利用LLPS的稳健性和多功能性,研究者们设计了基于LLPS的工具来精确操纵受体聚集。Li等[117]利用相分离在亚宏观层面上实现了可视化的细胞膜蛋白与膜受体的时空调控。他们通过融合多价模块化相分离支架蛋白对和受体结合剂构建了膜锚定依赖的相分离系统。相分离支架蛋白对与受体结合剂结合后被拉到细胞膜表面,导致其局部浓度显著提升,进而通过多价相互作用形成相分离,介导细胞表面受体酪氨酸激酶、死亡受体和趋化因子受体多聚激活。近期,Veatch等[118]设计了膜相分离驱动的受体信号结构域响应性组装的纳米级信号平台,并通过超分辨率纳米显微镜定量测量聚集后B细胞受体(B cell receptor, BCR)出现的膜结构域。结果显示,这些结构域根据它们对液体有序相的偏好来富集和保留膜蛋白,并且BCR簇处的膜组成可以通过簇中的蛋白质成分和膜的整体组成进行调节,进而影响BCR活化的幅度。
2.2 受体空间组装激活的元件工程
细胞表面受体聚集本质上是一个受体动态组装的过程。因此,通过在分子层面上精确地控制受体的组装,可以有效控制细胞内信号传递。Suga等[119]构建了大环肽二聚策略。他们通过RaPID系统筛选得到了对Met具有强亲和力的大环化合物。这些大环化合物通过适当的交联剂进行二聚化后,成为了有效的受体寡聚激动剂,能够特异性地激活Met相关的下游信号转导途径。最近,Baker等[120]报道了一种有生物活性的二元蛋白质二级结构的计算方法。该方法可以设计出刚性接口,将两个二面角形的蛋白质单元相互连接,并自组装为微米级二维p6m晶格阵列(六边形蜂窝状)。通过对蛋白质组件功能化,并重新配置它们的对称性,阵列能够形成表面可控的配体结构,从而诱导细胞表面受体空间组装。类似地,本文作者课题组[59]报道了一种基于DNA折纸的受体控制策略,成功构建了DOTA。该技术通过在纳米尺度上排列单价适配体或二价适配体来精确编程RTK受体的寡聚反应,实现了可定义的化学计量、化合价和细胞行为切换间距的控制[图3(b)]。
2.3 受体响应性聚集激活元件工程
响应性受体聚集激活元件工程是一种强大的开关工具,可在人为定义的条件下操控细胞受体以实现所需功能。通过化学诱导二聚,研究者们构建了许多具有独特响应激活特性的基因工程嵌合受体。例如:Lim等[77]开发了一种小分子诱导的CAR用于T细胞行为调控。该方法将传统CAR分成两个物理分离的多肽,只有当存在异二聚小分子试剂时,这些多肽才能重新组装,激活T细胞[图4(a)]。近期,Wang等[121]构建了对pH和ATP等多种环境输入具有响应性的DNA纳米器件。该器件使用pH响应的i基序和ATP结合适配体作为响应单元,通过在细胞表面构建与门来选择性地组装Met和CD71受体,从而调节HGF/Met信号转导。
2.4 受体聚集时空分辨调控元件工程
时空分辨的受体聚集激活工程策略通过引入空间定位元件和/或时间响应元件等手段,实现对受体聚集和激活的精确时空控制。其中,最具代表性的是光控受体聚集激活工程策略。Tampé等[99]开发了一种基于氨基三乙酸/组氨酸标签(trivalent nitrilotriacetic acid/His tag,trisNTA/His tag)光活化相互作用对,用于实现光诱导神经肽Y2激素受体(neuropeptide Y2 receptor, Y2R)聚集。在这个方法中,多价螯合剂头trisNTA首先被分子内His6标签灭活。随后,该系统在光活化时原位捕捉His标记的受体,在细胞膜上快速产生不同大小、位置和密度的受体组装[图4(c)]。磁致动为时空分辨控制细胞受体提供了一种新的策略。近期,Cheon等[122]将磁性纳米颗粒与靶向结直肠癌(deleted in colorectal cancer, DCC)受体的抗体共轭,利用非侵入性的外部磁刺激,实现了对目标细胞受体在特定空间位置的精准操控。
2.5 受体聚集的细胞选择性激活元件工程
细胞选择性的受体聚集激活工程策略可以针对特定类型的细胞或组织实现精准激活控制。Rosenblum等[123]通过基因重组开发了TNF和识别人黑色素瘤细胞上gp240抗原的单链抗体的融合蛋白。基于抗体的靶向性,融合蛋白可以在人黑色素瘤异种移植物中精确定位,实现选择性的靶向治疗。近期,Liu等[124]构建了由细胞内源性分泌物驱动的细胞选择性受体簇调控(selective manipulation of receptor clustering, SMARC)策略。该策略由识别CD20受体的可伸缩DNA纳米结构“EDNS-CD20”和识别并结合血管内皮生长因子(vascular endothelial growth factor, VEGF)的“VEGF放大器”两部分组成。当“VEGF放大器”识别到细胞分泌的VEGF时,释放出一条信号链驱动“EDNS-CD20”纳米结构中的重复发夹结构单元收缩,并导致相应CD20受体簇聚集。通过SMARC策略,能够选择性地诱导淋巴瘤Raji细胞上的受体聚集(图6)。
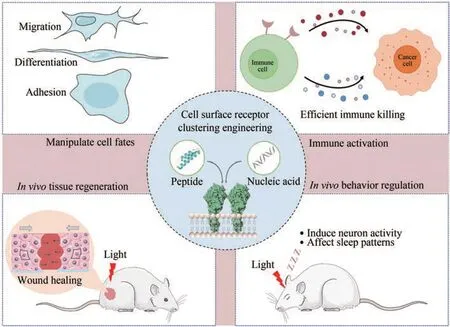
图6 人工调控受体聚集的生物医学应用Fig. 6 Biomedical applications for the artificial regulation of cell surface receptor clustering
3 人工调控受体聚集的生物医学应用
细胞表面受体聚集在包括增殖和分化在内的多种细胞活动中发挥关键作用。此外,多种受体具有再生作用和免疫调节活性,控制其聚集在再生治疗和免疫治疗领域中也具有重要意义。因此,以用户定义的方式操控细胞表面受体聚集不仅可以提高人们对细胞决策机制的理解,还能使细胞执行期望的生物医学功能(图6)。
3.1 细胞行为调控
细胞表面受体的调节可以用于活化特定细胞信号通路,进而影响下游细胞表型和命运,如细胞增殖、迁移和分化。其中,RTK受体是介导细胞迁移行为的关键细胞表面受体家族。当RTK受体发生聚集,其下游信号蛋白发生磷酸化转导,进而调节细胞骨架的结构和功能,影响细胞的迁移和浸润行为[4]。在2016年,Sando小组[125]创新性地提出二聚体RTK结合适配体能够模拟诱导RTK二聚的天然配体,成功激活Met介导的细胞内信号转导和细胞迁移。进一步,他们开发了基于双特异性DNA适配体的RTK受体相互作用伴侣的重编程策略(DNA aptamer-mediated reprogramming of the interaction partner of receptor tyrosine kinases, DRIPaR)[126]和环状DNA适配体激动剂(circular DNA aptamer-based agonists)策略[127],用于重编程RTK受体介导的细胞信号转导,精细控制细胞的迁移行为。近期,本文作者课题组[128]首次报道了一种能驱动细胞微米级迁移的DNA分子机器人(图7)。在DNA酶活性的驱动下,DNA机器人以细胞膜表面Met受体为立足点,随机自主地在细胞膜表面行走,并连续触发Met受体二聚化,将DNA机器人在纳米尺度上的分子操作转换为活细胞的微观行为,实现了超高灵敏的细胞迁移行为控制。

图7 驱动细胞迁移的可行走DNA分子机器人[128]Fig. 7 A DNA molecular robot that autonomously walks on the cell membrane to drive its migration[128]
细胞与基质的黏附主要是通过整合素受体介导的,整合素可识别细胞外基质蛋白中的RGD三肽基序,进而介导细胞内信号转导并调节肌动蛋白细胞骨架动力学[129]。因此,RGD基序是一个可用于定量调节细胞黏附、细胞定向和迁移的关键受体识别模块。相关研究证明,整合素聚集和信号活化的通用间距尺寸在58~73 nm之间[130-131]。而且,RGD配体的空间组织形式,例如排列、定位、密度等,对于细胞黏附迁移行为具有重要的调节作用[132]。近期,Ding等[133]构建了一种具有纳米间距梯度的RGD纳米阵列,能够选择性诱导细胞沿纳米空间梯度定向迁移。此外,整合素受体功能还可以通过DNA链取代控制的动态模块可逆调节。Li等[134]通过滚环扩增(rolling circle amplification,RCA)生成了DNA纳米弹簧支架,然后在表面连接多价RGD配体。加入外部互补DNA链可以调节纳米弹簧上RGD之间的伸展收缩运动,从而可逆调节整合素受体的聚集和去聚集,影响下游PI3K/Rac1信号转导和细胞形态改变。
3.2 免疫功能调节
免疫细胞是分布在全身的半自主细胞,能够穿过多种组织,以不同的细胞行为模式检测和应对多种病理性损伤[135]。免疫细胞的功能由免疫受体的集体信号决定。这些免疫受体的表达和活性取决于细胞的发育阶段及其环境背景。因此,研究人员非常希望设计具有增强功能的或新疾病“感知和应答”行为的免疫细胞,操控其精确检测疾病,并治疗自然免疫系统无法处理的各种潜在挑战性疾病。
巨噬细胞和中性粒细胞等先天性免疫细胞是免疫系统的第一道防线,通过模式识别受体(pattern recognition receptors, PRR)识别微生物物种中保守的结构形状和死亡细胞分泌的各种“危险信号”[49]。活化的先天免疫细胞会产生多种细胞因子,触发急性炎症反应,并促进后续其他免疫细胞的募集和活化。先天性免疫细胞膜上的Fc受体(Fc receptor, FcR)、C型凝集素受体(C-type lectin receptor, CLR)和Toll样受体(tolllike receptors, TLR)能够形成大规模簇[136],发挥着重要的信号转导作用。Yu等[137]创建了四个不同纳米间距的TLR1-TLR2异源二聚体配体阵列Pam3CSK4,揭示了TLR1/2触发的免疫反应与配体簇间距之间的定量关系。结果表明巨噬细胞的促炎反应,包括肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的分泌和核因子-κB(Nuclear factor kappa-B, NF-κB)的激活与配体纳米簇的间距有关。TLR1-TLR2纳米簇在细胞膜上越接近,细胞免疫反应就越强烈。
T细胞是一种适应性免疫细胞,它通过与抗原呈递细胞和TCR上负载的肽结合的主要组织相容性复合物(major histocompatibility complex,pMHC)之间的相互作用识别外来抗原。当TCR与pMHC相互作用并聚集时,能够转化为细胞内信号,启动T细胞的免疫反应[138]。为了研究这个过程,Vale小组[83]开发了一种基于DNA的合成信号系统(DNA-CARζ),其中TCR和pMHC的胞外域分别被互补的DNA链取代,通过单门控DNA结合可以启动T受体的聚集和细胞内信号转导。进一步,他们组近期将DNA-CARζ与DNA折纸技术结合,通过精确排列配体分布,揭示了TCR信号激活的敏感性和动力学的空间控制[139]。除了配体触发的TCR空间重组外,TCR与配体相互作用所涉及的机械力也能调节T细胞中的免疫信号转导。研究者已经开发出一种光热响应聚合物致动器来操控TCR聚集[140]。在这个系统中,固定在表面上的金纳米棒被涂上一种热响应性聚合物,并且聚合物的另一端用TCR配体功能化。当金纳米棒被近红外光照射时,诱导的局域加热导致聚合物坍塌。这种构象变化产生皮牛顿范围内的拉力并控制配体结合的TCR聚集。为了研究通过TCR配体结合产生的细胞力,Salaita小组开发了一种基于DNA的纳米颗粒张力传感器[141],该传感器模拟了TCR-pMHC的特征相互作用,以测量T细胞活化过程中通过TCR-配体力学传递的皮牛顿力。他们后续还设计了类似的基于DNA的比率张力探针,用于在激活期间同时监测TCR的力和聚集[142-143],揭示了T细胞可以调整其机械机制以优化免疫识别反应的特异性。
3.3 组织再生修复
生长因子是一类活性多肽,可以调节细胞迁移、增殖、分化和细胞外基质合成。常用的生长因子包括碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、肝细胞生长因子(hepatocyte growth factor, HGF)和转化生长因子-β1(transforming growth factor-β1, TGF-β1)等,这些生长因子已经被广泛应用于组织修复[144-145]。例如,TGF-β家族的生物活性是结合并促进两个Ⅰ型受体(TβRⅠ)和两个Ⅱ型受体(TβRⅡ)的相互作用。TGF-β受体信号通路的激活在皮肤纤维化中发挥作用。Raines等[146]使用胶原蛋白结合物在小鼠伤口床固定结合TGF-β受体的多肽配体,从而促进成纤维细胞表面TβRⅠ和TβRⅡ的多价聚集,进一步提高细胞对TGF-β的敏感性,有效促进小鼠皮肤胶原沉积和伤口愈合过程。
在骨骼肌再生过程中,肌肉前体成肌细胞需要迁移和分化为功能性肌细胞[147]。骨骼肌前体细胞定向迁移和增殖行为对伤口愈合过程至关重要。本文作者课题组[148]开发了一种近红外光活化的DNA激动剂(near-infrared light-activated DNA agonis, NIR-DA)纳米装置,实现了体内细胞行为的非遗传操控。该方法可诱导受体二聚活化的DNA激动配体功能化在金纳米棒上。该纳米装置受近红外光触发下,通过局部表面等离子体共振引起的光热效应,进而释放和活化DNA激动配体。进一步,DNA激动配体促进细胞受体的二聚激活,加速骨骼肌卫星细胞迁移和分化,最终促进骨骼肌损伤的再生进程。
HGF及Met受体是肝细胞最主要的有丝分裂原功能蛋白[149]。细胞膜的Met受体聚集激活对维护正常肝细胞功能和促进肝脏再生至关重要。Yang等[150]使用T4 DNA连接酶密封Met的二价适配体的两端缺口开发了一种环状二价适配体(circular bivalent aptamer, CBA),不仅可以在体内激活Met介导的再生信号通路,修复APAP诱导的肝损伤,并且表现出抗外切酶活性和对血清的高稳定性。
3.4 活体行为操控
细胞表面受体聚集工程可以通过改变细胞外受体结构的空间排列,实现对细胞行为的精准调控。近年来,研究者们尝试将人工受体操控推广到高水平的活体行为控制应用。Verkhusha等[151]设计了一种光控RTK工程的通用方法,通过基因工程将细菌光敏色素的光敏核心模块融合到酪氨酸激酶B(tyrosine kinase receptor B, TrkB)受体的胞外结构域,成功实现了光诱导的受体可控激活。该受体参与神经系统包括睡眠、学习和神经保护在内的多个过程。基于上述设计,将工程化高表达光控TrkB受体的小鼠神经元细胞注射到小鼠的大脑皮层,通过颅骨远红光的微创刺激,能够诱导小鼠神经活动并影响小鼠的睡眠模式。该研究充分展示了光控受体聚集工程在活体行为调控的巨大潜力。尽管如此,该方法在临床应用中的可行性和安全性仍需进一步验证。
4 总 结
人工调控细胞表面受体聚集的工程策略为研究者们探究细胞功能、解析受体下游信号转导机制和细胞行为的精准操纵提供了多样化的选择。特别是快速发展的化学合成生物学提供了丰富多样的受体控制元件和操控原理,使得人们通过模块化和定量化的工程设计来控制细胞表面受体聚集。研究人员已经整合多种优势功能模块,开发出具有空间组装、特定响应性、时空分辨和高细胞选择性等特点的元件工程,并成功将其应用于细胞行为和免疫功能调节。此外,这些基于理性设计的新方法被推广到活体层面,例如活体组织修复和神经行为调节等。这些工作充分展示了人工调控受体激活工程策略在调节细胞信号转导中的巨大潜力,并为开发精准细胞治疗药物提供了一种潜在的新方案。
尽管人工调控细胞表面受体聚集在肿瘤免疫治疗、再生医学和组织工程等领域的应用前景广阔,目前仍面临以下几个重要挑战:
①人工调控受体聚集策略的具体作用机理仍需要进一步探究。虽然受体聚集的研究已经取得了一些显著的进展,但我们仍需要更深入地研究受体聚集策略在不同细胞类型和不同病理状态下的作用机制,以更好地指导其在治疗和修复过程中的应用。
②人工调控受体聚集策略的识别元件设计和制备过程需要进一步优化。现有受体聚集调控方法十分依赖于特异性受体分子识别元件。然而,目前所报道的识别元件仍然有限,无法实现对所有受体家族的精准识别和调控。同时,对多肽配体进行工程改造和从头设计是得到具有新功能和高特异性受体识别元件的有效策略。但需要注意的是,以上两种方法非常依赖于配体分子的结构设计。然而,目前大多数受体-配体复合物的晶体结构仍未被确定,这给技术上的应用带来了困难。因此,未来需要更努力聚焦受体-配体复合物的晶体结构解析以及高亲和力和特异性的受体识别元件的设计与筛选,以进一步推动该技术的发展和应用。
③人工调控受体聚集策略在临床应用中仍需面对严峻的安全性和有效性挑战。尽管受体聚集激活功能元件的不断扩展为人们调控受体聚集提供了多样的分子工具,但现有各个体系均存在固有局限性。目前,该领域还没有获得真正具有临床应用价值的工程化方案。例如:基于小分子响应需要额外给药,而且难以实现高度时空分辨的控制;光学修饰的受体系统受限于光的组织穿透性,而且过度依赖于在体内持续传递光的光照设备;磁控技术本身具有极强的穿透能力,然而目前磁控工具和设备的开发仍处于早期阶段,磁性执行器和相关科学机制存在争议且缺少可用的商业化设备。
④现有人工受体激活工程仍需解决在体内的安全性和长期性问题。DNA、多肽和抗体等生物分子为人工受体激活提供了具有巨大潜力的元件。但是,这些大分子稳定性较差,在血液循环中的滞留时间短,阻碍了其在复杂生理环境中的应用。更高稳定性和可长循环的生物大分子的改进方法有望使人工受体激活元件工程的条件设计和变量调节更加多元合理。目前,研究人员已经开发了多种化学生物学策略提高生物分子的体内稳定性[152-153],有望在未来进一步应用于细胞受体聚集的体内操控。
综上,虽然人工控制细胞表面受体聚集的工程策略还存在一定的风险和挑战。然而,随着化学合成生物学、细胞生物学和生物医学工程等学科的不断发展,我们有理由相信未来将开发出更加精准化和智能化的人工控制策略,为研究干细胞分化、T细胞活化、病原体感染和癌症治疗等生理和病理细胞过程带来新的方法,从而推动以细胞为基础的肿瘤治疗和再生医学领域的发展。

