合成生物学表型测试生物反应器及其装备化研究进展
郭肖杰,剪兴金,王立言,张翀,4,邢新会,4,5
(1 清华大学化学工程系,生物化工研究所,北京 100084; 2 工业生物催化教育部重点实验室,北京 100084; 3 清华大学无锡应用技术研究院生物育种中心,无锡 214000; 4 清华大学合成与系统生物学中心,北京 100084; 5 清华大学深圳国际研究生院生物医药与健康工程研究院,深圳 518055)
合成生物学是一门综合多种学科的新兴交叉学科,包括生物学、化学、物理学、数学、信息科学和工程科学等。它以工程化理念为指导,对生物体进行有目标的设计、改造乃至重新合成,被誉为继DNA双螺旋结构发现和“人类基因组计划”后的第三次生物技术革命。合成生物学的概念最早在20世纪初被提出,随着基因“读-改-写”技术的不断进步,近年来合成生物学得到了快速发展[1-2]。目前,合成生物学的研究过程通常遵循“设计-构建-测试-学习”(design-build-test-learn,DBTL)的循环[3-4],设计高效细胞工厂:在设计阶段,科研人员根据目标产物,利用先验知识、经验和计算机模型等进行合成生物学的路径设计,包括选择底盘细胞、设计基因回路、调控代谢通路和利用底物等;构建阶段则主要利用基因合成技术、基因编辑技术、基因扩增技术等,构建所需的基因系统、分子表达系统和代谢网络,最终将设计好的合成生物学路径构建成为实现预期目标的生物体系;测试阶段则对所构建的生物体系进行表型测试表征,包括基因型数据和表型数据的测定,以及目标产物的产量和质量的表征等;学习阶段则利用大数据、机器学习、深度学习、人工智能等方法对测试结果进行综合评估分析和预测,用以进一步改进和优化设计。通过不断迭代优化的方式,可以逐步提高合成生物学的设计性能,加速生物制造项目的开发速度,提高目标产物的生产效率和质量。
在DBTL循环中,由于细胞代谢网络和调控机制的复杂性,以及基因型和表型之间的高度复杂关联,目前还缺乏充分的理性设计方法,细胞工厂设计构建仍需要进行长期的反复人工试错实验。因此,将理性合成途径的设计与非理性的进化相结合,建立一套高效的细胞工厂设计和构建策略,成为合成生物学的重要研究方向[5]。同时,随着细胞设计构建方法的持续创新和发展,构建的细胞突变库规模不断增加,对细胞的测试和筛选效率提出了更大的挑战。因此,表型测试成为DBTL循环的关键环节。
在DBTL循环的表型测试环节中,针对不同应用目标和不同通量需求的测试,生物反应器成为主要的表型研究工具,比如单细胞检测筛选技术、基于多孔板的高通量筛选技术以及基于微流控的高通量筛选技术。虽然表型测试相关研究工作已有大量的文献综述报道,但仍缺乏全面系统的生物反应器与装备化研究进展总结,无法为合成生物学广大科研人员和工程技术人员提供参考依据。因此,本文从单细胞检测与分选到不同尺度生物反应器的细胞分析和筛选技术角度系统综述了各种用于表型测试的生物反应器及其装备化研究进展和相关特性,包括皮纳升级生物反应器、微升级生物反应器、毫升级生物反应器以及升级生物反应器,为合成生物学表型测试提供重要参考。
1 单细胞检测与分选
在本文中,单细胞筛选是指根据细胞自身的特征,如细胞的形状、密度、大小、光信号、图像特征等进行筛选。自20世纪80年代固体平板培养法被用于筛选微生物单克隆以来[6],科学家们一直在不断探索从细胞突变库中获得目标单细胞的高通量方法,发展出了多种单细胞表型测试和筛选技术和装备。这些单细胞测试技术及其装备主要包括单细胞检测和单细胞分选两个模块。
单细胞检测模块主要包括细胞荧光(荧光蛋白代谢或表面标记的荧光分子)[7-8]、散射光(细胞和亚细胞结构和大小)[7,9-10]、拉曼光谱[11-13](揭示单个细胞的内在化学信息)、图像[14-16](明场图像、荧光图像以及三维图像)、磁信号[17-19](抗体或链霉亲和素包被磁珠识别的细胞表面抗原)、阻抗信号[20-22]等。其中,光散射信号、拉曼光谱、明场图像和阻抗信号在细胞自身受照射或激发时即可产生,无需进行标记,但单细胞的这些非标记信号强度往往较弱,导致检测误差较大、精度低、背景噪声大、抗干扰能力弱。而荧光强度、荧光成像和磁信号通常需要对细胞进行复杂的标记,这些标记为单细胞检测提供了较强的信号强度和较高的信号质量,以提高检测的准确性。同时,对于荧光信号而言,还可以通过基因工程技术向细胞内嵌入特定荧光蛋白基因,用于表达产生对应的荧光蛋白,如GFP、YFP、RFP等[23-24]。质谱也被广泛用于细胞分析,且具有较高的普适性[25-27],但该方式常需要对细胞进行裂解破碎,无法获得活细胞,此外,如需对细胞外分泌物进行检测则往往需要特定的微型生物反应器对其代谢产物进行富集才能实现检测。
单细胞的分选则是在对细胞目标特性进行检测识别的条件下获取目标细胞的方法和技术,分选过程中驱动细胞向特定方向运动的推动力可来源于电场、磁场、光场、声场、流体力场、重力场等作用。电场可以直接将带特定电荷的细胞分选到收集容器中[7],也可以基于介电电泳技术对不带电细胞分选[17,28],为细胞分选提供了一种超高通量方式,但前者细胞充电的过程往往会对细胞造成损伤,降低细胞活性。采用抗原-抗体特异性结合方法标记的细胞,可以使用磁性颗粒进行特异性偶联进而利用磁场进行分选[29],但其操作相对烦琐,整体效率低。基于光镊的单细胞筛选技术是由强会聚的激光束形成的光学势阱,通过光场梯度所产生的光力将细胞拉入光束轴,辐射压力(散射)分量推动细胞沿光束传播轴运动,完成对细胞运动的操控[11,16,30-31],但光镊的通量较低,且可能因其发热效应而损坏细胞,导致细胞活力下降或死亡。在声场方面,表面声波(surface acoustic wave,SAW)和驻波(standing surface acoustic wave,SSAW)驱动细胞分选是利用“声场”的物理原理,驱动连续流动中目标颗粒或细胞向不同方向运动,实现高通量、低损伤的细胞分选[8,32]。该方法通常在微流控芯片底部构建电机阵列,用以产生特定频率和幅度的声场,但芯片加工工艺较为复杂、成本高。流体力场则可以通过泵和阀来控制和改变,实现驱动目标细胞向特定方向运动,由于部件之间的通讯和响应时间较长,该方式的分选速率比较低,且往往需要自动化整体控制[14-15,33-34]。单细胞悬滴法则是根据液滴重力或微泵将包含单个细胞的液滴分配到目标基板(如微孔板)上,而非目标液滴则被转移至废液收集瓶中[35],分选过程温和,但速度受限。
通过上述两类模块的集成,可以开发多种单细胞检测与筛选平台,应用于不同场景。如传统的荧光激活细胞分选(fluorescence-activated cell sorting,FACS)装备集成了单细胞的荧光检测、散射光检测的光学检测模块和高压电场分选模块,细胞被检测后,设备对细胞及其周围液体进行充电,使其带上特定电荷,然后再在下游的高压电场中,受电场力迁移至特定位置,进入收集容器,完成单细胞的检测分选[图1(a)]。目前该装置已经在合成生物学中广泛应用,并已有相关综述详细报道[5]。磁激活细胞分选(magnetic activated cell sorting,MACS)则是使用抗体、酶、凝集素或链亲和素结合到磁珠上,这些物质可以与靶细胞上的特定蛋白质相关联,然后将细胞悬浮液置于磁场中,标记的细胞被吸引,而未标记的细胞被冲走,关闭磁场会释放剩余被捕获的细胞[图1(b)],MACS常用于动物细胞的分离,如Uosaki等[38]以血管细胞黏附分子作为心肌细胞表面标记物,基于MACS装置将从诱导多能干细胞中分离心肌细胞,获得了产心肌肌钙蛋白-t心肌细胞,所获得细胞的阳性率大于95%。中国科学院青岛生物能源与过程研究所徐健和马波团队[39]所开发的拉曼激活细胞分选装置(Raman activated cell sorting,RACS)则是对细胞进行拉曼光谱检测,然后通过电磁阀的开关驱动流体流动实现目标细胞分选,同时,借助介电泳方式实现细胞在拉曼检测窗口位置的捕获和释放,提高所获得的拉曼信号质量[图1(c)]。该装置用于产生类胡萝卜素酵母的筛选,在含有产生类胡萝卜素的酵母(9%)和不产生类胡萝卜素的酿酒酵母(91%)两种细胞株的混合物中进行了分选,前者的平均富集率为73%。Faenza等[20]开发了一种细胞阻抗信号检测和分选的装置,该装置通过集成了阻抗检测微阵列电极和压电式流体驱动器,细胞流经电极阵列时检测阻抗信号,如果是目标细胞,则触发压电开关,所产生的一定体积流体进入微流体通道,将目标细胞推动至下方压电喷头处,进而被喷射至多孔板中,完成细胞的检测和分选[图1(d)]。该装置成功地监测了分离K562白血病细胞至多孔板的过程,且所分选细胞无假阳性。Ren等[40]将驻波驱动技术和荧光检测技术(SSAW)进行整合,结合微流控芯片实现细胞的荧光检测和声场驱动分选,首先使用驻波技术使细胞颗粒在流体中聚焦成“线”,流经荧光检测区,获得高质量荧光信号,然后再次利用驻波驱动技术,将细胞从聚焦流中偏转至收集通道,从而实现高通量分选[图1(e)],该装置用于哺乳动物细胞(HeLa细胞)的检测分选,实现了2500个/s的高效分选,所分选细胞纯度大于90%。Nitta等[15]将三维成像技术和薄膜微阀流体驱动技术结合,通过获取高质量的细胞三维图像,结合深度学习算法,对细胞进行高内涵分析,并针对感兴趣的目标细胞,在下游流动过程中通过薄膜阀所驱动的微量流体流动,将目标细胞推动至收集管路中,以此完成细胞的图像分析和分选[图1(f)],该装置可以对聚苯乙烯微球实现100个/s的筛选速度,且纯度高达99%。
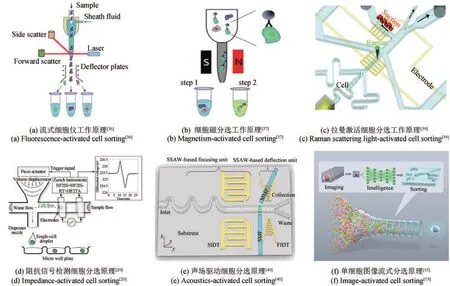
图1 单细胞检测与分选装置工作原理图Fig. 1 Single cell detection and sorting
此外,近年来有许多研究在微流控芯片上设计了许多微结构以实现细胞或粒子的主动分选,包括微井结构阵列单细胞捕获[41]、确定性横向位移(deterministic lateral displacement,DLD)[42-43]和惯性流系统(inertial microfluidic)[44-45],可基于单个细胞的直径大小和弹性对大量细胞进行快速高通量分选,且无需对细胞进行标记检测即可实现目标细胞分离。
2 皮纳升级微型生物反应器及装备化
本文中皮纳升级生物反应器体积范围1 pL~100 nL,主要包括两种类型[46-47]:一种是采用微加工技术在基板上制作微孔阵列,微孔直径常小于500 μm,细胞装入微孔中进行培养和检测,基于微孔的单细胞筛选的通量约为102~103个[48];另一种是基于微液滴的生物反应器,它是由液滴微流控技术产生的,将细胞封装在液滴中进行培养和检测,液滴直径常小于200 μm,基于微液滴的单细胞筛选技术的通量为105~108个[49]。这些皮纳升规模的生物反应器相对于大型生物反应器可以有效提高细胞生长的初始浓度,为单细胞提供非竞争性的生长空间,更有利于细胞的生长和代谢[50-52]。皮纳升级生物反应器通常用于单细胞或单克隆筛选,与本文第一部分所描述的依赖于单细胞形态特征或标记物进行检测和筛选的方法不同的是,基于皮纳升级生物反应器的单细胞检测筛选技术,可以满足对有机小分子、代谢物、酶、蛋白质等类型的胞外代谢分泌物进行高通量检测的需求[53-54]。为了快速测量特定的底物或代谢物,许多生物和化学传感器被应用到皮纳升级别的微反应器中,这些传感器通过与目标底物或代谢物进行特异性反应而产生强烈的荧光信号,使得从大规模的细胞文库中筛选目标细胞的工作变得容易和快速[55-56]。
微孔阵列生物反应器的发展得益于微加工技术和聚合物材料的快速进步。自20世纪80年代以来,微加工领域不断引入新的制造方法和先进材料[57-58],作为半导体工业中最常见的材质,硅和玻璃是第一批被研究的材料[58]。近些年,使用聚合物材料的软光刻技术可以在标准的分子生物学实验室中快速廉价地生产微结构[59-61]。用于生物分析的微孔有一定的要求,包括工作温度、无菌性、黏结性、透气性、透明性、低毒性等,其中聚合物聚二甲基硅氧烷(polydimethylsiloxane,PDMS)目前是软光刻制造中最常用的材料,具有疏松多孔、易于加工、结构可控性强、生物兼容性好、透明性高的优点[47],单细胞可在该类型微孔中进行长期的生长代谢(数天到一周)和状态观察。微孔阵列生物反应器中单细胞培养和检测方式如图2所示,通过有限稀释法[62]或单细胞分选的方式[7]将细胞分散至微孔中,并对微孔阵列周围环境进行适宜的温度控制和氧气供应,满足细胞在微孔阵列中生长和代谢的环境条件需求,并结合荧光显微技术,对细胞的生长代谢状态进行连续观察分析,进而挑选出合适的目标细胞[48]。

图2 基于微孔阵列的单细胞分选策略[48]Fig. 2 Workflow for single cell screening based with microwells[48]
液滴微流控是指通过油相和水相在微流控芯片中进行相互剪切,形成大规模的均匀液滴群,这些液滴直径常小于300 μm,在微生物学高通量单细胞培养和分析方面已显示出其独特优势[63-66]。微液滴具有通量高、体积小、易操作、传质传热迅速等特点,已日益成为单细胞分析的重要工具,其应用包括聚合酶链反应(polymerase chain reaction,PCR)、细胞培养、分选、分离、克隆形成、细胞裂解、基因和蛋白质表达、抗体分泌以及细胞毒性分析研究[53-54,65-67]。在微生物学领域,液滴通常是指油包水(Water-in-Oil, W/O)结构的微液滴,可以很容易地通过主动和被动的液滴生成技术制备[68]。单细胞培养的液滴大小从皮升到纳升不等,由于细胞在生成液滴过程中是随机分配到液滴内的,被包裹在液滴中的细胞数量及其分布概率服从泊松分布统计学规律[69-70],这与有限稀释方法类似。为了提高单细胞包封率,研究人员利用惯性流体技术[71]或介电泳技术[72]对芯片上液滴生成单元上游的细胞进行排序,并控制其逐一进入液滴,使得单细胞包封率可提高至80%以上。液滴形成后,可将液滴群储存在小容器中,如离心管、微管或其他自制容器中,然后放置在合适的温度、湿度和气体环境中进行孵育,微生物可在液滴中进行增殖和代谢。考虑到不同微生物种类需要不同的氧气浓度,研究人员采用高透气性微管路来储存液滴,氧气和二氧化碳可以通过管壁不断渗透到油相中[73-75],或者对油相进行反复充氧,使其给液滴供氧[76]。
在皮纳升级微液滴系统中,开发和整合有效的细胞快速实时检测技术是微生物分选的关键步骤。微流控系统中样品体积的微量化和液滴的快速流动对检测的速度和灵敏度提出了重大挑战,液滴微流控的检测技术需要具备简单、快速响应、高灵敏度、紧凑、灵活和低成本等特点[54]。液滴的检测与流式细胞术类似,其检测信号包括荧光[77-78]、拉曼[72,79-80]、图像[81-83]、光散射[84]、阻抗[85]、核磁[86-87]、电化学[88-89]、质谱[90-91]和光吸收度[92-93]等。对于液滴分选,与单细胞分选方式类似,仍然可以利用电场[94]、磁场[95-96]、光场[97]、声场[98-99]、重力场[100]、流体动力场[101]所产生的力来驱动液滴到收集或废液通道。通过上述检测方式和分选方式的组合集成,可以实现高通量、高效率的微生物检测与筛选。在皮纳升微液滴反应器中,较为广泛使用的装置是荧光激活液滴分选系统(fluorescence activated droplet sorting,FADS)。其是将液滴荧光检测和介电泳分选方式进行集成设计,检测到液滴荧光信号后,如果是感兴趣的目标液滴,则在微流控芯片下游用介电泳所产生的驱动力推动至收集通道中,完成液滴的检测分选[图3(a)],该技术平台在微生物高通量筛选和酶进化领域已经获得了广泛应用,有较多的相关文献综述报道[5,103-104]。基于FADS技术,天木生物公司推出了商业化的超高通量单细胞筛选平台DREM cell,实现了每天超百万液滴的筛选通量,显著提升表型测试效率,并使试剂消耗成本降低至传统方法的百万分之一。Wang等[79]将拉曼检测技术和介电泳分选技术结合,成功搭建了拉曼激活液滴分选装置(Raman activated droplet sorting,RADS)[图3(b)],并将其应用于产虾青素的雨生红球藻筛选,所获得细胞阳性率约98.3%,分选速率为260个/s。Holland-Moritz等[91]将质谱检测与介电泳分选技术结合,将样品液滴在微流控芯片上游进行分割,产生两个相同子液滴,其中一个液滴进入电喷雾电离质谱(ESI-MS)中进行检测,获得相关检测数据,另一个液滴则根据检测数据结果通过介电泳方式驱动进入收集通道或者废液通道,完成液滴的质谱检测和分选[图3(c)],该装置用于含有体外表达转氨酶的液滴筛选,实现了0.7个/s的液滴筛选速率,准确率为98%。Hasan等[94]则将时间分辨荧光检测技术与介电泳分选技术结合,实现了时间分辨荧光激活液滴分选系统,可根据不同荧光寿命对液滴进行分类[图3(d)]。Zang等[81]通过对液滴成像,检测液滴内微生物的生长量,并结合液滴介电泳分选方式,实现对目标液滴的分选[图3(e)],该装置应用于放线菌的生长情况检测,可以实现100个/s的液滴分选速率,在筛选未知物种及其未被发现的天然产物方面有很大潜力。Gielen等[92]将光谱吸收检测方法和介电泳分选技术集合,通过在液滴流路两侧放置光纤,两侧光纤分别连接光源和检测器,用以测试液滴经过检测窗口时其光谱吸收变化,并根据光吸收变化对感兴趣的目标液滴进行分选,实现光吸收激活液滴分选装置(absorbance-activated droplet sorter,AADS)[图3(f)]。该装置用于苯丙氨酸脱氢酶的进化研究中,通过两轮的定向进化,酶活性增加了2.7倍。

图3 基于皮纳升微液滴的单细胞表型测试与筛选Fig. 3 Single cell sorting based on droplet bioreactor with a volume of pico or nano liters
此外,采用双乳化液滴[105-107]或凝胶液滴[108]的方式包裹微生物细胞,培养完成后可以在成熟的商用流式细胞仪中直接筛选,无需重新搭建新的液滴分选装置。
然而,皮纳升级生物反应器目前仍然存在一些问题和挑战。由于皮纳升级生物反应器体积很小,蒸发会对其产生很大的影响。皮纳升级的微孔阵列生物反应器,往往需要覆盖一层透气性膜,以减少蒸发问题和交叉污染。相对于微孔阵列反应器而言,皮纳升级液滴的蒸发速度较为缓慢,这得益于油包水的物理结构和表面活性剂的综合作用[109-110],这种作用也使得液滴之间相互隔绝,使液滴成为独立的微型生物反应器[111-112]。但这种油包水液滴结构带来了一些问题:第一,液滴操作性能严格受到油相和水相界面的约束[109],对机械扰动和静电非常敏感,机械振动会造成液滴之间的激烈碰撞,破坏液滴之间的油膜层而引起液滴之间相互融合,静电则通过引起液滴界面的电荷分布发生变化而导致液滴融合,这些为液滴的操作和装备化开发带来了极大的技术挑战。第二,液滴稳定性与液滴内部的生物过程有较大关系,微生物在液滴中可能消耗或产生一些化学物质,这些化学物质反过来可以改变液滴界面张力,从而影响液滴稳定性,比如枯草芽孢杆菌代谢所产生的表面活性肽会进一步降低液滴界面张力。第三,对于难溶于水相的物质,比如脂溶性分子,可能会“泄漏”到载体油相中而被油相萃取,而在水相和油相中都有一定溶解度的物质则可能通过油相穿梭至邻近的液滴,从而导致交叉污染[111,113-114]。这个问题最常见的处理方式是更换油相为HFE-7500油或FC-40氟碳油[115],减少表面活性剂浓度[113,116],添加牛血清白蛋白(bovine serum albumin,BSA)[113],使用皮克林乳化剂[117]或在水相中增加糖含量[118]。
3 微升级生物反应器及其装备化
传统的微升级规模的微型生物反应器通常为多孔板,如96孔板、384孔板和1548孔板[119]。此外,还有单个液滴体积为0.1~4 μL、直径小于2 mm的微升级液滴反应器[74,120-121]。与皮纳升级别的生物反应器相比,微升级生物反应器可以为细胞的生长和代谢提供更多的营养物质和生长空间,且细胞的光密度(optical density,OD)和荧光检测方法更简单。微升级生物反应器主要应用于单细胞培养和筛选,单批次通量约为102~103个。
微升级多孔板中,96孔板是最常用的多孔板。由于表面张力的影响,384孔板和1536孔板中的培养基不能被摇床产生的离心力显著驱动,以致缺乏充分的混合而使细胞下沉到底部,并导致氧气传递困难,使得氧气传递速率(oxygen transfer rate,OTR)保持相对较低的水平,因此,384孔板和1536孔板的应用主要局限于厌氧菌株或类似于PCR的生化反应[122]。目前,96孔板已成为各种自动化设备的标准物理接口,包括平板挑单克隆仪、自动移液工作站、酶标仪、自动封板设备、培养箱等,用于微生物的高通量培养、分析和筛选[123]。同样受制于表面张力,96孔板内氧气传递和混合受到限制,这经常导致需要充分氧气供应的微生物(例如酵母)生长不良[124]。而通过提高转速来改善溶解氧和流体的混合,会导致剪切力的增加损伤微生物细胞,尤其是对剪切力较为敏感的细胞[125]。为了增加反应器内溶氧(dissolve oxygen,DO)和混合程度,研究人员设计了不同材料、不同形状和结构的微孔,包括方形、圆形、V形底部、U形底部等(图4)[124,126-127],并添加了全氟辛烷、全氟三丁胺、全氟萘等试剂作为氧载体增加供氧[128-130]。因此,科研人员需要根据实验考虑单孔体积、形状、材料等因素来选择最合适的多孔板生物反应器。
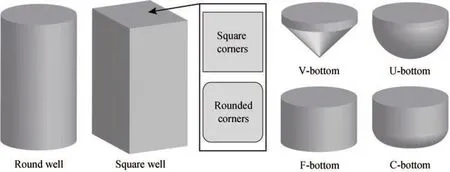
图4 多孔板中不同形状的微孔[126]Fig. 4 Different well geometries in microwell plates[126]
标准96孔板的引入,不仅大大提高细胞的研究通量,同时实现了较大程度的自动化,通过整合机械臂、移液工作站、酶标仪、孔板覆膜机、培养箱等多种装备,可以实现实验过程的自动化和标准化,解放人力,显著提升筛选通量。但96孔板系统同样存在较多挑战:①自动化的孔板系统所需要的设备数量多且价格昂贵,耗材和试剂消耗量大,运行费用高,操作复杂,且占用空间大,这些问题严重地限制了其广泛应用;②孔板“边缘效应”导致孔板培养结果的一致性相对较差[131],影响了实验结果的一致性;③96孔板的微孔之间距离过小,操作过程容易出现孔间交叉污染;④为了防止样品在振动时飞溅,转速对多孔板单孔细胞悬浮液的装载量有所限制,转速低会降低培养体系混合效果,而转速越高,装载量就越少,此时受蒸发的影响就越大。
微升级微液滴指的是体积在微升级别的油包水结构的微液滴,通常也被定义为“分段流”“柱塞流”等,可以包裹单个细胞或细胞群体进行细胞培养和检测[132-134]。相较于皮纳升级别的微液滴,微升级液滴可以为细胞生长提供更多的营养物质和更长的培养时间,微生物浓度可以高达106~107CFU/mL,有利于代谢产物的充分生产,特别是需要充分生长才能产生的次级代谢产物[135]。同样地,为了保证微升级液滴生物反应器充足的氧气供应,研究人员将液滴储存在高透气性材质的微管路中,氧气和二氧化碳可以通过微管路的管壁渗透到液滴和周围环境中,完成气体交换[35,135]。微升液滴的检测方法简单多样,与皮纳升级别的微液滴类似,但由于微升液滴体积大,对检测的灵敏度和精度要求较皮纳升级别液滴低,从而简化了装备设计,降低了仪器成本。而对于微升级液滴的分选,普通的声场、电场、光场等无法产生足够大的驱动力使液滴移动到收集通道或废液通道,因此主要依靠流体力场和重力场将液滴驱动至收集容器中[35,136]。微升级液滴内封装的细胞数量同样符合泊松分布统计学规律,因此,可以用于单细胞高通量筛选,如中国天木生物科技有限公司开发的商业化MISS cell系统、法国的Millidrop公司推出的Millidrop系统[35,137]。另外,微生物细胞接种悬浮液可以直接产生微升级液滴,以评价其在不同培养条件下的生长和代谢,如生长曲线测定、单因素多水平优化实验、适应性进化,不仅节省常规筛选方法需要的大量试剂和耗材,而且极大提高了自动化程度和实验效率,获得更丰富的微生物表型数据[120,135]。Jian等[135]和Jakiela等[120]以2μL液滴作为反应器,分别采用不同方式进行液滴生成、识别、检测、分割、融合、分选等操作,实现微液滴微生物的培养、传代、检测和分选,提供了全自动化微生物微液滴适应性进化平台[图5(a)和(b)],并分别成功应用于大肠杆菌对甲醇和抗生素的适应性进化实验。Cao等[138]通过设计多通道流体混合流路实现了高维度浓度空间的液滴快速自动化制备,一次实现多达5000个不同种类和浓度的毒性物质组合,可接种细胞进行细胞毒性测试[图5(c)],该系统应用于抗生素氨苄西林和氯霉素对大肠杆菌培养的干扰测试,并新发现了一种复杂的反应模式(包括协同效应和补偿效应)。Baraban等[132]基于微升级液滴提出了一种新型的微流体液滴分析仪,该装置前端可以将培养基、抗生素溶液、菌悬液等在微流道中进行混合并生成液滴,通过控制抗生素和培养基的流速,可以实现连续浓度梯度的抗生素液滴制备,并接入菌种进行生长,培养一段时间后,通过下游的荧光检测装置对微生物的生长量进行检测和数据处理,从而完成菌株的药敏测定[图5(d)]。Boedicker等[133]采用类似的方式,在装置前端生成不同抗生素浓度微液滴,接着,每个液滴与细菌活性指示剂和细菌悬液混合后重新生成液滴,并进行培养和检测,分析菌株对不同抗生素的抗性情况,该方法可显著缩短检测时间,降低细菌样品浓度要求,提高结果的准确性[图5(e)]。Jian等[35]基于微升级液滴设计了全自动的单克隆挑取装置[图5(f)],该装置包含微升级液滴的发生、培养、检测、分选至96孔板等多个模块,可以实现单个微生物的液滴包裹生成、培养、OD检测和分选目标液滴至孔板,具有微型化、自动化、高通量特点,并应用于大肠杆菌和谷氨酸棒状杆菌的单克隆挑选。
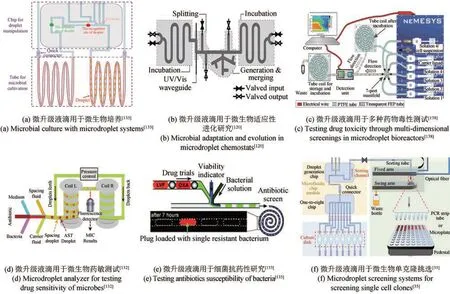
图5 基于微升级微液滴的微生物培养和分析装置Fig. 5 Microliter droplet-based microbial culture and analysis systems
微升级液滴的工程化应用研究同样面临诸多技术挑战。一是微液滴的稳定性常依赖于使用的表面活性剂,以防止液滴相互接触后融合,但常规油相和表面活性剂体系能够支持的液滴大小直径不超过300 μm,大于该体积后,液滴接触后极易相互融合,导致实验体系被破坏,因此通过表面活性剂作用来阻止液滴融合的方式显然不适用于微升级液滴体系。二是在透气性微管路中培养的微升级液滴,由于其黏度、界面张力和尺寸等特征的不同,使其在静止或运动过程中,造成不同液滴与油相之间的滑移情况有所差异,进而导致初始状态下分散的液滴之间逐渐相互靠近并融合。因此,解决微升级液滴之间融合问题的关键是防止液滴之间的接触。为了避免液滴之间接触,需要不断调整间隔距离,或者在液滴之间插入与油相和水相互不相溶的第三种介质作为液滴间的屏障,从而避免液滴融合[139-141]。即使如此,仍然需要添加适当的表面活性剂来保持液滴油水界面的稳定性,以避免液滴破碎、过乳化而造成的液滴内容物泄漏问题。三是微升级液滴具有与皮纳升级液滴相同的局限性,比如,一些分泌或降解表面活性剂的菌株筛选不适用,因为它们会破坏油水界面的稳定性。部分丝状菌(如霉菌)需要控制其在液滴中的培养时间,以避免菌丝伸出油水界面破坏液滴,造成交叉污染。
4 毫升级生物反应器及其装备化
本文中,应用于表型测试的毫升级生物反应器是指体积范围在1~100 mL的生物反应器,包括常见的深孔板(96/48/24/12/6孔单元数量)、试管、摇瓶、搅拌釜[142]和近期报道的微型管式生物反应器[75]。毫升级生物反应器可以提供相对可控的液体混合和氧气传质效果,因此可用于初期的菌株培养生物工艺开发[142-143]。同时,毫升生物反应器仍然具有并行化、自动化和低成本的优点,因此可用于一定通量的微生物表型测试和筛选场景,单批次通量常在101个。由于毫升级的培养体积较大,除了对pH/OD/DO等简单参数的在线测量外,研究人员还可以取样进行离线分析,采用更复杂的方法对样品进行检测,如色谱法、质谱法、滴定法等,以获得更多的生物过程表型参数。因此,毫升级生物反应器在微生物高通量筛选和发酵过程工艺优化之间起着重要的桥梁作用。
深孔板类型的毫升级微型生物反应器,单孔体积同样包含多种不同材质以及不同形状的深孔板,相对微升级多孔板而言,其单孔直径和深度更大,这使得液体表面张力在孔板振荡混合过程中的阻碍作用很小,有利于保证微生物的培养效果。同时,深孔板允许更大的液体振荡幅度和更高的振荡频率,使得细胞悬液的混合和氧传质可控性增大,通过调节培养箱的振荡幅度和频率即可实现[126,144]。与微升级多孔板相似,为了避免水相的蒸发以及相邻微孔间的交叉污染,常用透气性的封口膜或夹心盖覆盖孔板。这些封口膜一方面对氧气和二氧化碳有着较高的透过性,可满足培养液气体交换的需求,另一方面水蒸气透过阻力大,减少培养液蒸发量[122,124,145-146]。但即使如此,封口膜在使用过程中,尤其是水蒸气或者菌悬液凝结在封口膜上或者培养基振荡过程中飞溅到封口膜上,会显著增加气体交换阻力,降低供氧效率,导致微孔的差异性增大[144,147]。基于光学检测的非侵入性方法常作为深孔板内细胞悬液的检测手段,微孔里的生物量(通常采用OD值表征)基于光散射(发酵液内细胞的散射)进行测定,而对于pH或DO检测,常需要在孔板底部固定对应的荧光膜传感器,通过测定荧光信号变化来检测pH值和DO值[148-150]。比如,德国m2p labs公司所推出的Biolector系列商业化孔板反应器装备[图6(a)],它是基于毫升级孔板和非侵入式光学传感器的高通量微型生物反应器,工作体积为0.8~2.4 mL。为了实现更高的氧气传质效率,其微孔形采用“梅花型”结构,用以增加旋转振荡过程的氧气传递能力,同时微孔底部分别贴附pH和DO荧光膜传感器,实时在线监控pH、DO等参数[127]。

图6 不同类型的毫升级微型反应器及其装备Fig. 6 Different types of millilitre-scale microreactors
摇瓶和试管作为常见的振荡型毫升级生物反应器,因其操作方便、价格低廉,广泛应用于微生物筛选实验和过程工艺初步研究[151]。与微孔板相似,该类型生物反应器的混合和氧传递也依赖于摇床振荡频率和幅度、液体装样体积比和内部物理结构。试管的液体体积约为2~25 mL,摇瓶的液体体积约为20~500 mL,两者的装液量一般不超过生物反应器标准体积的20%。该类生物反应器的开口处常装有棉花或塑料泡沫塞,以保持生物反应器内部不受杂菌污染,同时提供充足的气体传质。同样地,类似于毫升级深孔板,细胞悬液的蒸发和飞溅会致使瓶口棉花或塑料泡沫等产生润湿和污染,降低气体交换速率[152]。对于毫升级试管和摇瓶的检测,可利用的在线测量方法很少,基于摇瓶和试管的集成化微型生物反应器装备仍比较稀缺[150,153-154]。美国颇尔(Pall)公司的Micro-24系统[图6(b)],有24个试管组作为反应器,每个反应器工作体积为5~7 mL,可独立控制pH、温度、DO等参数,且获得的结果具有可放大性[156]。但该反应器的取样和补料需要手动操作,这不仅中断氧气供应,而且增加样品污染的风险。
搅拌生物反应器是一种带有叶轮的反应器,广泛用于发酵研究和生产。微型搅拌生物反应器与传统的生产型搅拌生物反应器结构相似,且体积规模较小(小于100 mL),因此常用于早期发酵过程工艺开发[142,151]。微型搅拌式生物反应器由于体积限制,常规的pH检测电极和DO检测电极无法插入反应器内部,因此常采用相应的荧光膜传感器贴附于反应器内壁,通过荧光检测装备读取荧光信号值从而获得pH值和DO等参数[157-158]。搅拌生物反应器中可采用多种不同结构的叶轮,提供不同的氧传递、剪切速率和流体混合的效果[159-161]。相对于毫升级摇瓶和试管而言,搅拌釜反应器可以支持长期连续培养,并持续获取生物发酵过程参数,为后期菌株的发酵放大提供重要依据。但与其他小型生物反应器相比,毫升级搅拌式生物反应器具有较高的成本和复杂的操作,限制了其在高通量筛选中的应用。近年基于搅拌釜结构的生物反应器装备研发进展较快,比如德国美诺公司研制的bioreactor 48反应系统,反应器容积8~15 mL,通量高达48个。其反应器由一次性的聚苯乙烯塑料器皿和磁力搅拌器构成,而搅拌器中集成了可通气的管路来显著提高供氧能力,可检测参数包含pH、DO、OD,其中pH 和DO通过荧光膜进行实时检测[162-163]。但由于采用了磁力搅拌方式,在发酵液黏度过大时,有可能造成搅拌减速或停止而无法继续培养的问题。德国赛多利斯推出的Ambr 15微型反应器[164][图6(c)],其主体结构为搅拌结构,可装载体积为10~15 mL,单次可运行24~48个单元。溶氧的调控依赖于搅拌和通气,每个单元具备独立的通气管路,因此可独立控制溶氧,同时每个单元的取样和补料通过机械臂实现独立。该反应器装备具有DO、pH的检测功能,但由于采用特制的一次性微型搅拌桨,单个单元成本较高。
近年来,作者团队利用高透气性材质(Teflon AF-2400)的微管路作为表型测试生物反应器,并进行装备研制(EVOL cell)[图6(d)],用于微生物的毫升级规模培养[73,75]。毫升级微型管式生物反应器中,氧气主要通过微管路管壁渗透到细胞培养基中,流体通过管内介质的连续流动进行混合,并进一步增强氧传质效果[165]。微管路内细胞悬液的流动为典型的层流状态,因此剪切力小,特别有利于流体力学敏感的细胞培养。在微型管式生物反应器中,由于流体的比表面积和流速稳定,保证了氧传递速率和过程参数稳定性,因此通过改变微型管式反应器的管路长度和并行数量,可以一定程度上实现微生物培养的“线性放大”。微型管式生物反应器由于采用特定的无泡供氧方式,使得反应器无需振荡和搅拌,即可实现高效的氧气传递,这使得培养液的在线检测变得简单。笔者团队基于该反应器原理,在微型管路的两侧集成了用于OD实时监测的光电传感器,利用微管路的短光程检测优势,实现了实时在线且超大量程(OD值检测范围0~20)的微生物生长监测[75]。毫升级微型管式反应器有着巨大的发展潜力,但目前存在一定的问题和挑战。第一,受微管路内径的限制,大粒径、絮状或高黏度的培养基可能造成管材堵塞,严重制约了其在微生物研究领域的应用。第二,管式反应器内部流体剪切力低,贴近管壁附近的流速几乎为零,这容易造成微生物的聚集吸附。虽然特氟龙管具有优异的表面性能,能够有效阻止吸附的产生,但对于一些产生表面活性剂、胶原物质的微生物而言,仍然可能附着在管壁上形成生物膜。第三,微管路的内径较小,其内部存在的气泡对流动造成较大阻力,对反应器内溶液的运动产生较大影响,表现为流动不顺畅、连续流体被截断,从而导致混合效果和溶氧一定程度上的变化,该类问题需要在工程化开发和应用过程中进一步优化解决。
5 升级生物反应器及其装备化
本文中,用于表型测试的升级生物反应器主要是指0.1~5 L的生物反应器,用于对高通量筛选得到的微生物进行进一步表型发酵验证和放大。该生物反应器的主要类型为搅拌式生物反应器,具有pH、DO、温度等检测探头,通过曝气和搅拌实现溶氧控制,可进行分批或连续发酵(图7)。改造高产菌种为了实现工业规模的发酵生产,通常需要通过小型搅拌釜进行过程工艺初步开发,提供必要的发酵过程工程参数,如功率参数(功率/体积,P/V)、溶氧浓度或氧传递系数[143,167-168]、呼吸熵[169-170]等,再通过特定的放大系数和标准,对后期的放大生产进行指导[171-172]。为了提高反应器通量,研究人员将多个搅拌釜生物反应器进行并联运行,并进一步集成装备化,如上海国强生化的多联罐生物反应器系统、迪必尔生物的平行反应器系统等。

图7 典型搅拌式生物反应器结构示意图[166]Fig. 7 Diagram for typical configurations of stirred bioreactors[166]
在生物发酵过程中,搅拌叶轮持续对反应器内溶液进行搅拌增强混合和溶氧,但随着发酵罐体积的增大,局部范围内温度、pH、营养物质浓度和DO仍然存在不均匀性,甚至对微生物生长产生抑制作用。在搅拌式生物反应器中,常规的DO、pH和温度等参数可以在生物反应器中配备电极进行检测,以及部分代谢参数可通过红外光谱[173-174]、拉曼光谱[175-177]等光学手段进行检测。除此之外,其他发酵过程参数的测量通常需要从反应器中取样和处理,再利用特定的分析仪器进行分析,该过程操作烦琐、所需时间较长,难以保证检测的及时性。另外,很多发酵过程持续时间在数天至数周,常常需要不同操作人员轮流值班,给工程技术人员带来了繁重的工作量。近年来,随着采样分析设备的出现,发酵参数的测量可以自动、在线、高频、准确地进行。同时,根据发酵罐的在线检测数据,还可以通过排料和补料,对发酵过程进行及时的反馈调整,如尹孚森生物技术公司(INFORS)的YSI-2980系统(德国)、迪必尔生物的Quiklfow系统(中国)、西尔曼科技的AP-100系统(中国)、天木生物科技有限公司的BODS系统(中国)等,这些集成化在线检测装备极大地提高了发酵罐的运行监测和发酵过程控制效率,解放了人力,同时保证了数据的及时性、准确性和一致性,显著提升发酵效率,对于细胞工厂表型测试和发酵放大具有重要的应用价值。此外,部分在线检测设备具有留样功能,可将发酵罐样品保存至4 ℃环境,方便研究人员对数据进行回溯和重复测量,或将所保留样品进行更复杂的离线检测,如采用色谱法、质谱法、滴定法等方式,以获取更加全面、详细的发酵过程参数。
6 总结与展望
不同尺度和不同通量的生物反应器为合成生物学DBTL循环过程的测试环节提供了重要的表型测试工具,根据不同的实验目的和需求,选取合适类型的测试技术与装备成为细胞工厂构建的关键环节,通常包括单细胞检测与分选和皮纳升级反应器、微升级反应器等进行细胞文库的高通量测试和筛选,而毫升级生物反应器则兼顾细胞工厂的高通量筛选和初步发酵过程工艺开发,升级生物反应器则主要应用细胞的过程工艺开发,本文将上述不同测试装备进行了归纳总结(表1)。
常规的合成生物学测试项目,往往包括联合使用多种技术与装备对细胞进行充分测试,以保证通量和过程工艺的一致性和合理性,提升测试效率。此外,当单细胞存在于皮纳升级生物反应器和微升级生物反应器中时,这种极小的微空间隔离方式可以显著增加细胞密度,体积越小其相对密度越大,且细胞分泌释放的相关因子在细胞周围环境聚集,浓度得到提升,极大地促进细胞生长和代谢,因此该类型生物反应器体积越小,细胞生长越迅速,这种方式称为“随机限域”(stochastic confinement)[133]。在限域空间内,反应分子的扩散和相互作用均受到限制,分子间相互作用加强。同时,限域空间还可以促进反应物分子之间相互接近,从而增加反应的选择性和特异性,这对酶催化反应极为重要。因此,相对于其他尺度较大的生物反应器,皮纳升生物反应器和微升级生物反应器对于微生物的培养和代谢及酶催化反应有着显著优势,日益成为合成生物学的重要研究平台。
近些年作者团队与天木生物科技有限公司紧密合作,研发了一系列用于合成生物学表型测试的高端装备平台,包括基于皮纳升液滴高通量单细胞筛选平台(DREM cell)、基于微升级液滴的单细胞高通筛选平台(MISS cell)及微生物适应性进化系统(MMC)、基于微型管式反应器的毫升级微生物培养和驯化系统(EVOL cell)、基于升级以上规模发酵罐的生物发酵在线监测系统(BODS)等,覆盖了从皮纳升到升级别的多种尺度和通量的生物反应器,构建了系列化的合成生物学表型测试平台,在行业中得到了广泛应用。
多孔板、摇瓶、搅拌釜发酵罐等不同类型的生物反应器发展由来已久,尤其是多孔板生物反应器和装备,现阶段已经实现了自动化和集成化,但同时也遇到了技术升级瓶颈,例如,如何克服孔板氧气传递受限、培养一致性差、通量低等问题,以及如何解决发酵过程的放大(scale-up)和缩小(scale-down)尺度差异等问题。同时全自动化微孔板操作平台需要多套昂贵设备的联动使用,搭建和维护成本高,需要空间大,限制了其推广使用。液滴微流控技术具有操作容易、通量高、液滴培养数字化和易自动化等特点,是适于合成生物学高通量表型测试的颇具广泛应用前景的方法。商业化的装备系统体积小、运行成本低、使用和维护方便,越来越受到广大科研人员和工程技术人员的关注,成为合成生物学发展的智慧平台。目前,液滴微流控技术仍处于产业化上升期,虽然已有部分技术实现了产业化推广,但如何进一步实现微液滴的高度稳定、提升液滴通量的精准可控性、实现微液滴装备的创新定制化以及液滴操作的标准化和自动化等方面仍然存在大量的基础科学和工程科学问题需要深入研究。另外,需要发展更多适用于不同尺度液滴体系的表型测试传感器,显著提升表型表征能力,构建更多维度的基因型-表型模型,为液滴微流控技术在DBTL循环中的应用提供更强大的使能工具,最终实现开发国产替代高通量自动化合成生物设施平台,突破我国生物技术装备研发能力弱、自主创新设备欠缺等“卡脖子”问题,加速我国合成生物技术原始创新步伐,支撑绿色生物经济的高质量发展。

