18β-甘草次酸通过PGK1糖酵解途径抑制oxLDL诱导的血管内皮细胞凋亡研究
韩维维,王 博,钟 晴,张 蓉,徐 驰*
1黑龙江中医药大学临床医学院;2黑龙江中医药大学基础医学院,哈尔滨 150040
动脉粥样硬化(atherosclerosis,AS)是心血管疾病(cardiovascular disease,CVD)的主要危险因素之一。人主动脉内皮细胞(human aortic endothelial cells,HAECs)与AS病变的产生有关[1]。此外,既往研究表明,HAECs的异常迁移、增殖和凋亡与AS的进展密切相关[2]。氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)会损害人主动脉内皮细胞功能并且是促进AS进展的关键危险因素[3]。研究发现糖酵解是参与动脉粥样硬化形成最重要的代谢途径之一[4]。Sarrazy等[5]研究发现动脉粥样硬化小鼠敲低葡萄糖转运蛋白1的表达水平,可提高小鼠对葡萄糖的摄取从而发挥抗动脉粥样硬化的作用。Matsui等[6]研究发现通过抑制葡萄糖-6-磷酸脱氢酶的活性减少糖酵解可降低血管中超氧化物的水平,进而减轻动脉粥样硬化小鼠的损伤,另一研究发现糖酵解途径关键基因PGK1参与ox-LDL诱导的人主动脉内皮细胞凋亡[7]。以上研究结果说明糖酵解途径在动脉粥样硬化病理进程中扮演重要角色。
18β-甘草次酸(18β-glycyrrhetinic acid,GA)是甘草中关键的生物活性成分,具有抗炎症,抗氧化,抗病毒及抗癌等多种药理作用,其中抗氧化的作用尤其显著,与此同时还可以通过生物转化等过程更大限度地发挥积极作用[8]。Wang等[9]研究发现GA可以抑制脂多糖(lipopolysaccharide,LPS)诱导的脐静脉内皮细胞的白介素-6(interleukin-6,IL-6)等炎性细胞因子的分泌及凋亡的发生,提示GA可以抑制内皮细胞的炎症和凋亡。那么GA能否通过糖酵解途径抑制内皮细胞的凋亡进而防治动脉粥样硬化,目前尚未报道。因此本研究基于PGK1介导的糖酵解途径来探讨GA抑制内皮细胞凋亡的分子机制,为AS的防治提供新的思路和科学依据。
1 材料和方法
1.1 主要材料和试剂
原代人主动脉内皮细胞(武汉普诺赛生物技术公司);GA(货号DG0172,质量分数≥98%,成都德思特生物技术有限公司);oxLDL(货号CB82737214,广州奕元生物有限公司);乳酸检测试剂盒(货号A019-2-1,南京建成公司);葡萄糖检测试剂盒(货号S0201S)、CCK8试剂盒(货号C0038)、TUNEL细胞凋亡检测试剂盒(货号C1090)购于碧云天公司;PGK1(货号E9R7O)、GLUT1(货号E4S6I)、HK2(货号C64G5)、PKM2(货号D78A4)Rabbit mAb抗体购于美国Cell-Signaling公司;Bax(货号14-6999-82)Mouse mAb、Bcl2(货号13-8800)Mouse mAb、Caspase-3(货号700182)Rabbit mAb及Caspase-9(货号MA1-12562)Mouse mAb抗体购于美国Thermo Fisher公司。
1.2 主要仪器
CO2恒温孵育箱(MCO-15AC,SANYO公司,日本);多功能酶标仪(FlexStation 3,Molecular Devices,美国)。
1.3 原代人主动脉内皮细胞培养
使用原代人主动脉内皮细胞专用培养基常规培养,包含1%青链霉素、1%原代内皮细胞添加剂及2%胎牛血清作为完全培养基,不含胎牛血清添加的培养基作为同步化培养基,同步化6 h后进行给药处理。
1.4 实验细胞分组
实验分为空白对照组(control,Con)、oxLDL模型组(model,Mod,100 mg/L)、GA治疗组(oxLDL+10 μmol/L,GA-10;oxLDL+20 μmol/L,GA-20;oxLDL+40 μmol/L,GA-40),其中oxLDL处理细胞24 h后,不同浓度的GA再处理24 h。给予PKG1激动剂后分组为空白对照组(control,Con),oxLDL模型组(model,Mod,100 mg/L),GA治疗组(oxLDL+40 μmol/L,GA-40),PKG1激动剂(特拉唑嗪)+GA+oxLDL组(GA+TZ),其中特拉唑嗪和GA共同作用于细胞24 h。
1.5 Western blot法检测蛋白表达
用预冷的PBS清洗用药处理后的主动脉内皮细胞3次,每孔加入60 μL RIPA强裂解液,置于冰上裂解30 min,12 000 r/min收集细胞上清,加入细胞上样缓冲液,100℃煮沸5 min。SDS-PAGE分离蛋白,将蛋白转移至NC膜上,脱脂奶粉封闭1 h,TPBS洗膜3次,分别加入一抗PGK1(1∶500)、GLUT1(1∶1 000)、HK2(1∶1 000)、PKM2(1∶500)、Bax(1∶500)、Bcl2(1∶300)、Caspase-3(1∶500)、Caspase-9(1∶200)及β-actin(1∶2 000),4℃孵育过夜,洗膜后室温孵育二抗(1∶5 000)1 h,洗膜后用成像仪发光拍照。
1.6 TUNEL法检测主动脉内皮细胞凋亡
弃掉细胞上清后,用PBS轻轻冲洗细胞,4%多聚甲醛固定15 min。然后,用TUNEL试剂在37 ℃避光条件下孵育1 h,使其渗透30 min。最后,用DAPI染料标记细胞核。荧光图像采用共聚焦激光扫描显微镜(奥林巴斯,日本)拍摄。红色荧光代表TUNEL标记的标记凋亡细胞的信号。TUNEL标记核的数量(红色)占总DAPI标记核的数量(蓝色)的百分比为凋亡指数。
1.7 CCK-8法检测人主动脉内皮细胞活性
将原代人主动脉内皮细胞接种在96孔板,每孔200 μL培养基并根据不同的GA浓度进行给药,每组设置6个平行复孔,作用24 h后每孔加入10 μL CCK-8溶液,在培养箱中培养1 h,待明显显色后用多功能酶标仪检测在450 nm波长的各组OD值。
1.8 比色法检测内皮细胞葡萄糖和乳酸浓度
去除人主动脉内皮细胞培养液,用PBS清洗三次。加入裂解液充分裂解后,离心取上清作为待测样品,按照试剂盒说明书进行操作,96孔板每孔加200 μL上清液,于630 nm和530 nm波长处分别检测葡萄糖和乳酸吸光度值。
1.9 统计方法

2 结果
2.1 GA对人主动脉内皮细胞活性的影响
CCK-8结果显示GA浓度0、10、20、40、80、160 μmol/L处理内皮细胞时,细胞活性(OD值)分别为0.89±0.07、0.87±0.03、0.83±0.05、0.85±0.04、0.61±0.04、0.52±0.12,其中大于GA浓度大于80 μmol/L时细胞的活性降低(P<0.01),而浓度在10~40 μmol/L时对细胞的活性无影响(P>0.05),因此选用10、20、40 μmol/L分别为低剂量组,中剂量组和高剂量组进行实验。
2.2 GA对oxLDL诱导的血管内皮细胞凋亡的影响
与Con相比,Mod人主动脉内皮细胞Bax、cleaved Caspase-3、cleaved Caspase-9蛋白表达水平及TUNEL凋亡指数明显增加,Bcl2蛋白表达水平明显降低(P<0.05);与Mod相比,GA治疗组(GA-10、GA-20、GA-40)内皮细胞Bax、cleaved Caspase-3、cleaved Caspase-9蛋白表达水平及TUNEL凋亡指数明显降低,Bcl2蛋白表达水平明显增加(P<0.01)(见图1、2)。以上结果说明GA可以抑制oxLDL诱导的人主动脉内皮细胞凋亡。
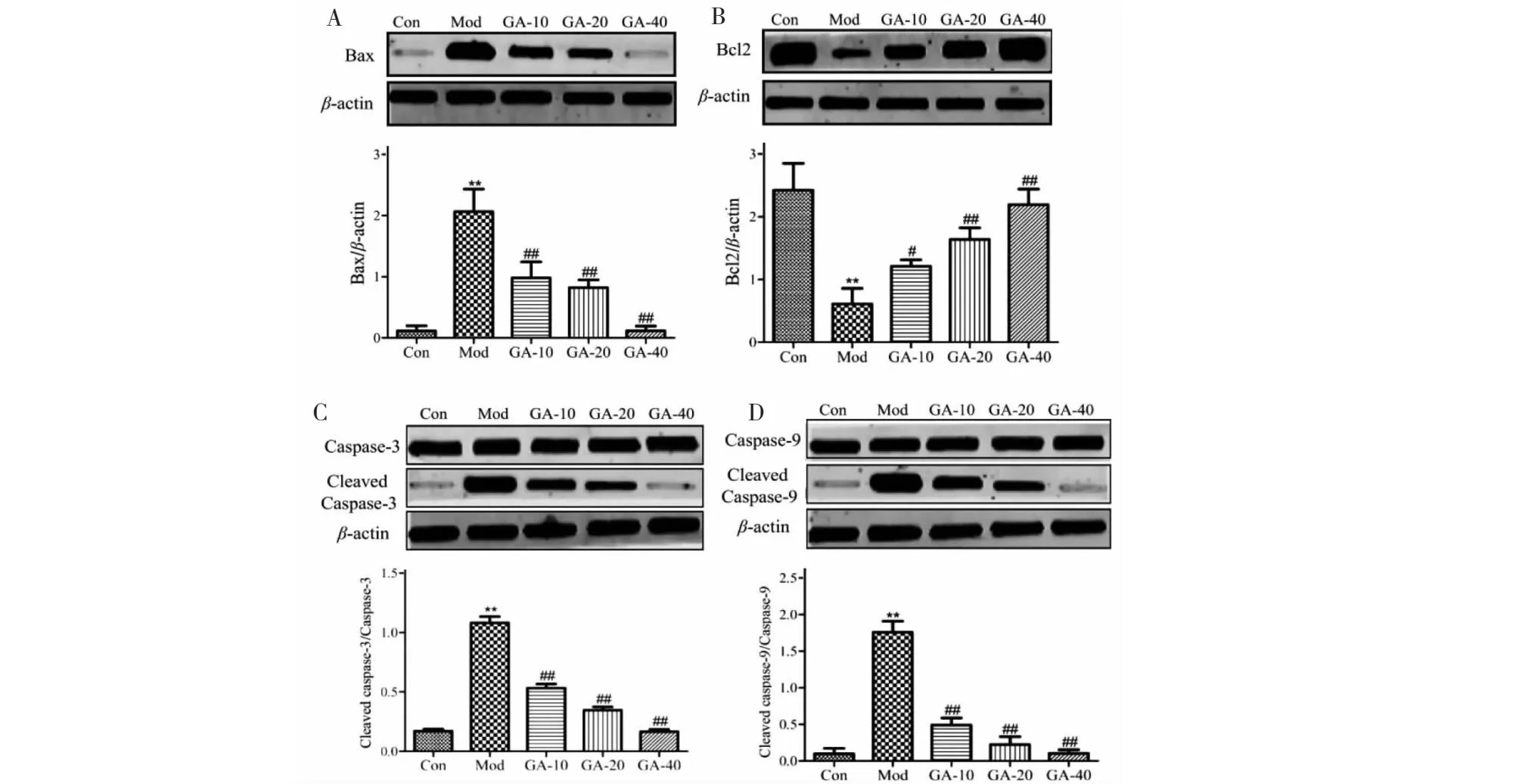
图1 GA对各组细胞凋亡的影响Fig.1 Effect of GA on cell apoptosis in each group
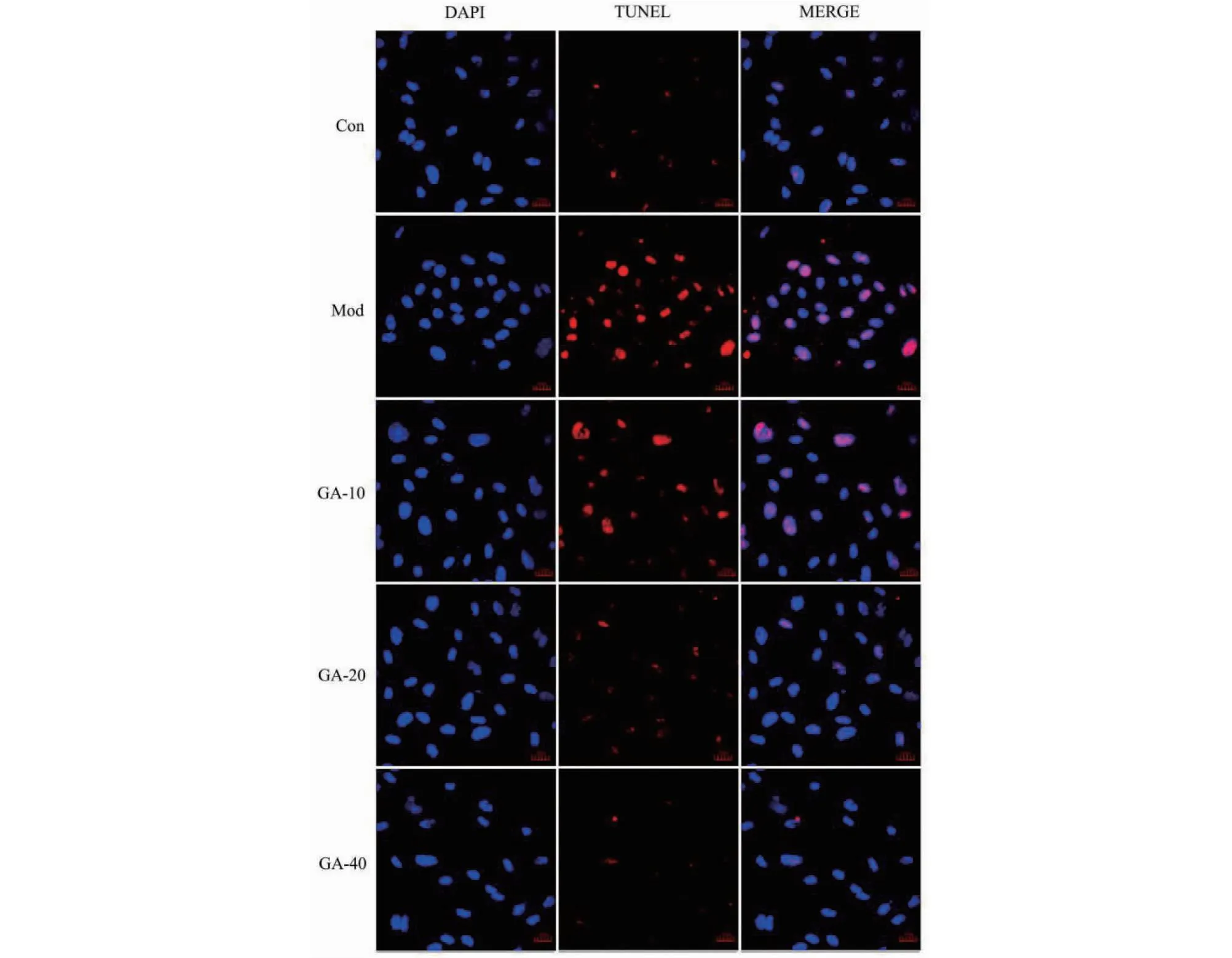
图2 TUNEL法检测凋亡水平Fig.2 Apoptosis level was measured by TUNEL method
2.3 GA对oxLDL诱导的人主动脉内皮细胞糖酵解关键基因PGK1、GLUT1、HK2、PKM蛋白水平的影响
与Con相比,Mod人主动脉内皮细胞PGK1蛋白表达水平明显增加(P<0.01);与Mod相比,GA治疗组(GA-10、GA-20、GA-40)内皮细胞PKG1蛋白表达水平明显下降(P<0.01),并且呈剂量依赖性(见图3)。
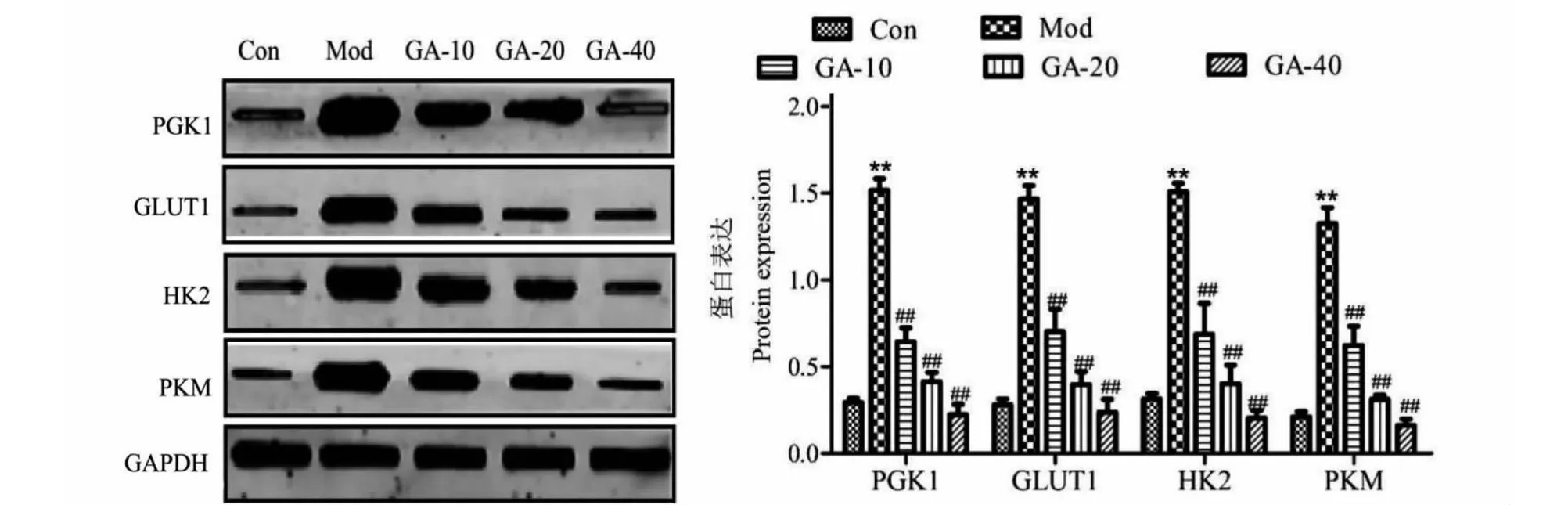
图3 GA对oxLDL诱导的人主动脉内皮细胞糖酵解关键基因PGK1、GLUT1、HK2、PKM蛋白水平的影响Fig.3 Effect of GA on the protein levels of PGK1,GLUT 1,HK2,and PKM,the key glycolysis genes induced by oxLDL in human aortic endothelial cells
2.4 GA对oxLDL诱导的人主动脉内皮细胞葡萄糖消耗和乳酸生成的影响
比色法结果显示,与Con相比,Mod人主动脉内皮细胞葡萄糖消耗量明显降低,乳酸分泌量明显增加(P<0.01);与Mod相比,GA治疗组(GA-10、GA-20、GA-40)内皮细胞葡萄糖消耗量明显上升,乳酸分泌量显著减少(P<0.01),并且呈剂量依赖性(P<0.01)(见图4)。
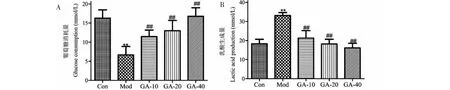
图4 GA对oxLDL诱导的人主动脉内皮细胞葡萄糖消耗和乳酸生成的影响Fig.4 Effect of GA on glucose consumption and lactate production in human aortic endothelial cells induced by oxLDL
2.5 PGK1蛋白激动剂特拉唑嗪对GA抑制oxLDL诱导的血管内皮细胞凋亡作用的影响
与Con相比,Mod人主动脉内皮细胞Bax、cleaved Caspase-3及cleaved Caspase-9蛋白表达水平明显增加,Bcl2蛋白表达水平明显降低(P<0.05);与Mod相比,GA治疗组(GA-40)内皮细胞Bax、cleaved Caspase-3及Cleaved Caspase-9蛋白表达水平明显降低,Bcl2蛋白表达水平明显增加(P<0.01)(见图5),然而加入PGK1蛋白激动剂特拉唑嗪后可以逆转GA的上述作用,提示GA通过抑制PGK1介导的糖酵解通路进而抑制oxLDL诱导的血管内皮细胞凋亡。
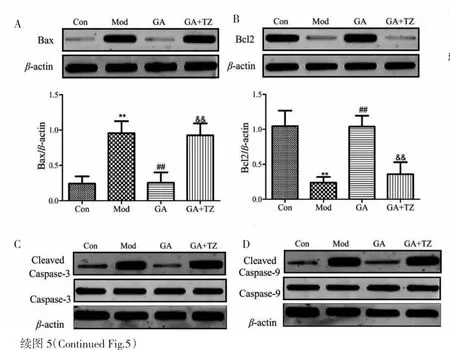
图5 特拉唑嗪对每组凋亡蛋白表达的影响Fig.5 Effect of terrazosin on apoptotic protein expression in each group
3 讨论与结论
近年来研究发现,作为甘草的关键生物活性成分GA对多种心血管疾病具有一定的防治作用。GA通过调控RhoA/Rho激酶通路抑制肺动脉平滑肌细胞增殖进而防治肺动脉高压[10]。Yang等[11]通过代谢组学分析发现GA可通过抗氧化和抗炎作用缓解肺动脉高压大鼠代谢紊乱,提高机体抗缺氧能力,恢复各种代谢途径(能量代谢、氨基酸代谢、脂质代谢)。另外GA还可以通过抑制IP3介导的内皮细胞钙离子信号通路进而调控多种心血管的功能。比如其可以通过减弱细胞内钙过载改善心脏舒张功能,并可以通过调控钙内流介导的p38 MAPK通路进而抑制缺血性心肌细胞凋亡[12,13]。然而GA对AS的防治机制目前尚不清楚。
本研究利用oxLDL处理人主动脉内皮细胞模拟AS体外细胞模型。发现在oxLDL诱导的内皮细胞损伤模型中,促进凋亡指标cleaved Caspase-3、cleaved Caspase-9、Bax及TUNEL水平显著增加,抑制凋亡因子Bcl2的水平显著下调,加入低中高剂量的GA均可以有效抑制促凋亡指标Caspase-3、Caspase-9、Bax及TUNEL的水平,并促进抑制凋亡因子Bcl2的表达,提示GA可以抑制oxLDL诱导的内皮细胞凋亡。进一步研究发现另外,在oxLDL诱导的内皮细胞凋亡模型中,糖酵解关键基因PGK1、GLUT1、HK2及PKM表达水平显著增加,提示在oxLDL诱导内皮细胞凋亡过程中激活了细胞的糖酵解代谢。而加入低中高剂量的GA均可以有效抑制上述糖酵解关键基因的表达水平,说明GA可以抑制oxLDL诱导的内皮细胞的糖酵解途径。多项研究已证实糖酵解是参与动脉粥样硬化形成最重要的代谢途径之一[14-16],而本研究结果也证实了糖酵解参与了oxLDL诱导内皮细胞凋亡过程,并且GA可以抑制oxLDL诱导的内皮细胞的糖酵解途径。本研究进一步还发现加入PGK1激动剂特拉唑嗪后,可以显著逆转GA对oxLDL诱导内皮细胞凋亡的抑制作用,上述研究说明GA通过PGK1介导的糖酵解途径抑制内皮细胞的凋亡。而PGK1是催化糖酵解途径中第一个产生ATP的酶,是介导糖酵解途径的关键基因。Zhang等[7]研究发现oxLDL处理的人主动脉内皮细胞模型中PGK1蛋白表达显著增加,而本研究结果与上述一致,说明PGK1介导的糖酵解途径是动脉粥样硬化发生发展的重要病理机制。
综上所述,本研究发现GA通过抑制PGK1介导的糖酵解通路进而抑制oxLDL诱导的内皮细胞凋亡,为动脉粥样硬化的治疗提供新的思路和靶点。