电针调控PI3K/AKT/mTOR通路改善血管性痴呆大鼠海马神经元炎性和氧化损伤机制
毕珂瑶,李赫妍,苏景超,陶树琴,唐巍
(1.安徽中医药大学,合肥 230038;2.安徽中医药大学针灸经络研究所,合肥 230012)
血管性痴呆(vascular dementia, VD)是由脑血管受损引起的一种以慢性进行性认知能力下降为特征的功能障碍综合征[1]。患者多表现为记忆功能、计算能力、人格、情绪情感、视空间能力等一系列的精神活动受损,执行功能障碍,信息处理速度迟缓。继阿尔茨海默病之后,VD是世界上最普遍的痴呆原因之一,约占所有痴呆症的20%,且发病率不断攀升[2]。目前,针灸被广泛应用于VD的临床治疗,且疗效显著[3-6]。针刺还可抑制慢性脑灌注不足导致的氧化损伤与炎症反应,提升体内抗氧化物水平,降低炎性因子表达,抑制神经损伤[7]。其中,电针通过电流对特定穴位产生刺激,起到改善脑血管损伤并促进认知恢复的作用[8],对VD治疗效果显著,安全性高且不良反应小,可控性高于单纯针刺[9]。大量医学研究[10]均表明,磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase, PI3K)/蛋白激酶B(protein kinase B, AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通路在控制血管生成、调节神经信号转导、细胞增殖、代谢和凋亡等多种生理作用过程活动中发挥不可被忽视的作用,参与缺血性脑损伤、神经退行性疾病等一系列脑部疾病的发生发展。PI3K/AKT/mTOR信号通路由针刺激活后,可促进卒中大鼠血管、神经元和突触的再生,保护神经血管单元[11]。但电针是否能通过调控PI3K/AKT/mTOR信号通路而改善VD患者海马神经元损伤还需进一步证实。本研究基于PI3K/AKT/mTOR通路,探讨电针百会与足三里对VD大鼠的海马神经功能异常的改善作用以及可否降低体内炎症反应、氧化应激水平,为临床电针治疗VD提供实验依据。
1 材料与方法
1.1 实验动物
选取12~15周龄清洁级雄性SD大鼠45只,体质量为(250±20)g,购自济南朋悦实验动物繁育有限公司,实验动物生产许可证号为SCXK(鲁)2019-0003。饲养环境为(23±3)℃、湿度45%~55%,适应性喂养1周,术前禁食不禁水。本实验经安徽中医药大学实验动物伦理委员会批准(伦理号为AHUCM-rats-2021096)。
1.2 主要试剂和仪器
大鼠白介素6(intertleukin 6, IL-6)(JYM0646Ra,南京建成生物工程研究院)、IL-1β(interleukin 1β, IL-1β)(JYM0419Ra,南京建成生物工程研究院)、大鼠谷胱甘肽-过氧化物酶(glutathione peroxidase, GSH-Px)酶联免疫吸附测定试剂盒(JYM1138Ra,南京建成生物工程研究院)、丙二醛(malonaldehyde, MDA)(A003-1-1,南京建成生物工程研究院)、超氧化物歧化酶(superoxide dismutase, SOD)(A001-3-1,南京建成生物工程研究院)检测试剂盒、Nissl染色试剂盒(焦油紫法)(B031,上海碧云天生物技术有限公司)、RIPA细胞裂解液(强)(P0013B,上海碧云天生物技术有限公司)、一抗二抗去除液(P0025,上海碧云天生物技术有限公司)、山羊抗兔IgG(ZB-2301,北京中杉金桥生物有限公司)、预染蛋白Marker(26616,美国Thermo)、ECL(enhanced chemi luminescence, ECL)超敏发光试剂盒(340958,美国Thermo)、PI3K(ab86714,英国Abcam)、p-PI3K(ab182651,英国Abcam)、AKT(4691s,美国CST)、p-AKT(4060s,美国CST)、mTOR(2972s,美国CST)、p-mTOR(5536s,美国CST)、兔抗和辣根过氧化物酶标记的羊抗兔IgG二抗(ZB-2301,北京中杉金桥生物有限公司)、抗小鼠/兔二步法检测试剂盒(B001,安徽欣乐生物技术有限公司)、DAB显色试剂盒(B011,安徽欣乐生物技术有限公司)。一次性使用针灸针(0.25 mm×13 mm,苏州天协针灸器械有限公司)、华佗牌SDZ-Ⅴ型多功能电针治疗仪(苏州医疗用品厂有限公司)、UV-1800型紫外可见分光光度计(上海菁华科技仪器有限公司)、CX41型显微镜(日本OLYMPUS)、EPS300型电泳仪、VE-186型转膜仪(上海天能科技有限公司,Tanon)、JS-1070P型自动曝光仪(上海培清科技有限公司)。
1.3 造模方法及分组
随机选取30只大鼠使用双侧颈动脉结扎法(2-VO)制备VD大鼠模型[12]。大鼠进行麻醉后正中切开颈部皮肤,钝性分离出双侧颈动脉,仔细剥离其迷走神经。将清理过的双侧颈总动脉用5-0丝线双重结扎,缝合后为预防感染,使用碘伏消毒。造模后第3天开始水迷宫试验,每日4次,每次2 min,共5 d。测试第3天,开始记录成绩,如测试第5天,逃避潜伏期仍超过20 s即定为血管性痴呆模型[13]。造模成功后,将这30只大鼠随机分为模型组、电针组,每组15只。剩余15只大鼠为假手术组,仅分离颈动脉不结扎。
1.4 干预方法
造模成功后第3天对电针组大鼠进行治疗。参考华兴邦《大鼠穴位图谱的研制》[14],电针大鼠负极“百会”(顶骨正中,向后斜刺3~4 mm)、右单侧正极“足三里”(膝关节后外侧,在腓骨小头下约5 mm处,左右各一穴,直刺7 mm)。为防止大鼠挣扎时电针脱落,使用大鼠平板式固定器将其固定。电针频率4 Hz/ 20 Hz,强度1~2 mA,以大鼠安静耐受为度,电针20 min;每日1次,连续2周,第7天和第14天间断治疗。其余组不进行电针治疗,相同时间给予等量捉抓刺激。
1.5 Morris水迷宫实验
电针治疗结束后第2天,各组大鼠同时进行水迷宫实验。水迷宫选用直径150 cm、深度50 cm、水深30 cm的圆形黑色水池。将水池等分为4个象限,将1个直径为10 cm的透明平台放置于其中一象限。将水池注满水,确保平台高于水面1 cm,让水温平衡至室温。前4 d为定向航行实验,将大鼠随机由剩余3个象限入水,登上平台停留10 s记为寻台成功,逃避潜伏期记为大鼠入水至寻台成功的时间;若大鼠寻台时间超出60 s,则人工将其放置平台上停留10 s,记录逃避潜伏期为60 s。第5天为空间探索实验,平台撤除后,在剩余3个象限内,将大鼠随机入水,在60 s内,记录大鼠首次穿越原平台的时间。
1.6 取材与指标检测
水迷宫实验结束后,腹腔注射2%戊巴比妥钠麻醉大鼠,将麻醉后大鼠仰卧固定,做腹正中纵切口,分离肠管,暴露腹主动脉,从腹主动脉采血。每组取5只大鼠的海马双侧组织由4%多聚甲醛进行固定,其余海马组织-80 ℃冰箱进行保存。
1.6.1 Nissl染色法观察海马区神经元状态
将海马切片固定包埋后脱蜡冲洗,浸染于56 ℃焦油紫染液中。冲洗干净后再将其静置于Nissl分化液中浸泡数秒(背景接近于无色时停止分化)。脱水后二甲苯透明后封片。光学显微镜下观察,尼氏体示紫色、细胞核示淡紫色。
1.6.2 酶联免疫吸附测定法检测血清GSH-Px、IL-1β和IL-6含量
抽取的大鼠腹主动脉血于室温下放置15 min后,3 000 r/min转速离心20 min,分离上清液,参考GSH-Px和IL-1β、IL-6 酶联免疫吸附测定试剂盒的使用说明书,采用波长450 nm酶标仪读取,得到标准品的浓度和吸光度值后,制成吸光度值标准曲线,使用得出的公式计算IL-1β、IL-6和GSH-Px的含量。
1.6.3 生化检测法检测海马区MDA和SOD含量
根据化学检测试剂盒说明书进行脑匀浆的制备及测定。将各组大鼠断头取脑后称得海马重量,加入符合比例的预冷生理盐水(4 ℃),将组织匀浆器匀浆出的匀浆液以3 000 r/min离心10 min,冷冻保存上清液制成10%的组织匀浆。参考MDA、SOD试剂盒说明书分别对匀浆中MDA和SOD含量进行测定。MDA检测将0.5 mL离心管中加入0.2 mL MDA工作液和0.1 mL上清液,盖上管盖,盖上用针扎一小孔,旋涡混匀器混匀,95 ℃水浴40 min后,冲洗冷却,3 500~4 000 r/min离心10 min,测量上清液532 nm处吸光度。SOD检测将配制后的工作液加入样品中,混合均匀,37 ℃孵育20 min,450 nm处酶标仪读数。
1.6.4 Western blot法检测海马组织中PI3K、AKT、mTOR、p-PI3K、p-AKT及p-mTOR蛋白表达水平
裂解海马组织,提取总蛋白,BCA蛋白定量,对提取总蛋白进行SDS-聚丙烯酰胺凝胶电泳(PAGE)、转膜、抗体封闭,加入GAPDH、PI3K、AKT、mTOR、p-PI3K、p-AKT及p-mTOR一抗工作液(除p-AKT1:2 000外,其余均为1:1 000),在4 ℃下孵育过夜。以二抗(1:20 000)室温孵育l.2 h后,ECL发光试剂盒检测,凝胶成像仪拍照,GAPDH作为内参,Image J软件进行条带灰度值的分析。
1.6.5 免疫组化法检测海马区mTOR阳性表达水平
取上述制备好的海马切片,固定包埋后脱蜡冲洗,高压修复抗原后,室温在3% H2O2溶液中孵育,PBST冲洗3次。滴入山羊血清,37 ℃封闭20 min。滴加一抗mTOR(1:500),4 ℃缓慢摇动孵育过夜。PBST冲洗3次。滴入二抗,37 ℃孵育20 min,PBST冲洗3次。DAB显色后苏木素溶液复染,脱水后封片,光学显微镜观察结果。使用Image-Pro Plus软件分析海马区mTOR免疫组化染色的平均光密度。
1.7 统计学分析
采用SPSS22.0软件对数据进行统计分析。计量资料符合正态分布以均数±标准差表示,多组比较采用单因素方差分析,两两比较采用LSD检验(方差齐时)或Dunnett’s T3(方差不齐时);不符合正态分布比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠空间记忆和学习能力比较
与假手术组比较,模型组逃避潜伏期和空间探索首次跨越秒数明显延长(P<0.01);与模型组比较,电针组逃避潜伏期和空间探索首次跨越秒数明显缩短(P<0.01)。详见表1。
表1 3组大鼠平均潜伏期比较(±s) 单位:s
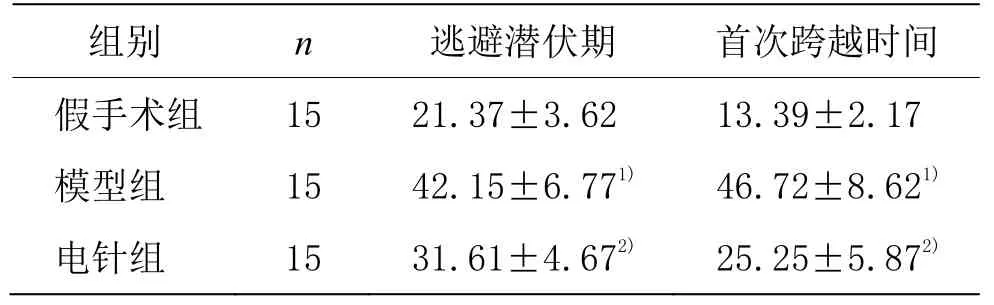
表1 3组大鼠平均潜伏期比较(±s) 单位:s
注:与假手术组比较1)P<0.01;与模型组比较2)P<0.01。
组别 n 逃避潜伏期 首次跨越时间假手术组 15 21.37±3.62 13.39±2.17模型组 15 42.15±6.771) 46.72±8.621)电针组 15 31.61±4.672) 25.25±5.872)
2.2 3组大鼠海马神经元形态比较
Nissl染色结果可见,假手术组神经细胞无明显损伤,尼氏小体清晰可见。与假手术组比较,模型组大鼠神经细胞紧缩,呈空泡性,尼氏小体溶解破碎,数量减少,胞浆深染。与模型组比较,电针组尼氏小体数量增多,细胞固缩减少溶解破碎减轻且形态较好。详见图1。

图1 3组大鼠海马神经元形态比较(×400)
2.3 3组大鼠血清IL-1β、IL-6和GSH-Px含量比较
与假手术组比较,模型组大鼠血清因子IL-1β和IL-6含量显著升高(P<0.01),GSH-Px含量显著下降(P<0.01),与模型组比较,电针组大鼠血清LL-1β和IL-6含量显著降低(P<0.01),GSH-Px含量显著升高(P<0.01)。详见图2。
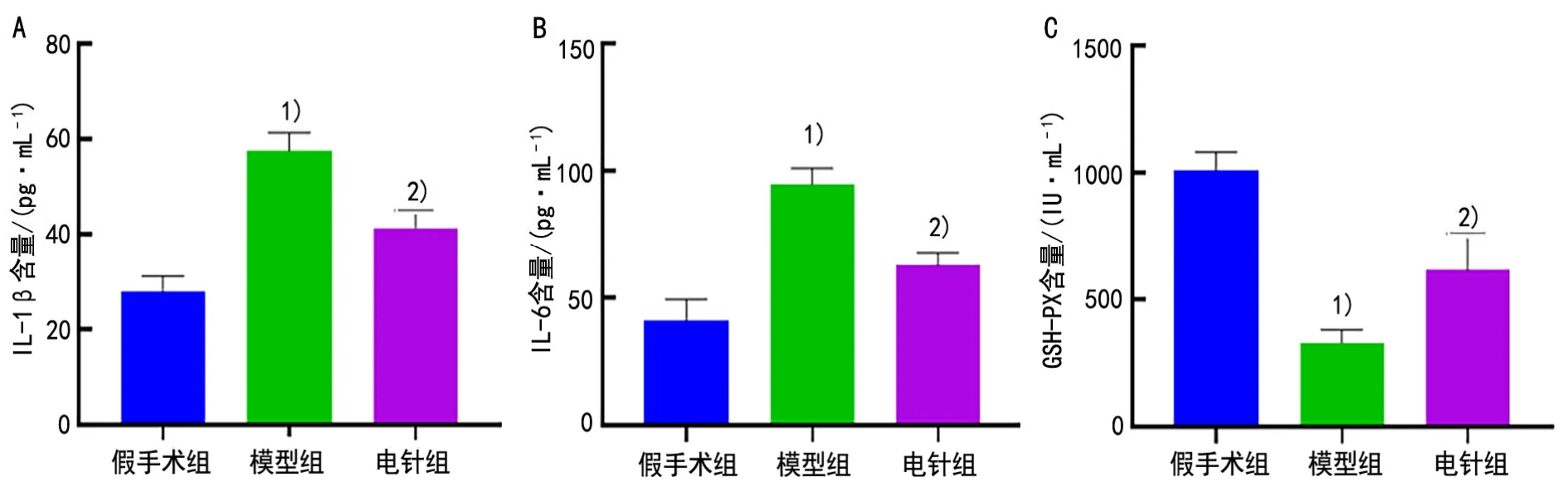
图2 3组大鼠血清IL-1β、IL-6和GSH-Px含量比较(±s, n=15)
2.4 3组大鼠海马MDA和SOD含量比较
与假手术组比较,模型组大鼠海马区MDA含量显著升高,SOD含量显著下降(P<0.01)。与模型组比较,电针干预组大鼠海马区MDA含量显著下降(P<0.01),SOD含量显著升高(P<0.01)。详见图3。

图3 3组大鼠海马MDA和SOD含量比较(±s, n=10)
2.5 3组大鼠海马区p-PI3K、p-AKT及p-mTOR蛋白表达水平比较
与假手术组比较,模型组大鼠海马区p-PI3K、p-AKT、p-mTOR蛋白表达水平显著降低(P<0.01)。与模型组比较,电针组大鼠海马区p-PI3K、p-Akt、p-mTOR蛋白表达水平显著升高(P<0.01)。详见图4。

图4 3组大鼠海马组织中p-PI3K、p-AKT及p-mTOR蛋白表达水平比较(±s, n=10)
2.6 3组大鼠海马组织mTOR蛋白表达比较
镜下可见,mTOR在免疫组织化学染色后显示为棕色或浅黄色,位于细胞质中。mTOR蛋白阳性表达在假手术组大鼠海马神经细胞散在可见。与假手术组比较,模型组mTOR的蛋白表达下降(P<0.01);与模型组比较,电针组mTOR蛋白表达上升(P<0.01)。详见图5。
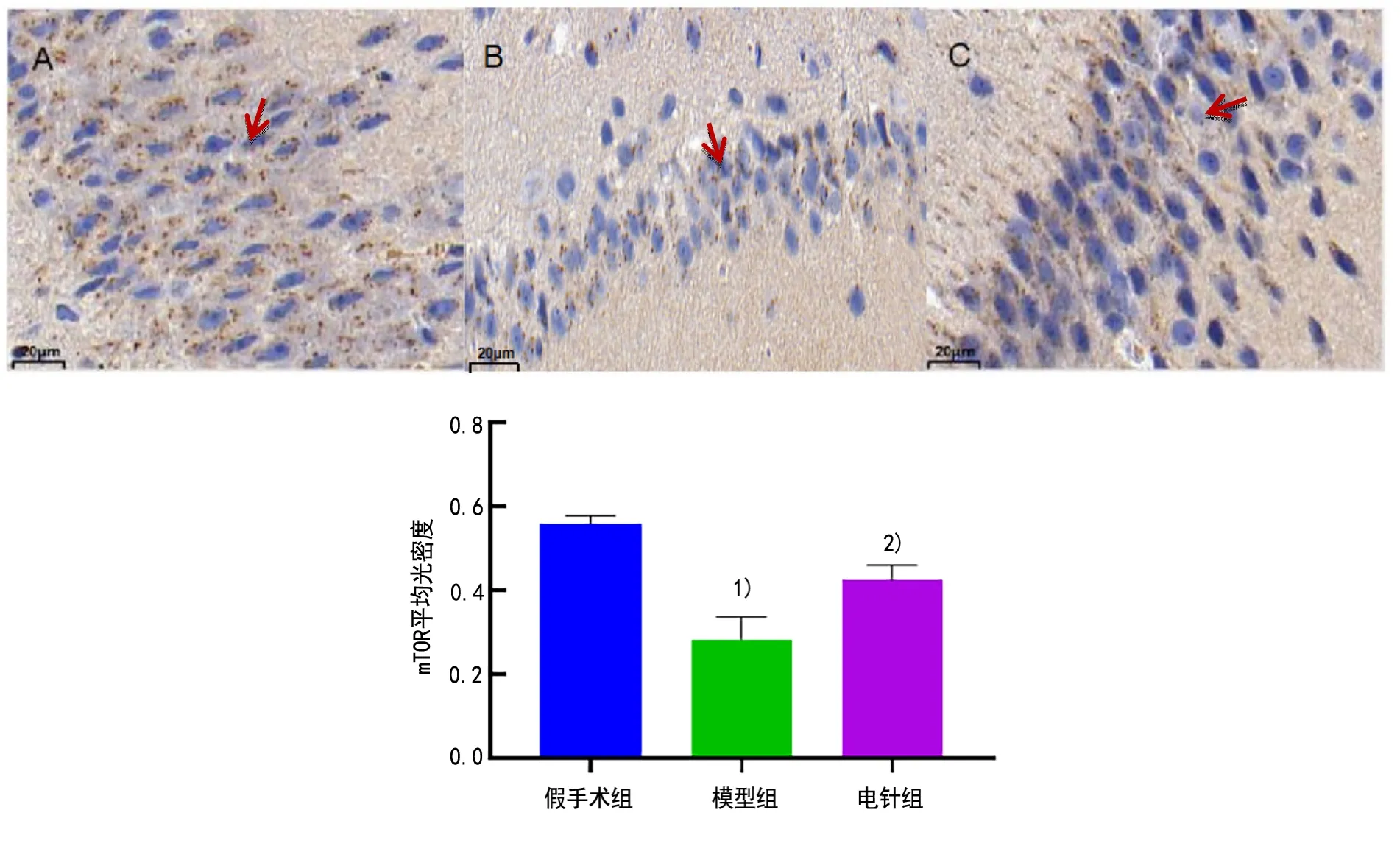
图5 3组大鼠海马组织mTOR表达比较(×500,±s, n=5)
3 讨论
血管性痴呆(VD)属中医学“痴呆”范畴,疾病表现为本虚标实,虚实夹杂,其本为肾精不足,以致脑失滋养,脑髓空虚,其标为气血津液逆乱,以致痰浊蒙窍,瘀阻脑络。标本错杂交互,互为因果。督脉和足阳明胃经皆循行于脑。《灵枢·经脉》:“胃足阳明之脉……循发际,至额颅。”《素问·骨空论》:“督脉者……上额交巅上,入络脑。”所谓经脉所过,主治所及。督脉为“阳脉之海”,上络于脑,可补脑髓之充盈。百会位于巅顶,属督脉之要穴,为百脉之会,素有醒神益智、充养脑髓之效;足三里属足阳明胃经要穴,可补后天之脾胃以滋先天之肾精。故本实验选取足三里与百会相配可达到标本兼治、养精益髓、清浊开窍之效。VD若经过早期有效的治疗,具有一定可逆性[15]。
近年来研究[16]表明,针刺可从多方面改善VD病理进程,抑制大脑神经元的凋亡,缓解脑损伤后的氧化应激和神经元炎性损伤,调节神经递质和葡萄糖的代谢,一定程度提升认知功能,恢复大脑血管功能和突触可塑性。其中,有学者认为血管病变会导致认知能力下降[17],VD大鼠多伴有认知和记忆障碍。由游离核糖体和粗面内质网构成的尼氏小体位于神经元的胞体和树突内,是神经元功能状态的参考标志[18]。VD大鼠的血管损伤是神经元损失和突触解体的主要原因,导致神经系统评分降低并增加梗塞体积、DNA损伤和神经元凋亡[19]。SHANG N等[20]发现长期铝暴露导致神经毒性积累和神经细胞坏死诱发的认知障碍,可以通过上调PI3K/AKT/mTOR通路缓解,mTOR活性是发挥该通路作用的关键因素。PI3K/AKT/mTOR是由PI3K和其下游分子丝氨酸/苏氨酸AKT组成的重要通路[21]。激活的PI3K在细胞膜上产生第二信使磷脂酰肌醇-3,4,5-三磷酸,在细胞中与AKT结合。AKT由细胞膜转移到细胞质内部,被磷酸化和激活,随后其再磷酸化细胞质和细胞核中的一系列底物,其中mTOR是最重要的底物之一[22]。磷酸化的mTOR可直接反应mTOR的活性,mTOR可作用于下游的诸多因子并且调节机体多种细胞过程,如细胞自噬、细胞周期、细胞存活、细胞生长等[23]。有研究[24]发现雷帕霉素可能通过调控PI3K/ AKT/mTOR信号通路抑制神经细胞凋亡和促进线粒体吞噬而发挥改善血管性痴呆后的认知障碍作用。CHEN S等[25]研究发现,通过apoE模拟肽激活脑出血小鼠髓系细胞触发受体,调控下游靶点PI3K/AKT信号通路,可抑制神经炎症和细胞凋亡。本研究Nssil染色结果可见,VD大鼠神经细胞固缩,尼氏小体破碎溶解;电针后神经细胞形态得到明显改善,尼氏小体清晰可见且数量增多,表明大鼠神经元损伤的改善可能与电针上调PI3K/ AKT/mTOR信号通路有关。Morris水迷宫可以测试大鼠海马依赖性学习,包括获得空间记忆和长期空间记忆[26]。本研究显示,电针组大鼠逃避潜伏期和空间探索实验首次跨越秒数显著缩短,表明电针可促进VD大鼠空间记忆和学习能力的恢复。
PI3K/AKT/mTOR信号通路可参与调控脑损伤后的神经元功能障碍,发挥神经保护作用[27]。WANG Y等[28]发现嗅三针干预阿尔兹海默症大鼠,上调PI3K/AKT/mTOR信号通路,可保护海马突触可塑性功能,缓解神经炎症反应和神经细胞凋亡。VD患者血管组织损伤及神经变性影响其先天免疫,激活白细胞和抗原呈递细胞,加剧炎症反应[19]。海马神经炎症是导致VD患者的缺血性损伤的过程之一[29]。IL-1β、IL-6为典型促炎细胞因子,长期产生可在神经细胞与神经纤维束之间的炎症过程中引起细胞毒性作用[30]。此外,研究发现百会透曲鬓头针疗法可减轻大鼠脑出血后血肿周围的炎症反应,显著降低IL-1β、IL-6含量[31]。本实验研究发现,电针上调VD大鼠PI3K/AKT/mTOR信号通路后可显著降低其血清IL-1β、IL-6含量,缓解脑部血管受损后的炎性反应。
氧化应激也是脑缺血类疾病的一个关键特征,内皮一氧化氮合酶和活性氧的结合导致脂质的异常分解,致使有毒产物的沉积,促进了DNA损伤和细胞凋亡[32]。MDA是多不饱和脂肪酸的最终产物[33]。SOD是反映清除氧自由基能力的关键酶。GSH-Px是一种非蛋白质抗氧化剂,经常被用作脂质过氧化物的指标[34]。研究[35]发现,N-金刚烷基-4-甲基噻唑-2-胺通过PI3K/AKT/mTOR信号通路可抑制皮层神经元中自噬细胞死亡,此通路对增强皮层神经元抗氧化酶活性,降低活性氧导致的一系列氧化应激损伤发挥相对的调控作用。慢性脑灌注不足期间脑循环减少可诱导线粒体损伤和功能障碍,提高氧化应激水平[19]。本实验研究发现,电针组大鼠海马区MDA含量降低,SOD、GSH-PX含量增加,氧化损伤得到明显改善;VD大鼠海马区p-PI3K、p-Akt、p-mTOR蛋白表达水平显著降低,电针后大鼠p-PI3K、p-Akt、p-mTOR蛋白表达水平显著升高。VD大鼠电针治疗后,海马区mTOR蛋白表达水平显著增加。可见通过激活PI3K/Akt从而激活mTOR,可缓解VD大鼠海马损伤并改善其认知功能。本实验因未设置通路抑制剂组作为对照,电针对VD大鼠PI3K/AKT/mTOR信号通路的调控作用仍不够确切,稍显欠缺,实验设计仍有较大进步空间。
综上所述,电针可通过上调PI3K/AKT/mTOR通路,保护VD大鼠海马神经元,降低氧化应激与炎症水平,为临床治疗VD提供实验依据。

