载锰单原子纳米酶和驱蛔素的壳聚糖水凝胶制备及其抗幽门螺杆菌活性
张丁丁,郭 荣,赵松峰,段 飞,丁 波,韩冰洁,荆自伟*
1.郑州大学第一附属医院 药学部,河南 郑州 450052
2.河南中医药大学第一附属医院 消化科,河南 郑州 450099
3.河南中医药大学第一附属医院 药学部,河南 郑州 450099
4.郑州大学第一附属医院 转化医学中心,河南 郑州 450052
幽门螺杆菌Helicobacterpylori是导致胃炎、消化性溃疡的主要诱因,同时也是胃癌的第1 类致癌因素[1]。流行病学调查显示,我国自然人群的幽门螺杆菌感染率高达56.22%[2]。2017 年《ACG 临床指南:幽门螺杆菌感染的治疗》推荐标准三联或含铋剂四联疗法作为抗幽门螺杆菌感染的一线治疗方案[3]。然而《第五次全国幽门螺杆菌感染处理共识报告》指出,我国幽门螺杆菌对甲硝唑、克拉霉素和氟喹诺酮类等传统抗菌药物的耐药率逐渐上升,并且二重、三重甚至更多重耐药现象也已出现,使幽门螺杆菌根除率呈下降趋势,感染者存在严重疾病风险[4-5]。
纳米酶(nanozyme)是一类既有纳米材料的独特性能,又有催化功能的模拟酶,目前,纳米酶已被认为是一类有前途的抗菌剂[6-7]。基于过氧化物酶(peroxidase,POD)和氧化物酶(oxidase,OXD)等多酶催化活性,纳米酶触发的化学动力治疗可以催化内源性过氧化氢(H2O2),产生活性氧[如羟基自由基和超氧阴离子等],实现广谱的抗菌治疗,同时避免常规药物的耐药性[8]。受天然酶结构启发,研究人员通过模拟其金属-Nx活性单元,陆续开发出锰、钴、铂、铁单原子纳米酶等[9]。单原子纳米酶具有可设计的几何结构和电子配位、独特的量子尺寸效应和最大限度的原子利用效率[9-10]。Zhu 等[11]采用PEG 修饰中空的锰单原子纳米酶(manganese single-atom nanozymes,MnSAE),呈现出高度分散的锰原子位点、无定形结构、自然价态Mnδ,同时具有类过氧化氢酶(catalase,CAT)、OXD 和POD活性,可发生级联催化反应,产生丰富的活性氧,用于杀伤肿瘤细胞[11]。
中医药在根除幽门螺杆菌感染方面具有不良反应少、耐药性低、不易引起肠道菌群失调、与化学药联用能够提高根除率并降低复发、改善临床症状等优势[12]。土荆芥ChenopodiumambrosioidesL.是中成药荆花胃康胶丸的一味主药,用于治疗幽门螺杆菌感染所致的胃炎、胃溃疡等,对胃食管返流病、功能性消化不良等也有较好的疗效[12]。张学智课题组[13-14]发现荆花胃康胶丸原料药和土荆芥具有显著的体外抗幽门螺杆菌作用,与抗菌药物联用后,抗菌效果显著增强。聂小妮等[15]研究证实,我国9 省12 个产区的土荆芥挥发油的化学成分主要为驱蛔素(ascaridole,Asc)、α-松油烯、p-伞花烃和冰片烯等。采用UHPLC-Q-Orbitrap HRMS 技术对土荆芥甲醇提取物进行定量,发现驱蛔素在土荆芥中质量分数为25.7%。
因此,将纳米生物医学和土荆芥的现代化研究相结合,能够成为治疗幽门螺杆菌感染可行的策略之一。幽门螺杆菌表达一类尿素膜通道蛋白(urea membrane channel protein,Ure I),能够选择性地将宿主代谢产生的尿素(urea)转运到胞内,被胞质中的脲酶(urease)分解为氨和二氧化碳,中和胃酸,从而保护细菌免受胃酸的破坏。基于“Urea-Ure I”理论,本课题组前期构建一系列以脲基(urea-)为靶头、Ure I 为受体的壳聚糖靶向纳米粒,用于幽门螺杆菌感染的靶向治疗,显示出良好的pH 敏感性、胃黏附性、Ure I 靶向性和抗菌活性[16-18]。进一步地,本课题首先制备脲基修饰的壳聚糖(chitosan,Cs)靶向材料,然后构建具有靶向作用和胃黏附特性的水凝胶,共载单原子纳米酶和驱蛔素,通过化学动力和化学治疗的协同作用,发挥优异的抗菌活性。本研究为幽门螺杆菌的根除治疗提供一种新的思路,具有重要的研究价值和临床意义。
1 仪器与材料
1.1 仪器
OTF-1200X 型管式炉,沈阳科晶自动化设备有限公司;AL104 型万分之一分析天平,瑞士Mettler Toledo 公司;AVANCE NEO 400M 型核磁共振波谱仪,德国Bruker 公司;Nicolet iS20 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪、Multiskan SkyHigh 型多功能酶标仪,美国Thermo Fisher Scientific 公司;Gemini SEM 300 型扫描电子显微镜(scanning electron microscope,SEM),德国ZEISS 公司;Tecnai F20 型透射电子显微镜(transmission electron microscope,TEM),美国FEI 公司;TMS-PRO 型质构仪,北京盈盛恒泰科技有限责任公司;F98 型荧光分光光度计,上海精密仪器有限公司;UV-1800PC 型紫外-可见分光光度计,上海美西乐仪器有限公司;LSM 980 激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM),德国ZEISS 公司。
1.2 材料与试剂
壳聚糖,95%脱乙酰度,黏度100~200 mPa·s,分析纯,上海阿拉丁生化试剂公司;NH2-PEGCOOH,相对分子质量2 000,上海炎怡生物技术有限公司;尿素、2-甲基咪唑、邻苯二甲酸酐、十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、四水合氯化锰(MnCl2·4H2O)、对苯二甲酸(TA)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDCI],分析纯,上海麦克林生化科技有限公司;Zn(NO3)2·6H2O,分析纯,郑州派尼化学试剂厂;驱蛔素,分析纯,美国City Chemical LLC公司;邻苯二甲酸酐,化学纯,上海萨恩化学技术有限公司;水合肼,化学纯,天津富宇精细化工有限公司;3,3′,5,5′-四甲基联苯胺(TMB)、1,3-二苯基异苯并呋喃(DPBF),分析纯,北京索莱宝科技有限公司。
幽门螺杆菌SS1 菌株,由西安交通大学曹永孝教授惠赠;人正常胃黏膜上皮GES-1 细胞,美国ATCC 细胞库。
2 方法与结果
2.1 脲基PEG 壳聚糖材料(Urea-PEG-Cs,UPCs)的合成与表征
2.1.1 UPCs 的合成 由图1 可知,UPCs 的合成包括2 部分。第1 步,尿素与NH2-PEG-COOH 通过取代反应合成中间体化合物Urea-PEG-COOH;第2步,首先采用邻苯二甲酸酐对壳聚糖的C2-氨基进行保护合成PACs,之后其C6-羟基和Urea-PEGCOOH 发生酯化反应生成Urea-PEG-PACs,最后利用水合肼脱去邻苯二甲酸酐,得到UPCs。

图1 UPCs 的合成路线Fig.1 Synthetic route of UPCs
将9.29 mmol 的NH2-PEG-COOH 溶于15 mL无水吡啶中,再加入9.75 mmol 的尿素连续搅拌,回流反应24 h,冷却后析出结晶产物,经滤过、蒸馏水洗涤,乙醇重结晶,得到Urea-PEG-COOH。
将6.14 mmol 的壳聚糖加入到50 mL 的95%DMF/H2O 混合溶剂。加热搅拌下加入18.42 mmol的邻苯二甲酸酐。回流反应5 h 后停止,将反应液倒入冰水中,充分析出沉淀后抽滤,60 ℃真空干燥箱中干燥,得到邻苯二甲酸酐修饰的壳聚糖(PACs)。称取1.69 mmol 的Urea-PEG-COOH 加入25 mL 的DMF。室温搅拌后加入1.69 mmol 的NHS和1.69 mmol 的EDCI。反应2 h 后加入16.9 mmol的PACs。继续搅拌72 h 后停止反应,抽滤,用甲醇洗涤滤饼。放入60 ℃真空干燥箱中干燥,得到Urea-PEG-PACs。将上述Urea-PEG-PACs放入15 mL的DMF 中,之后加入45 mL 的水合肼,加热回流7 h 后停止,将反应液倒入冰水中析出沉淀,抽滤,用蒸馏水和乙醇洗涤滤饼。放入60 ℃真空干燥箱干燥,得到产物UPCs。
2.1.2 UPCs 的1H-NMR 和FTIR 表征
(1)1H-NMR:使用400 MHz 核磁共振波谱仪对Urea-PEG-COOH 进行核磁共振氢谱(1H-NMR)分析。取5 mg 的UPCs 用CF3COOD/D2O 溶解,于25 ℃下进行1H-NMR 分析。1H-NMR 图谱(图2-a)显示,壳聚糖骨架C1的H 出峰位置在δ4.32~4.52,Urea-PEG-COOH 连接臂的亚甲基的特征峰在δ1.53~1.71 处出现。

图2 UPCs 的1H-NMR (a) 和FTIR (b) 表征Fig.2 1H-NMR (a) and FTIR (b) characterization of UPCs
(2)FTIR:使用FTIR 仪对UPCs 进行表征。取适量UPCs 与溴化钾混合,使用研钵充分研磨至粉末状,并进行压片处理。用FTIR 仪对样品进行扫描,扫描范围为400~4 000 cm−1。由FTIR 图谱(图2-b)可见,在1 636~1 655 cm−1可观察到脲基(urea-)的特征吸收峰。由此推断,靶向的脲基头部成功地连接到壳聚糖骨架上,其结构与目标物结构一致。
2.2 共载锰单原子纳米酶(Mn single-atom nanozyme,MnSAE)的制备
MnSAE 的制备方法见文献报道[11]。将60 mg 的ZnNO3·6H2O 和2 mg 的CTAB 溶于适量水溶液,然后加入到含有908 mg 的2-甲基咪唑的水溶液中,室温条件下剧烈搅拌2 h,制备ZIF-8 立方体结构。取上述得到的20 mg 的ZIF-8 加入适量去离子水中,超声10 min 得到均一分散的溶液,加入2 mL 的25 mg/mL 的鞣酸溶液,室温条件下继续搅拌2 h,经13 000 r/min 离心10 min,水洗3 次后冷冻干燥,得到空心的ZIF-8 纳米立方体。取20 mg 空心的ZIF-8 分散于10 mL 去离子水中,超声10 min 形成均一分散的溶液,缓慢加入10 mg/mL 的MnCl2·4H2O 水溶液,室温条件下继续搅拌3 h。将反应液13 000 r/min 离心10 min,水洗后冷冻干燥,得到Mn-ZIF-8。上述产物放入管式炉中,以5 ℃/min 的速度升温至900 ℃并在氩气保护下维持2 h,后自然降至室温,得到MnSAE。
2.3 壳聚糖靶向水凝胶的制备
称取120 mg 的UPCs 加入到4 mL 的1%盐酸溶液中,充分溶解,使其质量浓度为30 mg/mL。将5 mg 的MnSAE+5 mg 的驱蛔素分散到UPCs 溶液中,震荡混匀。即得到Asc/MnSAE@UPCs 水凝胶,冷冻干燥,放入4 ℃冰箱中,备用。
另外,分别用壳聚糖替代UPCs,驱蛔素、MnSAE 替代MnSAE+驱蛔素,制备壳聚糖水凝胶、Asc@UPCs 水凝胶、MnSAE@UPCs 水凝胶、Asc/MnSAE@Cs 水凝胶作为后续实验对照。
2.4 MnSAE 和壳聚糖靶向水凝胶的形态学表征
2.4.1 SEM 观察 通过SEM 观察水凝胶的内部形貌。将冻干后的水凝胶切片制样,用导电胶固定在铜片上,真空条件下将其表面均匀喷金,在加速电压为20 kV 条件下用SEM 观察并拍照。
2.4.2 TEM 观察 利用TEM 观察MnSAE 和水凝胶的形貌和主要元素分布。将Asc/MnSAE@UPCs水凝胶重分散在水溶液中,之后滴到400 目铜网上,静置一段时间,样品用2%磷钨酸钠负染5 min,自然风干,置于TEM 下观察MnSAE 和水凝胶形态,并用X 射线能谱仪进行元素分布(energy dispersive X-ray spectroscopy mapping,EDS-mapping)分析。
2.4.3 MnSAE 和Asc/MnSAE@UPCs 水凝胶的形态学表征结果 TEM 结果提示,MnSAE 为空心的立方体结构,能够更好地吸附锰元素,保证锰单原子的最大利用效率(图3-a)。SEM 和TEM 结果表明,Asc/MnSAE@UPCs 水凝胶为多层大孔结构(图3-b、c)。

图3 MnSAE 的TEM 图 (a) 及Asc/MnSAE@UPCs 水凝胶的SEM 图 (b)、TEM 图 (c) 和元素分布结果 (d~i)Fig.3 TEM image of MnSAE (a), and SEM image (b), TEM image (c), and EDS mapping results (d−i) of Asc/MnSAE@UPCs hydrogels
通过元素分布结果可知,水凝胶中主要含有C、N、O、Mn 和Zn 元素,5 种元素均匀分布在水凝胶中,此外,经计算Mn 元素质量分数为0.36%,证实MnSAE 成功结合到水凝胶中(图3-d~i)。
2.5 统计学方法
采用SPSS 21.0 进行数据分析。所有数据均表示为±s。应用单因素方差分析比较各组水凝胶溶胀度、黏附强度、对GES-1 细胞增殖影响和体外抗菌活性。P<0.05 时,表示差异具有统计学意义。
2.6 Asc/MnSAE@UPCs 水凝胶的体外释药研究
取经冷冻干燥的Asc/MnSAE@UPCs 水凝胶30 mg,放入预先处理过的透析袋(截留相对分子质量7 000),分别放于含有100 mL 不同pH 值的溶液(pH 1.2 醋酸溶液和pH 6.0、pH 7.4 PBS 缓冲液)中。设置恒温水浴振荡器的水浴温度为(37.0±0.5)℃,振荡频率为100 r/min,分别于0、0.5、1.0、2.0、4.0、8.0、12.0、18.0、24.0 h 取样2 mL 并补充等量同温度的溶出介质。采用UHPLC-Q-Orbitrap HRMS 定量分析驱蛔素含量并计算累积释放率。
Asc/MnSAE@UPCs 水凝胶在不同pH 值缓冲液中的释放曲线见图4。可知Asc/MnSAE@UPCs 水凝胶对驱蛔素的释放具有缓释作用。与pH 6.0 和pH 7.4 的PBS 缓冲液相比,驱蛔素在pH 1.2 的醋酸溶液中的释放更快,提示其具有pH 敏感性,说明壳聚糖靶向材料/β-甘油磷酸钠水凝胶在酸性环境中具有更为疏松的凝胶网络结构,有利于驱蛔素从水凝胶中释放到酸性的幽门螺杆菌感染部位,从而发挥治疗作用。

图4 Asc/MnSAE@UPCs 水凝胶的释药曲线 (±s , n = 3)Fig.4 Release curves of ascaridole from Asc/MnSAE@UPCs hydrogels (±s , n = 3)
2.7 水凝胶的体外溶胀研究
通过测定水凝胶的平衡溶胀度来评价其溶胀性能。首先,称取20 mg 的冻干水凝胶(Wdry),置于含有30 mL PBS 的烧杯中,达到溶胀平衡。然后用滤纸除去溶胀的水凝胶表面的水分,并称定质量(Wswollen),每组水凝胶重复测量3 次,计算水凝胶的溶胀度。
溶胀度=(Wswollen-Wdry)/Wdry
壳聚糖水凝胶浸泡在液体环境中会不断吸水溶胀,直至达到溶胀平衡,这是水凝胶的一个重要特征,反映了水凝胶的含水量和保水能力,也有利于所载药物的缓慢释放。从表1 水凝胶的溶胀度结果可知,未经修饰和载药的壳聚糖水凝胶的平衡溶胀度较高,达到14.89%。采用Urea-PEG-COOH 修饰壳聚糖、载MnSAE 和/或驱蛔素,均会使水凝胶的溶胀度轻度降低至10%左右,这可能与其内部交联结构有关。
表1 水凝胶的溶胀度 (±s, n = 3)Table 1 Swelling ratio of hydrogels (±s , n = 3)

表1 水凝胶的溶胀度 (±s, n = 3)Table 1 Swelling ratio of hydrogels (±s , n = 3)
组别 溶胀度/%壳聚糖水凝胶 14.89±1.98 Asc@UPCs 水凝胶 10.68±0.99 MnSAE@UPCs 水凝胶 9.53±2.31 Asc/MnSAE@Cs 水凝胶 11.14±1.53 Asc/MnSAE@UPCs 水凝胶 10.22±2.21
2.8 水凝胶的体外黏附研究
通过质构仪评价水凝胶的体外黏附性能。取6.0 cm×2.0 cm 长条状的新鲜猪皮,将水凝胶放置在两块猪皮之间,使其重叠区域面积为2.0 cm×1.0 cm,并在室温条件下放置1 h 完全成胶。然后使用质构仪测量其拉力,拉力传感器量程为50 N,速率为10 mm/min,每组水凝胶重复测量3 次,计算水凝胶的黏附强度。实验结果见表2。
表2 水凝胶的黏附强度 (±s, n = 3)Table 2 Adhesion strengths of hydrogels (±s , n = 3)
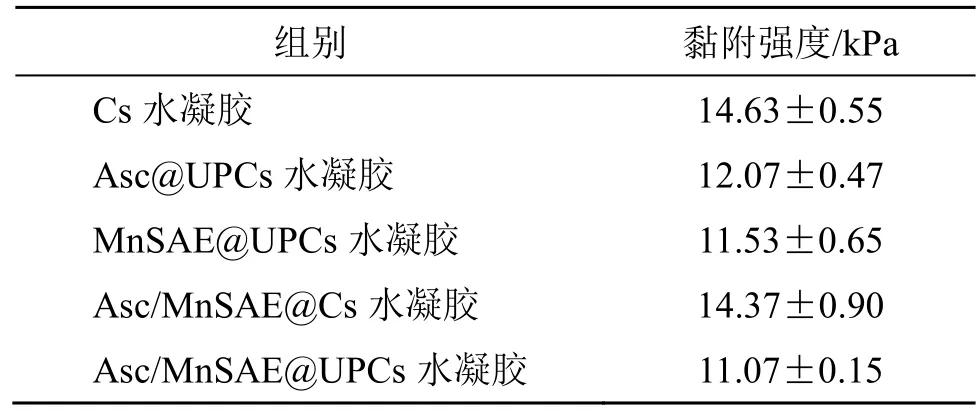
表2 水凝胶的黏附强度 (±s, n = 3)Table 2 Adhesion strengths of hydrogels (±s , n = 3)
组别 黏附强度/kPa Cs 水凝胶 14.63±0.55 Asc@UPCs 水凝胶 12.07±0.47 MnSAE@UPCs 水凝胶 11.53±0.65 Asc/MnSAE@Cs 水凝胶 14.37±0.90 Asc/MnSAE@UPCs 水凝胶 11.07±0.15
黏附强度=最大拉力/最初接触面积
壳聚糖水凝胶和Asc/MnSAE@Cs 水凝胶的黏附强度相对较高,分别为14.63、14.37 kPa。而Asc@UPCs 水凝胶、MnSAE@UPCs 水凝胶和Asc/MnSAE@UPCs 水凝胶的黏附强度轻度下降,分别为12.07、11.53、11.07 kPa。整体来看,制备的水凝胶含有丰富的羟基、氨基、羧基等基团,可以通过氢键黏附在皮肤上,展现出优异的黏附性,可延长其在胃黏膜处的滞留时间,提高纳米酶和驱蛔素在感染部位的浓度。
2.9 类酶活性评价
2.9.1 POD活性 采用TMB催化底物验证MnSAE的POD 活性[19]。在室温条件下,向200 µL 的pH 5.5 的缓冲液中加入MnSAE(Mn 终质量浓度为0、3.75、7.50、15.00、22.50、30.00 µg/mL),再加入10µL 的400 µg/mL 的TMB 的溶液,最后加入32 µL 1%的H2O2溶液,使用多功能酶标仪记录20 min 内不同体系在652 nm 波长处的吸光度(A)值。
2.9.2 OXD 活性 TMB 也可被OXD 氧化后产生蓝色物质,在652 nm 处有最大吸收,用于评价MnSAE 的OXD 类酶活性。取不同质量浓度的MnSAE(Mn 终质量浓度为0、2.00、2.67、4.00、8.00、16.00 μg/mL)加入到pH 5.5 的缓冲液中,1 min 后加入10 µL 的400 µg/mL 的TMB 的溶液,室温反应20 min,利用酶标仪测定652 nm 处的A值。
2.9.3 羟基自由基生成 使用TA 光致发光法检测羟基自由基的生成[6]。0.1 mol/L 的H2O2、0.5 mmol/L对苯二甲酸和Asc/MnSAE@UPCs 水凝胶(MnSAE质量浓度为50 µg/mL)在室温下于0.01 mol/L 的HAc-NaAc 缓冲液(pH 5.5)中培养30 min。采用荧光分光光度计来测量反应体系在410 nm 波长处的A值。
2.9.4 超氧阴离子生成 同时使用DPBF 作为捕获剂检测超氧阴离子的生成[20]。将Asc/MnSAE@UPCs 水凝胶(MnSAE 质量浓度为50 µg/mL)、0.1 mol/L 的H2O2和25 μg/mL 的DPBF 在0.01 mol/L的HAc-NaAc 缓冲液(pH 5.5)中室温条件下孵育30 min。用紫外-可见分光光度计测量420 nm 波长处的A值。
2.9.5 酶催化活性结果 类酶催化活性是纳米酶实现高效抗菌活性的前提。POD 酶可通过类Fenton 反应催化H2O2分解为羟基自由基,使TMB 转化为蓝色氧化物。由图5-a 可知,TMB 氧化物的产生在一定范围内随着MnSAE 质量浓度和时间的增加而增加。OXD 也可直接将TMB 氧化为为蓝色产物。同样的,MnSAE 的OXD 产物在一定范围内与其质量浓度也呈正相关性(图5-b)。上述实验证实了MnSAE的POD 和OXD 活性。进一步地,分别使用对苯二甲酸和DPBF 作为捕获剂检测Asc/MnSAE@UPCs水凝胶产生羟基自由基和超氧阴离子的能力。羟基自由基可以将非荧光的对苯二甲酸氧化为具有荧光的2-羟基对苯二甲酸,图5-c 可看出随着时间的增加,荧光强度逐渐增大,表明羟基自由基的生成。此外,超氧阴离子可漂白DPBF 在420 nm 波长处的荧光。与壳聚糖水凝胶相比,Asc/MnSAE @UPCs水凝胶的荧光剧烈下降(图5-d)。上述结果证实了羟基自由基和超氧阴离子的生成。

图5 Asc/MnSAE@UPCs 水凝胶的类酶催化活性Fig.5 Multienzyme-like catalytic activities of Asc/MnSAE@UPCs hydrogels
2.10 水凝胶的体外安全性评价研究
利用细胞增殖检测试剂盒(CCK-8)检测Asc/MnSAE@UPCs 水凝胶对人正常胃黏膜上皮细胞GES-1 细胞的影响。取对数生长期的GES-1 细胞,以5×104/孔的细胞密度接种于96 孔板,与不同质量浓度的Asc/MnSAE@UPCs 水凝胶共孵育24 h。除去96 孔板中旧的培养基,用PBS 洗1 遍,加入120 µL 培养基稀释的CCK-8 试剂,37 ℃避光孵育2 h,使用酶标仪在450 nm 波长处检测A值。每组设置6 个复孔,并将PBS 处理的细胞组作为空白对照组,计算细胞活力平均值。结果如表3 所示。与对照组相比,当壳聚糖水凝胶和UPCs 水凝胶的质量浓度达到200 µg/mL 时,对GES-1 细胞的活性影响没有统计学差异(P>0.05)。经进一步计算,壳聚糖水凝胶和UPCs 水凝胶的半数抑制浓度(half maximal inhibitory concentration,IC50)值均大于4.7×106µg/mL,证实制备的水凝胶在使用范围内没有明显的毒性。壳聚糖、β-甘油磷酸钠、PEG 等都是安全低毒的生物材料,因此制备的水凝胶表现出良好的生物相容性。
表3 水凝胶对GES-1 细胞增殖的影响 (±s, n = 6)Table 3 Effect of hydrogel on proliferation of GES-1 cells(±s , n = 6)

表3 水凝胶对GES-1 细胞增殖的影响 (±s, n = 6)Table 3 Effect of hydrogel on proliferation of GES-1 cells(±s , n = 6)
水凝胶质量浓度/(μg∙mL−1)细胞存活率/%壳聚糖水凝胶 UPCs 水凝胶0 100.00±5.48 100.00±3.79 5 97.57±3.72 96.32±4.38 10 94.21±1.21 92.36±2.20 50 92.88±2.12 89.74±3.60 100 90.92±6.05 86.91±1.48 200 85.54±7.55 83.95±1.80
2.11 水凝胶的抗幽门螺杆菌活性研究
利用平板计数法检测水凝胶的体外抗菌活性[21]。取对数生长期的幽门螺杆菌调节600 nm 波长处A值为0.1(1×106cfu/mL)。取稀释好的600 μL 幽门螺杆菌混悬液,分别加入600 μL 样品(壳聚糖水凝胶、Asc@UPCs 水凝胶、MnSAE@UPCs 水凝胶、Asc/MnSAE@Cs 水凝胶、Asc/MnSAE@UPCs 水凝胶),在37 ℃恒温摇床中60 r/min 摇动,每组样品3 次重复。分别孵育12、24、36 h 后,将各样品均稀释10 000 倍,接种到幽门螺杆菌选择性固体培养基中培养,形成菌落并计数。水凝胶的抗菌活性如表4所示。制备的载药水凝胶的抗幽门螺杆菌活性具有时间相关性。此外,与对照组相比,壳聚糖水凝胶几乎没有抗菌活性。然而,Asc@UPCs 水凝胶和MnSAE@UPCs 水凝胶组的幽门螺杆菌菌落数明显降低(P<0.05)。尤其需要指出的是,共载MnSAE和驱蛔素的Asc/MnSAE@UPCs 水凝胶显示出最优异的抗菌活性,显示出化学动力治疗和化学治疗的协同抗菌作用。并且,该组抗菌活性显著高于未经Urea-PEG-COOH 修饰的Asc/MnSAE@Cs 水凝胶组(P<0.05),进一步证实了脲基修饰的壳聚糖水凝胶的靶向递送和抗菌效果。
表4 水凝胶的体外抗幽门螺杆菌活性 (±s, n = 3)Table 4 In vitro anti-H.pylori activities of hydrogels(±s , n = 3)

表4 水凝胶的体外抗幽门螺杆菌活性 (±s, n = 3)Table 4 In vitro anti-H.pylori activities of hydrogels(±s , n = 3)
组别 幽门螺杆菌菌落数/cfu 12 h 24 h 36 h对照 1 032±75 1 094±86 1 107±69壳聚糖水凝胶 1 023±58 1 039±79 1 052±75 Asc@UPCs 水凝胶 797±81## 643±55## 573±85##MnSAE@UPCs 水凝胶 622±54## 537±42## 429±52##Asc/MnSAE@Cs 水凝胶 461±63## 298±63## 256±49##Asc/MnSAE@UPCs 水凝胶 293±36##** 92±46##** 77±67##*
与对照组比较:##P<0.05;与Asc/MnSAE@Cs 水凝胶组比较:*P<0.05 **P<0.01。##P < 0.05 vs control group; *P < 0.05 **P < 0.01 vs Asc/MnSAE@Cs hydrogels group.
2.12 水凝胶的体外活性氧检测
取600 μL 的600 nm 波长处A值为0.1 的幽门螺杆菌混悬液,与600 μL 样品(壳聚糖水凝胶、Asc@UPCs 水凝胶、MnSAE@UPCs 水凝胶、Asc/MnSAE@Cs 水凝胶、Asc/MnSAE@UPCs 水凝胶)在37 ℃恒温摇床中孵育24 h。离心后弃去上层培养液,用PBS 冲洗3 遍后加入1 mL 的2′,7′-二氯荧光素二乙酸酯(DCFH-DA),37 ℃避光孵育30 min。之后用PBS 洗3 遍,重新分散到100 μL 的PBS 中,滴加到载玻片上,甘油封片,用CLSM 观察活性氧的生成。利用CLSM观察水凝胶生成活性氧的能力。DCFH-DA 探针进入幽门螺杆菌后,可被酯酶水解生成DCFH,活性氧能够氧化非荧光的DCFH 产生具有绿色荧光的DCF。DCF 的荧光强度与细菌内活性氧水平成比。如图6 所示,加入MnSAE 的水凝胶组均产生活性氧,尤其是Asc/MnSAE@UPCs 水凝胶的活性氧含量最高,与前述抗菌活性结果保持一致。

图6 水凝胶治疗后幽门螺杆菌生成活性氧的结果Fig.6 Reactive oxygen species generation results of H.pylori after treatment with hydrogels
3 讨论
具有黏附性和高生物相容性的壳聚糖水凝胶在制备抗幽门螺杆菌递药系统方面具有广阔的应用前景。本课题将纳米生物医学和中药材土荆芥的现代化研究相结合,制备共载MnSAE 和驱蛔素的壳聚糖水凝胶。通过表征证实了水凝胶的形态和元素组成,并对其体外释药、溶胀度和黏附性和体外安全性、抗菌活性进行评价,以期为幽门螺杆菌感染的根除治疗提供一种新的思路。
尿素是幽门螺杆菌胃内定植和生存的关键外源物质。幽门螺杆菌细胞膜表面的尿素通道蛋白Ure I 能够特异性地将宿主氨基酸代谢产生的尿素分解为氨和二氧化碳,中和胃酸,使细菌周围的pH 值升高,从而保护细菌免受胃酸的破坏[22]。基于“Urea-Ure I”理论设计抗幽门螺杆菌递药系统已经得到证实,展示出良好的Ure I 靶向性和抗菌活性[16-18,23]。众所周知,壳聚糖骨架上具有高反应活性的C2-氨基和C6-羟基,易于进行各种修饰到壳聚糖,且C2-氨基活性高于C6-羟基。从增加成胶性能和维持递药系统表面电荷角度出发,本课题选择将Urea-PEG-COOH 修饰到壳聚糖的C6-羟基。经过1H-NMR和FTIR 证实,所得UPCs 结构与目标化合物一致。此外,体外抗菌活性和细菌内活性氧检测实验也证实了经 Urea-PEG-COOH 修饰的 Asc/MnSAE@UPCs 水凝胶具有更好的幽门螺杆菌靶向抗菌效果。
在MnSAE 的制备过程中,选择金属有机骨架ZIF-8 作为前驱体,采用鞣酸刻蚀其内核,使其成为中空的立方体结构,有利于Mn2+最大程度的均匀分布在ZIF-8 框架的外层。然后采用高温热解的方式破坏其晶体结构,使其成为无定型的C-N 结构,Mn2+变为自然价态,锚定在C-N 结构上,成为MnSAE。通过类酶活性表征,结果证实包载MnSAE的水凝胶具有POD 和OXD 活性,能够产生羟基自由基和超氧阴离子,和土荆芥的中药单体成分驱蛔素协同发挥优异的化学动力、化学治疗的协同抗菌作用。下一步,拟开展相关动物实验评价其体内抗菌活性,并通过体内活体成像、蛋白组学、16S rRNA等技术研究水凝胶的胃黏附特性、抗菌机制和对肠道菌群的影响,证实其在抗幽门螺杆菌治疗方面的科学价值和临床意义。
利益冲突所有作者均声明不存在利益冲突

