AP2M1抑制弥漫性大B细胞淋巴瘤细胞增殖和侵袭
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是一种起源于B淋巴细胞的恶性肿瘤[1],也是全球常见的侵袭性非霍奇金淋巴瘤(non-Hodgkin′s lymphoma,NHL)类型,约占所有NHL患者的1/3[2]。DLBCL的主要治疗方案为全身化学治疗(化疗),一线化疗方案为环磷酰胺/阿霉素/长春新碱/强的松[3]。尽管现有的治疗方案使60%~70%的DLBCL患者得到有效治疗,但DLBCL的5年生存率仍然很低,仍有30%~40%的患者出现化学治疗耐药、复发和转移[4]。因此,有必要探索新的诊断和治疗靶点以提高患者的生存时间。接头相关蛋白质复合体2亚基μ1(adaptor related protein complex 2 subunit μ1,AP2M1)是接头蛋白质复合体2(adaptor protein complex 2,AP-2)家族,也是一种膜蛋白质,参与网状蛋白质的内吞作用[5]。AP2M1的表达水平与DLBCL患者的总体生存率呈正相关,AP2M1高表达的DLBCL患者的总体生存率高于低表达患者[6]。然而,目前尚不清楚AP2M1在DLBCL中的具体功能。AP2M1对胆囊癌细胞中的磷酸化的表皮生长因子受体(epithelial growth factor receptor,EGFR)表达具有抑制作用[7]。EGFR是一种跨膜酪氨酸激酶受体,与细胞外配体结合形成二聚体,使细胞内结构域磷酸化,随后磷酸化并激活磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K),导致PI3K/蛋白质激酶B(protein kinase B,Akt)信号的激活[8]。EGFR/PI3K/AKT信号通路是一种重要的癌调节通路[9]。本研究旨在揭示AP2M1基因对DLBCL细胞增殖和侵袭的影响,并分析其对EGFR/PI3K/AKT信号通路的调控作用。
1 材料与方法
1.1 材料
1.1.1 实验试剂:Lipofectamine 2000(Invitrogen公司);RPMI-1640培养基(Sigma-Aldrich公司);四甲基偶氮唑盐(MTT)、Matrigel(北京索莱宝科技有限公司);Annexin V-FITC细胞凋亡检测试剂盒、Trizol、BeyoRT Ⅱ M-MLV反转录酶(RNase H-)、BeyoFast SYBR Green One-Step RT-qPCR Kit试剂盒、ECL(碧云天生物技术研究所);Bcl-2、p-PI3K、p-AKT一抗(Cell Signaling Technology公司);Bax、基质金属蛋白质酶(MMP)-2、MMP-9、AP2M1、EGFR、PI3K、AKT、β-actin一抗和山羊抗兔IgG H&L(HRP)二抗(Abcam公司)。
1.1.2 细胞和动物:人弥漫性大B细胞淋巴瘤细胞系OCI-LY8(ATCC公司)。SPF级BALB/c雄性裸鼠(体质量18~22 g,7~8周龄)[西安交通大学实验动物中心,生产许可证:SCXK(陕)2020-001]。
1.1.3 患者标本的采集:共收集空军军医大学第二附属医院血液内科收治的弥漫性大B细胞淋巴瘤患者的34份DLBCL组织(设为DLBCL组)和21份反应性淋巴结增生(reactive hyperplasia of lymph node,RLH)组织(设为RLH组)。所有受试患者采集组织标本前均未接受相关治疗。所有受试者均签署受试研究知情同意书,本研究经空军军医大学第二附属医院伦理委员会批准(审批编号:TD-LXY-2020-0126-L05)。
1.2 方法
1.2.1 细胞的分组和感染处理:将OCI-LY8细胞共分为5组:对照组(control)、NC-shRNA组、AP2M1-shRNA组、NC-LV组和AP2M1-LV组。根据试剂盒使用说明步骤,使用Lipofectamine 2000对OCI-LY8细胞进行细胞转染。对照组细胞不进行感染处理,NC-shRNA组细胞转染阴性对照shRNA慢病毒,AP2M1-shRNA组细胞感染AP2M1 shRNA慢病毒,NC-LV组细胞感染阴性对照过表达慢病毒、AP2M1-LV组细胞感染AP2M1过表达慢病毒。shRNA及慢病毒均委托上海吉玛制药技术有限公司合成。感染48 h后进行后续实验。
1.2.2 MTT法检测细胞增殖:将100 μL对数增殖期的OCI-LY8细胞(2×103个)加入96孔板中,在37 ℃和5% CO2条件下培养48 h。每孔加入10 μL的MTT溶液(5 mg/mL)继续孵育4 h。去除上清液并加入150 μL的DMSO溶解结晶。酶标仪中测量570 nm处吸光度值(A值)。
1.2.3 流式细胞仪检测细胞凋亡:将对数增殖期的OCI-LY8细胞用PBS溶液(pH 7.5)重悬处理,取1×105个OCI-LY8细胞接种在6孔板中,加入5 μL的annexin V-FITC和5 μL 的PI,室温避光孵育5 min处理。在BD FACSCalibur流式细胞仪上分析细胞凋亡水平。
1.2.4 Transwell小室法检测细胞迁移和侵袭:迁移实验中,用200 μL不含FBS的RPMI-1640培养基重悬对数生长期的OCI-LY8细胞(1×104个),然后加入Transwell上室中,Transwell下室添加800 μL含20% FBS的RPMI-1640培养基。培养48 h后,用棉签擦去未迁移的细胞,然后用4%多聚甲醛固定30 min,1%结晶紫染色15 min。显微镜下计数迁移的细胞。侵袭实验中,首先使用50 μL 250 μg/mL的Matrigel包被Transwell上室,其他步骤同迁移实验处理。
1.2.5 RT-qPCR检测mRNA表达:使用Trizol从组织标本和OCI-LY8细胞中提取总RNA,用分光光度法定量RNA浓度。BeyoRT Ⅱ M-MLV反转录酶(RNase H-)用于制备cDNA。采用BeyoFast SYBR Green One-Step RT-qPCR Kit试剂盒在ABI 7500实时荧光定量PCR仪上进行PCR。反应条件为:95 ℃ 30 s;40个循环(95 ℃ 5 s,60 ℃ 34 s)。β-actin为内源性对照,采用2-ΔΔCt方法计算基因相对表达量。引物序列如下:AP2M1正向5′-TTGATG ACTGCACCTTCCAC-3′和反向5′-TGTCCTTGGTTGT GCGATAC-3′;β-actin正向5′-CTCCAGGCAGTTCG GCAACCTATCCT-3′和反向5′-ACTGCGTTATTCGG TCGCAGCAG-3′。
1.2.6 Western blot检测蛋白质表达:使用RIPA分离OCI-LY8细胞和肿瘤组织的总蛋白质。BCA试剂盒定量蛋白质浓度,然后使用10%~12%的SDS-PAGE分离蛋白质并转移到PVDF膜上,5%脱脂牛奶4 ℃封闭膜12 h后,将膜与Bcl-2、Bax、MMP-2、MMP-9、AP2M1、EGFR、p-PI3K、PI3K、p-AKT、AKT和β-actin一抗(稀释比为1∶1 000)在4 ℃孵育过夜,随后与山羊抗兔IgG H&L(HRP,稀释比为1∶1 000稀释)二抗在室温下孵育2 h。通过ECL显影,ImageJ软件定量条带密度。β-actin为内源性对照。
1.2.7 裸鼠移植瘤模型的建立及治疗处理:将裸鼠在SPF条件下饲养1周,然后随机分为阴性对照过表达慢病毒(R-NC-LV)组和AP2M1过表达慢病毒(R-AP2M1-LV)组,每组6只。两组裸鼠分别皮下注射100 μL NC-LV和AP2M1-LV的OCI-LY8细胞悬液(5×106个)。使用游标卡尺测量肿瘤体积。28 d后颈椎脱臼处死裸鼠,分离肿瘤并进行称重。
1.2.8 免疫组织化学检测:分离的裸鼠肿瘤组织用4%多聚甲醛固定,常规制作4 μm石蜡切片。切片脱蜡和水化后,用10 mmol/L柠檬酸钠缓冲液煮沸30 min进行抗原修复,正常山羊血清中封闭30 min后与AP2M1和EGFR一抗(稀释比为1∶200)在4 ℃下孵育过夜,然后与山羊抗兔IgG H&L(HRP,稀释比为1∶200)二抗于室温孵育1 h。DAB显色,苏木精复染,显微镜下观察阳性染色情况。
1.3 统计学分析
2 结果
2.1 DLBCL组织和RLH组织中AP2M1的表达水平
DLBCL组中AP2M1的mRNA相对表达量为0.44±0.16,显著降低于RLH组的1.00±0.23(t=9.853,P<0.001)。
2.2 AP2M1对OCI-LY8细胞增殖和凋亡的影响
与对照组相比,AP2M1-shRNA组的相对细胞活力升高(P<0.05),AP2M1-LV组的相对细胞活力降低(P<0.05)(图1A)。与对照组相比,AP2M1-shRNA组中AP2M1的mRNA和蛋白相对表达量均降低(P<0.05),AP2M1-LV组中AP2M1的mRNA和蛋白相对表达量均升高(P<0.05)(图1B~D)。

A.relative cell viability in each group; B-D.AP2M1 mRNA and protein expression in OCI-LY8 cells of each group; *P<0.05 compared with control group and NC-shRNA group; #P<0.05 compared with control group and NC-LV group.
与对照组相比,AP2M1-shRNA组的细胞凋亡率降低(P<0.05),AP2M1-LV组的细胞凋亡率升高(P<0.05)(图2A, B)。与对照组相比,AP2M1-shRNA组的Bcl-2蛋白相对表达量升高(P<0.05),Bax蛋白相对表达量降低(P<0.05);与对照组相比,AP2M1-LV组的Bcl-2蛋白相对表达量降低(P<0.05),Bax蛋白相对表达量升高(P<0.05)(图2C~E)。
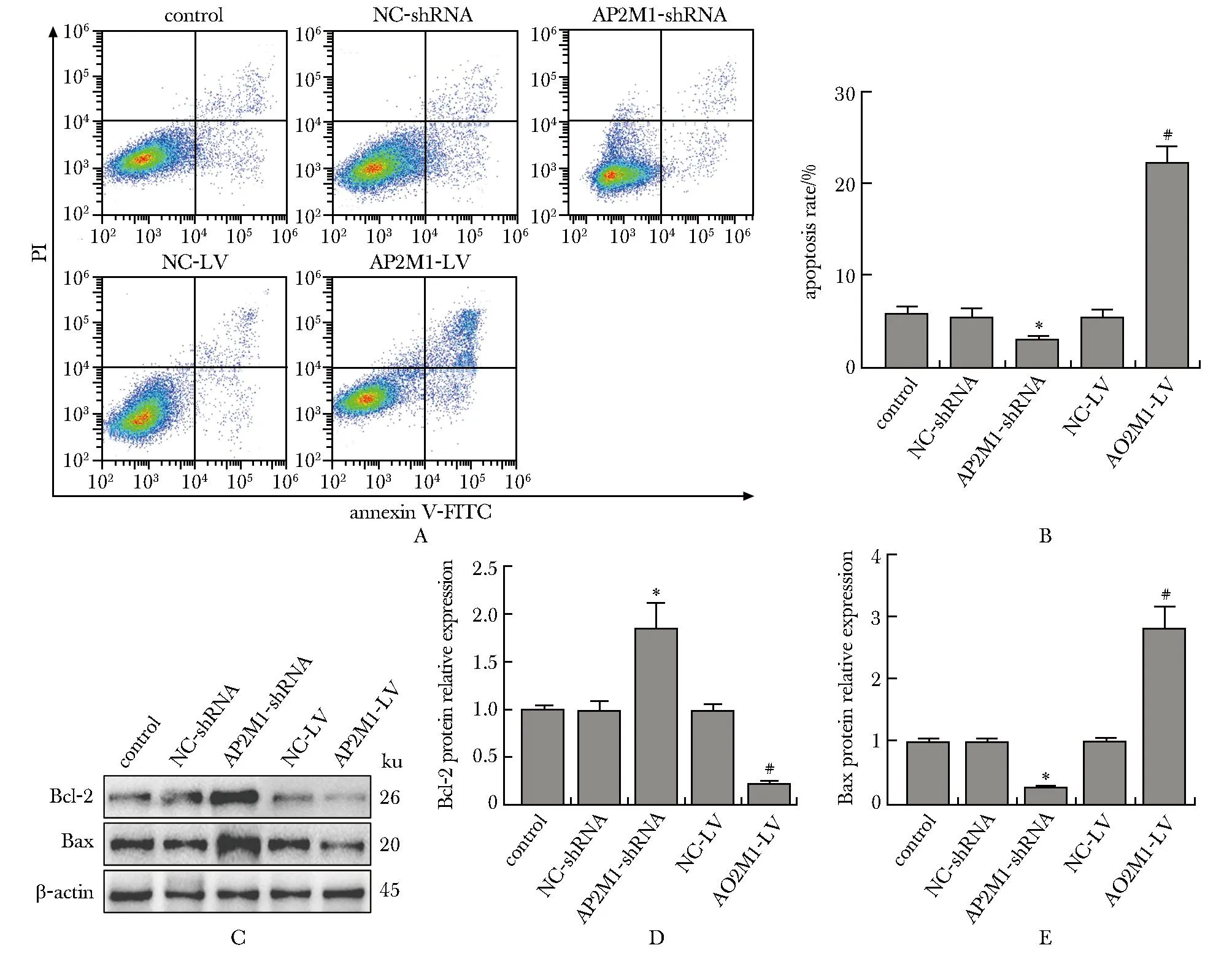
A,B.apoptosis of OCI-LY8 cells detected by flow cytometry; C-E.protein expression of apoptosis-related proteins Bcl-2 and Bax in each group of cells; *P<0.05 compared with control group and NC-shRNA group; #P<0.05 compared with control group and NC-LV group.
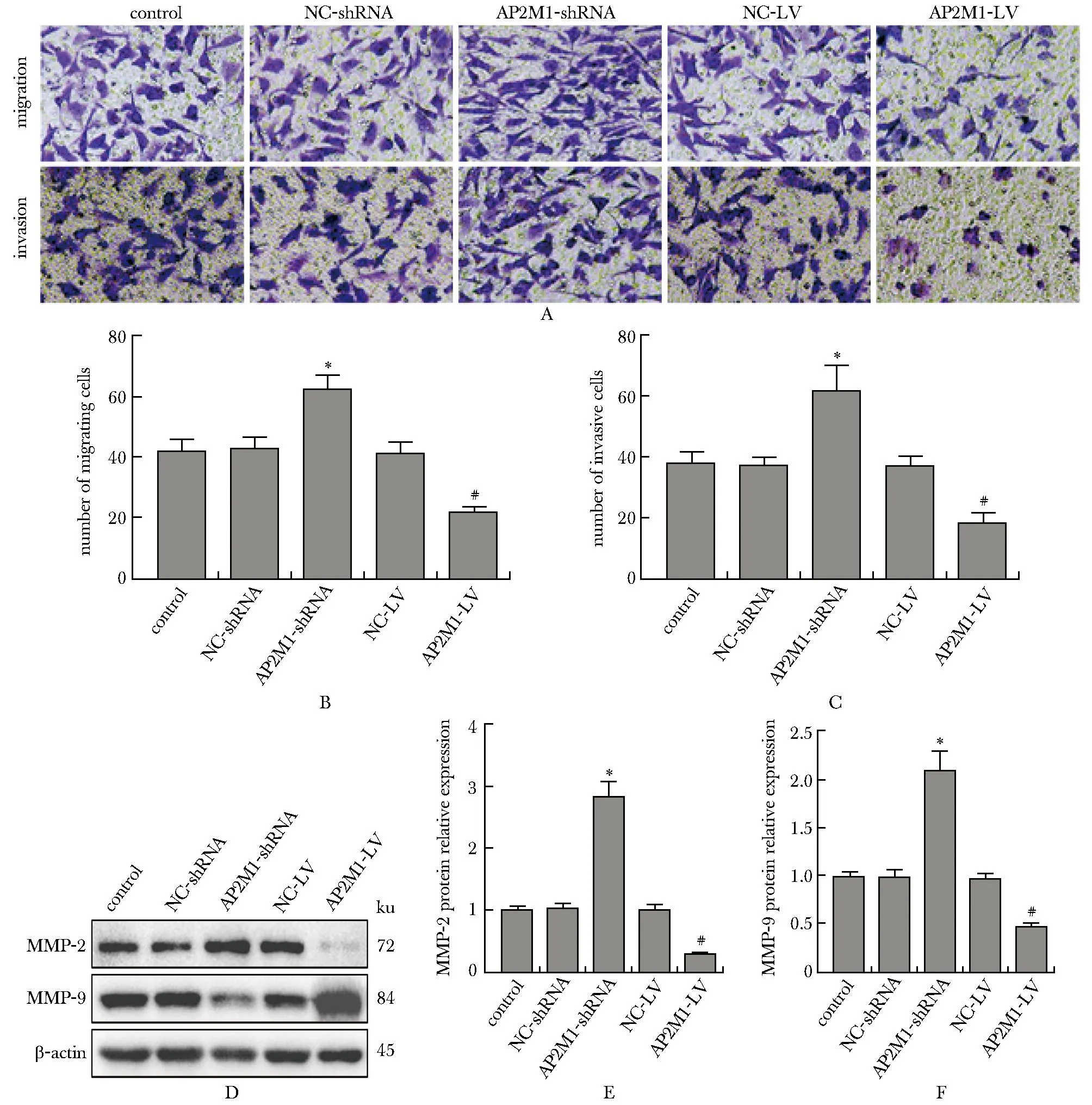
A-C.migration and invasion of OCI-LY8 cells detected by Transwell assay(×400); D-F.protein expression of migration and invasion-related proteins MMP-2 and MMP-9 in cells of each group; *P<0.05 compared with control group and NC-shRNA group; #P<0.05 compared with control group and NC-LV group.
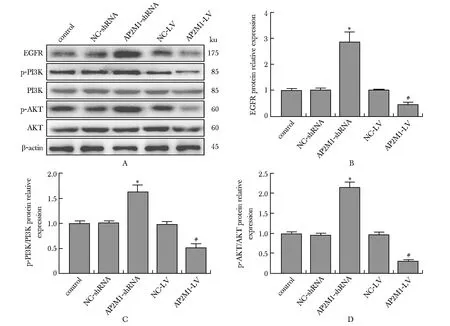
A-D.protein expression of EGFR and the phosphorylation of PI3K and AKT in cells of each group; *P<0.05 compared with control group and NC-shRNA group; #P<0.05 compared with control group and NC-LV group.
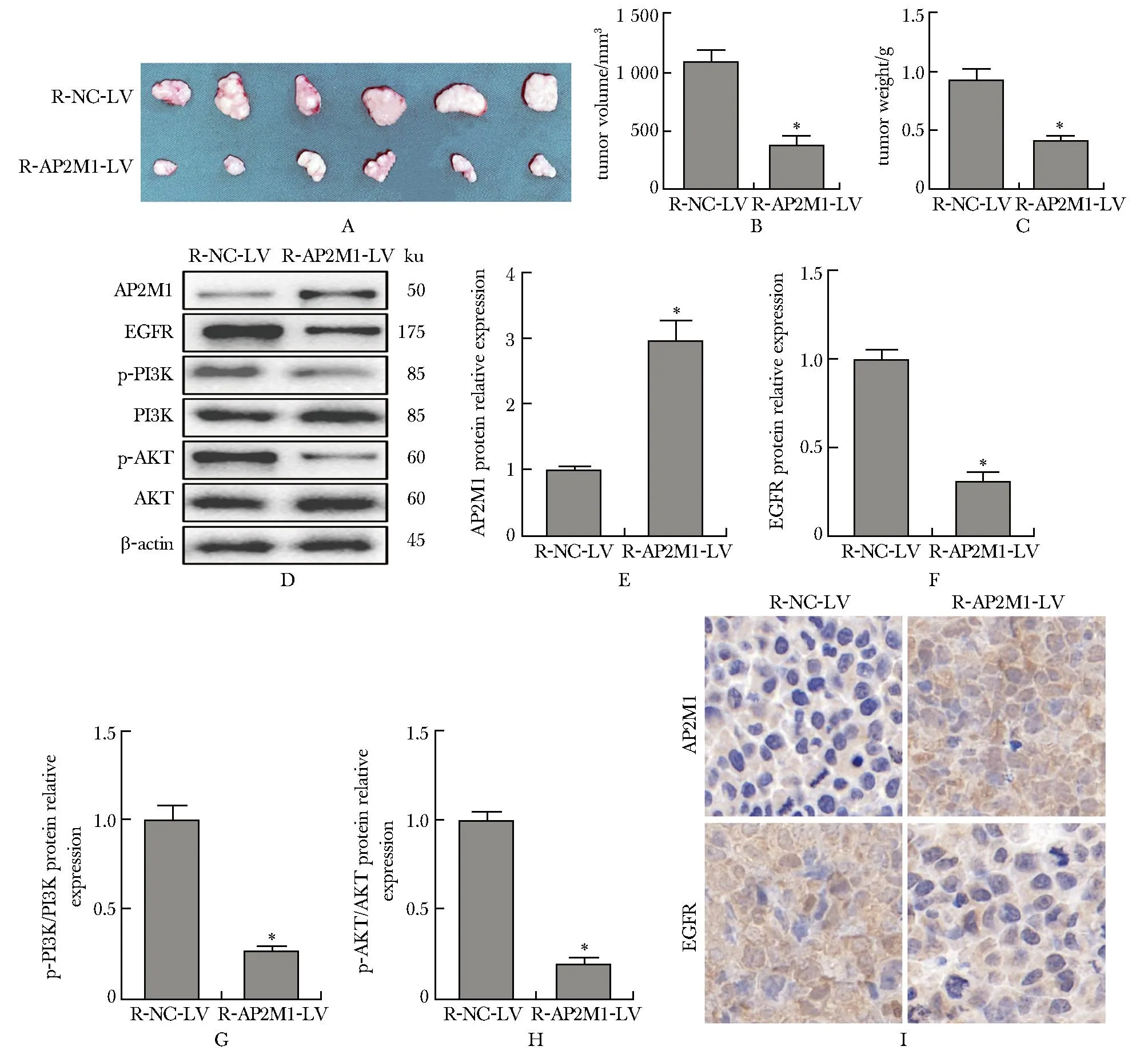
A-C.tumor images (6 repetitions), tumor volumes and tumors of two groups of nude mice; D-H.protein expression of AP2M1 and EGFR and phosphorylation of PI3K and AKT in tumor tissue of each group; I.immunohistochemical staining images of AP2M1 and EGFR in tumor tissue (×400); *P<0.05 compared with R-NC-LV group.
2.3 AP2M1对OCI-LY8细胞迁移和侵袭的影响
与对照组相比,AP2M1-shRNA组的迁移和侵袭细胞数量增加(P<0.05),AP2M1-LV组的迁移和侵袭细胞数量降低(P<0.05)(图3A~C)。与对照组相比,AP2M1-shRNA组的MMP-2和MMP-9蛋白相对表达量升高(P<0.05),而AP2M1-LV组的MMP-2和MMP-9蛋白相对表达量降低(P<0.05)(图3D~F)。
2.4 AP2M1对OCI-LY8细胞中EGFR/PI3K/AKT信号通路的影响
与对照组相比,AP2M1-shRNA组细胞中EGFR的蛋白表达水平及PI3K和AKT的磷酸化水平均升高,AP2M1-LV组细胞中EGFR的蛋白表达水平及PI3K和AKT的磷酸化水平均降低(P<0.05)(图4)。
2.5 AP2M1对移植瘤模型裸鼠肿瘤生长和EGFR/PI3K/AKT信号通路的影响
与R-NC-LV组相比,R-AP2M1-LV组裸鼠的肿瘤体积和质量均降低(P<0.001)(图5A~C)。与R-NC-LV组相比,R-AP2M1-LV组裸鼠的肿瘤组织中AP2M1的蛋白表达水平升高(P<0.001),EGFR的蛋白表达水平及PI3K和AKT的磷酸化水平均降低(P<0.001)(图5D~H)。免疫组化染色结果也显示,与R-NC-LV组相比,R-AP2M1-LV组裸鼠的肿瘤组织中AP2M1的阳性表达升高,EGFR的阳性表达降低(图5I)。
3 讨论
最新研究报道,AP2M1在DLBCL患者肿瘤组织中异常表达,AP2M1高表达患者的总体生存率更高[6]。在本研究中,发现AP2M1在DLBCL中的转录水平明显低于RLH组织,提示AP2M1可能参与了DLBCL的发生发展。目前,AP2M1在不同癌组织中具有不同的表达模式。例如,胆囊癌组织中AP2M1的表达水平降低[7]。然而,肝癌组织的AP2M1表达水平则高于正常肝脏组织,并且AP2M1表达水平与患者预后相关,AP2M1低表达的患者的生存率更高[10]。本研究分析,AP2M1可能与不同癌类型的发病机制或肿瘤特性有关,在肝癌中,AP2M1对网状蛋白质内吞作用的调节影响了乙肝病毒对宿主的感染,进而影响了癌的发生发展[11]。在DLBCL中,AP2M1可能发挥其他的功能。
本研究发现,AP2M1在DLBCL中主要发挥抗癌作用,AP2M1的高表达有助于抑制DLBCL的进展。为了揭示AP2M1影响DLBCL细胞功能的分子机制。本研究考察了AP2M1对OCI-LY8细胞中中EGFR/PI3K/AKT信号通路的影响。EGFR/PI3K/AKT信号通路是重要的促存活通路,在癌形成中发挥重要作用[9]。目前,文献证实AP-2复合物调节活化的EGFR的内吞及其功能[12]。磷酸化的EGFR变成活化的二聚体,该二聚体进入内吞小体发生内吞,随后分选入溶酶体进入降解途径[13]。EGFR通过内吞作用进入细胞可影响细胞增殖、发育相关信号通路的传递,有研究显示,当EGFR无法内吞时,EGF的刺激能够增强细胞增殖,相反,EGFR的内吞可减弱EGF诱导的细胞增殖[14]。本研究推测,AP2M1可能通过调节EGFR影响DLBCL细胞功能。结果表明,AP2M1的过表达在体内和体外均抑制了EGFR/PI3K/AKT信号通路的激活,而下调AP2M1则在体外激活了该通路。因此,EGFR/PI3K/AKT信号通路可能介导AP2M1对DLBCL细胞功能的调控作用。其他学者也报道,AP2M1的过表达抑制了胆囊癌细胞中的EGFR表达及其下游PI3K/AKT信号的活化[7],支持本研究结果。
综上所述,本研究表明AP2M1在DLBCL中发挥抗癌作用,AP2M1的过表达部分通过抑制EGFR/PI3K/AKT信号通路来抑制DLBCL细胞的增殖和侵袭。AP2M1可能是治疗DLBCL的新型分子靶标,值得进一步研究。

