槐耳多糖调节YAP/TAZ信号通路对骨肉瘤细胞生物学行为的影响
陈嘉丽 韩梦媛 王冬明
(上海中医药大学附属龙华医院药剂科,上海 200032)
骨肉瘤(Osteosarcoma,OS)是一种被认为来源于骨形成间充质干细胞的罕见肿瘤[1],主要影响青少年,虽然仅占儿童和青少年癌症约5%,但它对儿童癌症死亡率有很大影响[2-4]。一小部分低级别OS可通过手术治愈[5],但当OS发生转移时,单独手术无法治愈[6]。因此,研究OS的发生机制仍是一个挑战。槐耳具有广泛的抗癌功能,包括诱导细胞凋亡、抑制血管生成和刺激免疫系统,且未发现明显的副作用[7-8]。槐耳多糖(Sophora japonica polysaccharide,PST)是从槐耳中提取的活性成分,由6种单糖和18种氨基酸组成。研究发现,PST可以抑制三阴性乳腺癌(Triple negative breast cancer,TNBC)细胞的增殖和迁移[9]。Qi等[10]发现PST诱导胃癌细胞凋亡。Li等[11]发现PST可以在乳腺癌治疗中起到积极作用。但是目前关于PST是否对OS起到积极影响鲜有报道。Yes相关蛋白(YAP)/转录共激活因子PDZ结合基序(TAZ)信号轴在许多实体瘤的生长和进展过程中经常被激活,包括肺癌、结直肠癌、乳腺癌、胰腺癌、肝癌、黑色素瘤和胶质瘤,YAP/TAZ信号通路激活可以驱动癌细胞存活、增殖、侵袭、迁移和转移[12]。YAP/TAZ信号通路的激活也可能使化疗、放疗或免疫治疗产生耐药性[13]。也有研究发现YAP/TAZ通路可以作为治疗转移性癌症的靶标[14]。Kovar等[15]发现,YAP/TAZ在肿瘤发生和转移中起重要作用。而槐耳可以通过下调肝细胞癌中的YAP来增强奥沙利铂的化疗敏感性[16]。基于此,本研究探讨PST是否可能通过下调YAP/TAZ信号通路对OS细胞生物学行为产生影响。
1 材料与方法
1.1 细胞及主要材料 PST(货号:FT28138-5g)购自上海梵态生物科技有限公司;人OS细胞MG63(货号:YS4270C)、Saos-2(货号:YS4116C)、G292(货号:YS3740C)、U20S(货号:YS962C)购自上海雅吉生物科技有限公司;人成骨细胞hFOB 1.19(货号:Sci-H1092)购自上海圻明生物科技有限公司;CCK-8试剂盒(货号:PH1759)购自福州飞净生物科技有限公司;抗体:p-YAP(货号:ab76252)、YAP(货号:ab205270)、TAZ(货号:ab242313)、Bcl-2(货号:ab117115)、Bax(货号:ab81083)、cleaved-Caspase-3(货号:ab208003)、E-cadherin(货号:ab76319)、vimentin(货号:ab217673)、N-cadherin(货号:ab271856)购自Abcam公司。
1.2 细胞培养及分组 将所有细胞均用补充有10%胎牛血清和1%青霉素-链霉素的DMEM培养基培养,培养基置于37 ℃,5% CO2的培养箱中。待G292细胞生长汇合度达到70%时,分为以下6组:G292组(G292细胞未做任何处理);用1、2.5、5 μg/mL PST[17]处理G292细胞依次记为L-PST组、M-PST组、H-PST组,用10 μmol/L YAP/TAZ信号通路激活剂GA-017[18]处理G292细胞记为GA-017组,用5 μg/mL PST和10 μmol/L GA-017共同处理G292细胞记为H-PST+GA-017组。转染后继续培养48 h,用于后续实验。
1.3 CCK-8检测G292细胞活性 将细胞接种在96孔板上,每孔接种3 000个细胞进行相应处理,置于37 ℃、5% CO2恒温培养箱培养48 h后添加10 μL CCK-8试剂,最后用酶标仪检测吸光度值(A450)。
1.4 流式细胞术检测G292细胞凋亡 将各组细胞进行胰酶消化,以250×g离心5 min,用预冷的PBS洗涤两次,每次10 min,然后转移到流式管中。用500 μL结合缓冲液重悬细胞,加入5 μL AnnexinV-FITC和PI,室温下孵育10 min,上机检测细胞凋亡率。
1.5 划痕实验以及Transwell法检测G292细胞迁移和侵袭 ①迁移:将细胞密度调整为2×105个/mL。取1 mL细胞悬液加入6孔板中。在细胞生长覆盖板底部后,使用无菌移液枪枪头小心地刮擦板底部,并用PBS冲洗。在细胞培养24 h后用显微镜拍照并计算迁移率。迁移率(%)=(初始划痕宽度-24 h划痕宽度)/初始划痕宽度×100%。②侵袭:预先将Matrige铺在Transwell上室,向Transwell上室加入200 μL浓度为2×105个/mL的细胞悬液。在下室加入含有10%胎牛血清的DMEM培养基,并在孵育24 h后取出Transwell的上室。小心地去除未穿膜的G292细胞,用4%多聚甲醛将G292细胞固定,并用0.01%结晶紫染色约10 min。随后,在光学显微镜下观察G292细胞侵袭数量。
1.6 Western blot检测YAP/TAZ通路蛋白、EMT相关蛋白以及凋亡相关蛋白表达 将G292细胞加入裂解液后,在冰上裂解30 min,将细胞经4 ℃离心机离心后获得上清液,上清液用于总蛋白提取。使用BCA法定量总蛋白,随后将蛋白质在制备的凝胶上运行以进行分离。分离后,将蛋白质转移到PVDF膜上,该膜与一抗(p-YAP、YAP、TAZ、Bcl-2、Bax、cleaved-Caspase-3、E-cadherin、vimentin、N-cadherin、GAPDH)在4 ℃下孵育过夜,TBST洗膜后,加入标记的二抗孵育1 h,ECL显色剂显色后用ImageJ软件对蛋白质定量。

2 结果
2.1 PST对细胞活性的影响 PST(2.5~5 μg/mL)抑制MG63、Saos-2、U20S、G292细胞A450值(P<0.05),且对G292细胞影响最显著。因此,以G292细胞为研究对象。见表1。

表1 PST对细胞A450值的影响
2.2 PST对各组G292细胞活性的影响 与G292组相比,M-PST组、H-PST组G292细胞A450值显著减小(P<0.05),GA-017组显著增加(P<0.05);与H-PST组相比,H-PST+GA-017组A450值显著升高(P<0.05)。见表2。

表2 PST对G292细胞活性的影响
2.3 PST对G292细胞凋亡的影响 与G292组相比,M-PST组、H-PST组细胞凋亡率、Bax、cleaved-Caspase-3蛋白水平显著升高(P<0.05),Bcl-2蛋白水平显著下降(P<0.05),GA-017组呈相反趋势(P<0.05);与H-PST组相比,H-PST+GA-017组细胞凋亡率、Bax、cleaved-Caspase-3蛋白水平显著下降(P<0.05),Bcl-2蛋白水平显著上升(P<0.05)。见图1~2、表3。
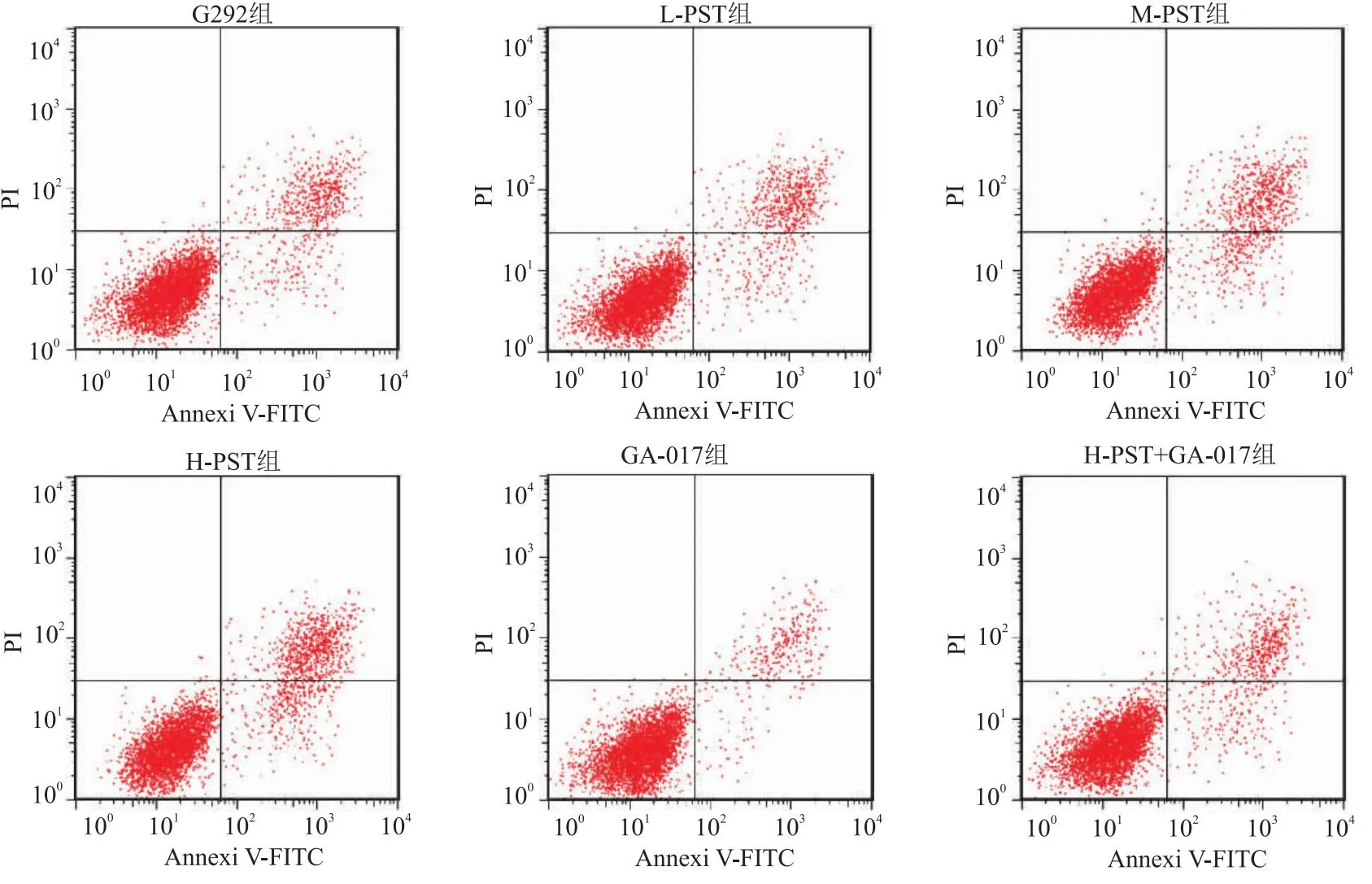
图1 流式细胞术检测G292细胞凋亡率
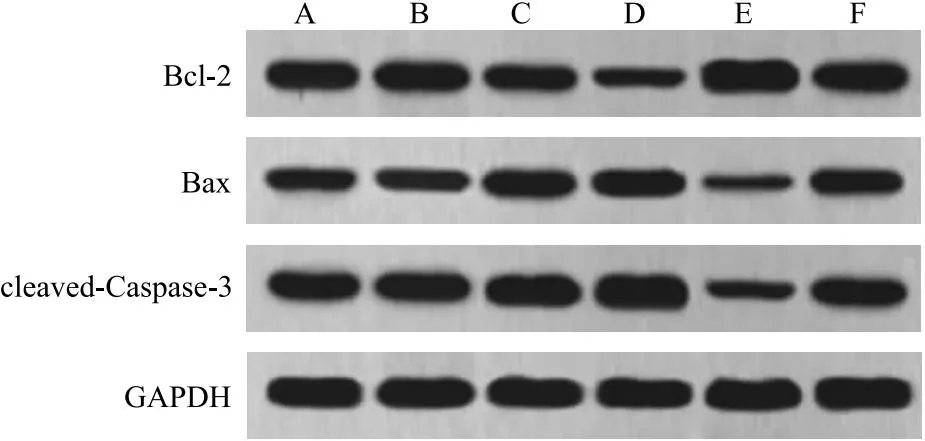
图2 各组G292细胞凋亡蛋白比较

表3 各组G292细胞凋亡率及凋亡相关蛋白的比较
2.4 PST对G292细胞迁移、侵袭以及EMT相关蛋白的影响 与G292组相比,M-PST组、H-PST组G292细胞迁移率、侵袭数量以及vimentin、N-cadherin蛋白水平显著降低(P<0.05),E-cadherin蛋白水平呈显著上调趋势(P<0.05),而GA-017组E-cadherin蛋白水平显著减少(P<0.05),迁移率、侵袭数量以及vimentin、N-cadherin蛋白水平显著上升(P<0.05);H-PST+GA-017组较H-PST组G292细胞迁移率、侵袭数目、vimentin、N-cadherin蛋白水平显著升高(P<0.05),E-cadherin蛋白水平显著下降(P<0.05)。见图3~5、表4~5。

图3 划痕试验观察G292细胞迁移(40×)

图4 Transwell试验观察G292细胞侵袭(200×)

图5 各组G292细胞EMT相关蛋白的比较

表4 PST对G292细胞迁移、侵袭的影响

表5 PST对G292细胞EMT相关蛋白的影响
2.5 PST对G292细胞YAP/TAZ通路蛋白的影响 与G292组相比,M-PST组、H-PST组G292细胞p-YAP/YAP、TAZ蛋白水平显著下降(P<0.05),而GA-017组p-YAP/YAP、TAZ蛋白水平显著上升(P<0.05);H-PST+GA-017组较H-PST组p-YAP/YAP、TAZ蛋白水平显著升高(P<0.05)。见图6、表6。
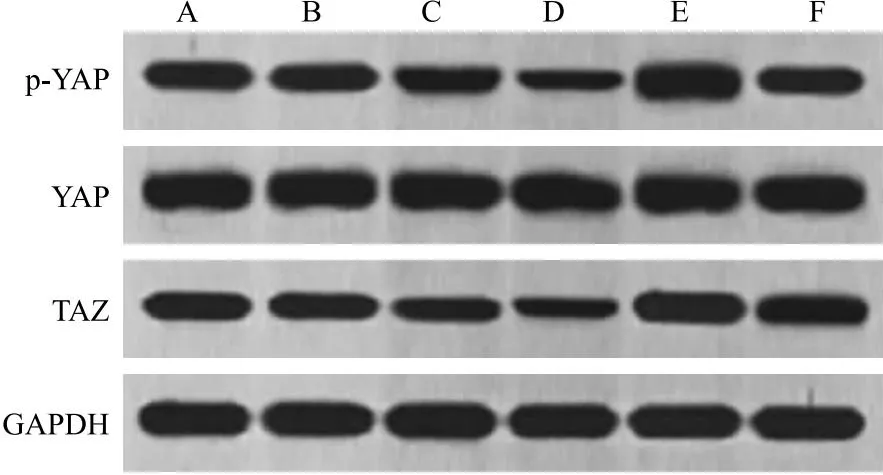
图6 各组G292细胞YAP/TAZ通路蛋白水平

表6 各组G292细胞YAP/TAZ通路蛋白水平比较
3 讨论
OS是最常见的原发性骨恶性肿瘤,具有很高的局部浸润和转移倾向。尽管手术与化疗相结合极大地改善了OS患者的预后,但转移性或复发性OS的预后仍然效果不佳[19]。因此,研究OS的发生机制仍是临床面临的难题之一。越来越多的证据表明,中药具有抑制肿瘤生长的潜力[16]。槐耳已被用于多种癌症的治疗,而PST作为槐耳中的主要活性成分在癌症治疗中也被广泛研究,大量研究证实PST在TNBC[9]、肝癌[20]、乳腺癌[11]的治疗中起到积极作用,但PST在OS上的研究鲜有报道。本研究结果显示,PST抑制OS细胞系(MG63、Saos-2、U20S、G292)细胞活性,且对G292细胞效果最显著,因此,以G292细胞为研究对象。与G292组相比,M-PST组、H-PST组G292细胞A450值、Bcl-2蛋白水平显著下降,细胞凋亡率、Bax、cleaved-Caspase-3蛋白水平显著升高,提示PST可能通过抑制G292细胞增殖,促进其凋亡抑制OS发展。
上皮间质转化(EMT)已被确定在肿瘤进展,侵袭和转移中起关键作用,并且是癌细胞获得侵袭性的一种方式[21]。在EMT过程中,上皮细胞通过失去细胞极性和上皮标志物(E-cadherin)的表达而经历表型转换,通过获得间充质标志物(N-cadherin,vimentin)表达而成为间充质细胞[22]。因此,这些转化的上皮细胞获得成纤维细胞样特性,并表现出细胞间粘附减少和运动性增加[23-24]。本研究结果显示,与G292组相比,M-PST组、H-PST组G292细胞迁移率、侵袭数量以及vimentin、N-cadherin蛋白水平均显著下降,E-cadherin蛋白水平显著升高,提示PST可能通过抑制G292细胞EMT过程抑制OS的进展。
国外研究报道称YAP/TAZ信号通路激活是肿瘤生长、转移和耐药性的驱动因素[12]。大量研究也证实可以通过调控YAP/TAZ信号通路来抑制癌症的发展。例如Zhu等[25]发现激活YAP/TAZ通路促进肝细胞癌的增殖。Ma等[26]发现激活YAP/TAZ信号通路促进结直肠肿瘤的发生。而YAP/TAZ信号通路在OS中的研究已经非常普遍,研究发现YAP/TAZ信号轴协调人OS的去分化、细胞命运和转移[27]。Ferraiuolo等[28]还发现龙舌兰可以通过抑制YAP/TAZ信号通路抑制细胞活力、集落形成和细胞迁移,并且可以诱导OS细胞系的凋亡,本研究结果与其一致。在本研究中,PST处理后G292细胞p-YAP/YAP、TAZ蛋白水平显著降低,提示PST可能通过抑制YAP/TAZ信号通路发挥抑制OS发展的作用。为了进一步证实猜测,本研究用YAP/TAZ信号通路激活剂GA-017处理G292细胞,结果发现GA-017组G292细胞A450值、迁移率、侵袭数量以及vimentin、N-cadherin、Bcl-2、p-YAP/YAP、TAZ蛋白水平均显著升高,细胞凋亡率、E-cadherin、Bax、cleaved-Caspase-3蛋白水平显著降低,与M-PST组、H-PST组的作用效果呈相反的趋势,而GA-017和PST共同处理G292细胞发现,PST对G292细胞恶性行为的抑制作用被GA-017部分逆转,提示PST可能通过下调YAP/TAZ信号轴抑制OS的进展。本研究不足之处在于缺少临床数据,将在下一步实验实施。
4 结论
PST可能通过调控YAP/TAZ信号轴影响OS细胞增殖、凋亡、迁移和侵袭,进而抑制OS发展。

