近红外光谱法快速检测何首乌炮制过程中多糖含量的研究
贾 彬,陈启文,赖嘉敏,张龙开,向超群,郭 拓,程 敏,肖 雪*
(1.国家药品监督管理局药品快速检验技术重点实验室(广东省药品检验所),广东 广州 510663;2.广东药科大学 广东省代谢病中西医结合研究中心(中医药研究所),广东 广州 510006;3.弘正道(中国)中药研究有限公司,广东 广州 510665;4.陕西科技大学 电子信息与人工智能学院,陕西 西安 710021)
何首乌为蓼科植物何首乌(Pleuropterus multifloruThunb.)的干燥块根,多以生首乌和制首乌做药用。制首乌是生首乌的加工品,有补肝肾、益精血、强筋骨、乌须发、化浊降脂的作用。何首乌经炮制后,泻下作用降低,补益作用增强,呈明显的“生熟异用”功效。近代药理学研究显示,何首乌在抗衰老、抗肿瘤、改善心血管功能、增强免疫力等方面具有良好的疗效[1-3]。而何首乌多糖作为何首乌中的主要药效成分,具有极高的药理活性,包括抗衰老[4]、抗炎[5]、降血脂[6]、抗肿瘤、免疫调节[7]等多种作用。多糖在炮制过程中的变化是何首乌药性改变的主要原因。现有研究多聚焦在古法炮制何首乌过程中多糖结构和含量的变化等,但古法炮制何首乌中含有黑豆多糖,难以阐释炮制过程对何首乌多糖的影响。因此有必要建立一种可以快速准确地分析何首乌炮制过程中多糖含量变化的方法。
近红外光谱技术具有快速、无损、绿色等优点,已广泛应用于医药[8]、化工[9]、食品[10]等领域。姬生国团队基于近红外光谱技术分别开展了制何首乌中二苯乙烯苷、游离蒽醌、醇溶性浸出物、水分等指标的快速测定研究[11-14],为何首乌药材合规性快检提供了技术支持。
但复杂样品的近红外光谱存在谱带宽、吸收峰重叠等问题,需要借助化学计量学方法对光谱进行模型校正[15]。同时,由于检测仪器的影响,近红外光谱信号中的背景、噪声、基线、杂散光等会影响模型质量,需对光谱进行预处理[16]。
本研究以何首乌清蒸炮制过程中多糖的含量变化为基础,采用傅里叶变换红外光谱仪采集何首乌的近红外光谱数据,并通过偏最小二乘法(PLS)对样本光谱进行校正。采用SG 平滑、变量标准化(SNV)、一阶解卷积导数(1stDec)、二阶解卷积导数(2ndDec)对光谱进行预处理。同时,为提高模型的预测能力及稳定性,选择竞争自适应重加权采样(CARS)、蒙特卡洛无信息变量消除法(MCUVE)、随机蛙跳法(RF)对光谱变量进行筛选。在此基础上建立了快速准确的何首乌多糖定量分析模型,以为何首乌炮制过程的状态分析等研究提供参考。
1 实验部分
1.1 仪器、试剂与样品
MPAⅡ型傅里叶变换近红外光谱分析仪(德国布鲁克公司);UV-3100PC 型紫外分光光度计(上海美谱达仪器有限公司);KQ5200E 型超声波清洗器(昆山市超声仪器有限公司);ELGA 超纯水机(法国威立雅集团);Sartorius BS110S 万分之一电子天平(德国赛多利斯集团);LD-200 型高速多功能粉碎机(天津市泰斯特仪器有限公司)。布鲁克近红外光谱分析软件OPUS 8.5(德国布鲁克公司)、MATLAB R2020b(美国MathWorks公司)、Unscrambler X 10.4(64-bit)(挪威Camo analytics公司)。
无水乙醇、浓硫酸(分析纯),纯净水(杭州娃哈哈集团有限公司),葡萄糖(广州化学试剂厂),蒽酮(上海麦克林生化科技股份有限公司)。
生何首乌(产地广东,批号20211260)、黑豆制何首乌(产地贵州,批号D2012132)均由弘正道(中国)中药研究有限公司提供。
1.2 实验方法
1.2.1 制何首乌的制备参照《中国药典》[17]2020 年版通则(0213)蒸法炮制加工制何首乌。分别取约10 kg 何首乌片,加入6 700 mL 超纯水,拌匀,静置过夜使汁吸尽,隔水加热,分别在0、2、4、8、12、18、24、30、36、48 h 取出一定量样品,晒干,得到10 批清蒸制何首乌样品,依次标记为Q0、Q2、Q4、Q8、Q12、Q18、Q24、Q30、Q36、Q48。
1.2.2 多糖的制备以上述不同清蒸时间的何首乌与市售制何首乌(标记为Z)共计11 批次样品为对象,在各批次样品中随机取6份作为独立样本,共收集何首乌样品66个。
1.2.2.1 何首乌样品预处理精密称定何首乌样品100 g(过20目筛),置于圆底烧瓶内,加入80%乙醇1 000 mL,加热回流1 h除去药材中的脂溶性成分,趁热过滤,滤渣用80%乙醇洗涤至无色,挥干表面残留的醇溶液,干燥至恒重备用。
1.2.2.2 何首乌多糖的提取[18]按照料液比1∶25 的比例将预处理的样品与纯净水置于圆底烧瓶中,提取2.5 h;第二次按料液比1∶20,提取2 h。趁热过滤,合并水提液后浓缩至100 mL,随后缓慢加入无水乙醇至醇含量达60%,摇匀,置于4 ℃冰箱静置8 h。取出,在滤饼中依次加入丙酮、石油醚2~3次进行抽滤操作,烘干滤饼即得到何首乌水提粗多糖固体。精密称定各何首乌水提粗多糖15 mg,加适量热水溶解并定容至250 mL容量瓶中备用。
1.3 蒽酮-硫酸法测定何首乌粗多糖中的单糖含量
移取2 mL 待测液置于比色管中,加入6 mL 蒽酮-硫酸试剂,剧烈振荡摇匀,浸于冰水浴中冷却,于100 ℃水浴煮沸5 min,取出,在冰水浴中冷却后于625 nm下测定吸光度值。
1.4 近红外光谱采集
何首乌样品粉末的近红外光谱均使用MPAⅡ型傅里叶变换近红外光谱分析仪获得。采用MATLAB 2020b、Unscrambler X 10.4 化学计量学软件对数据进行处理。光谱测定条件:光谱范围11 550~3 950 cm-1,扫描次数32 次,分辨率16 cm-1,软件为OPUS 8.5。以每个样品平行测定3 次后的平均光谱作为该样品的光谱。
2 结果与讨论
2.1 何首乌多糖含量测定方法学考察
移取2 mL 葡萄糖标准品溶液,加入6 mL 蒽酮-硫酸溶液,剧烈振荡摇匀,浸于冰水浴中冷却3 min,再置于100 ℃水浴中煮沸5 min取出,冰浴3 min,于440~800 nm波长下测定吸光度值。结果显示样品在625 nm处有最大吸收波长。
2.1.1 标准曲线建立配制质量浓度分别为0.02、0.04、0.05、0.06、0.08、0.1、0.15 mg/mL的葡萄糖标准品溶液,各取2 mL 测定其吸光度,以葡萄糖质量浓度(X,mg/mL)为横坐标,吸光度值(Y)为纵坐标,绘制标准曲线。结果表明,硫酸-蒽酮法测定的葡萄糖在0.02~0.15 mg/mL范围内线性关系良好,回归方程为Y=4.807 4X+0.095 4,相关系数(r2)为0.999 5。
2.1.2 精密度分别吸取Q0样品粗多糖溶液2 mL 至7个比色管中,测定吸光度值,计算得到各样品质量浓度的相对标准偏差(RSD)为0.40%,表明仪器精密度良好。
2.1.3 重复性平行制备Q0 样品粗多糖溶液7 份,分别测定吸光度值,计算得到各样品质量浓度的RSD为1.9%,表明方法重复性良好。
2.1.4 稳定性取Q0 样品粗多糖溶液2 mL,测定吸光度值,以第一次测量的时间为0 min,分别测定0、10、20、30、40、50、60 min 时样品的吸光度值,计算得到各样品质量浓度的RSD 为1.4%,表明溶液在60 min内稳定性良好。
2.1.5 加标回收率平行制备Q0 样品粗多糖溶液6份,分别加入已知样品含量相当的葡萄糖标准品固体,在625 nm 下测定吸光度值,计算得到平均加标回收率为98.6%,RSD为2.5%,表明方法的准确度良好。
2.2 不同炮制时间点的清蒸何首乌粗多糖及其单糖含量
为阐明何首乌炮制过程中多糖的含量变化情况,同时为建立近红外定量模型提供多糖真实信息,对不同炮制时间点的清蒸何首乌粗多糖及其单糖含量进行了测定。结果显示,清蒸过程中何首乌多糖的含量先升高后降低并逐渐趋于平稳,总体呈上升趋势(如图1)。市售制何首乌多糖含量为29.06%,与实验室制清蒸何首乌多糖含量相当。许煜迪[19]发现清蒸法炮制何首乌48 h,多糖类成分含量逐渐升至31.39%,单糖和二糖类成分含量逐渐降低,糖类成分总含量呈上升趋势。结构研究发现[20],随着炮制的不断深入,何首乌多糖的分子量逐渐降低。表明高温炮制过程中单糖、二糖以及多糖的糖链发生断裂,使得其水溶性增加、黏度降低、多糖溶出度增高,提高了多糖的生物活性[21]。但何首乌经炮制后转化为分子量较小的糖类成分,是否对其功效活性产生影响,还有待进一步研究。
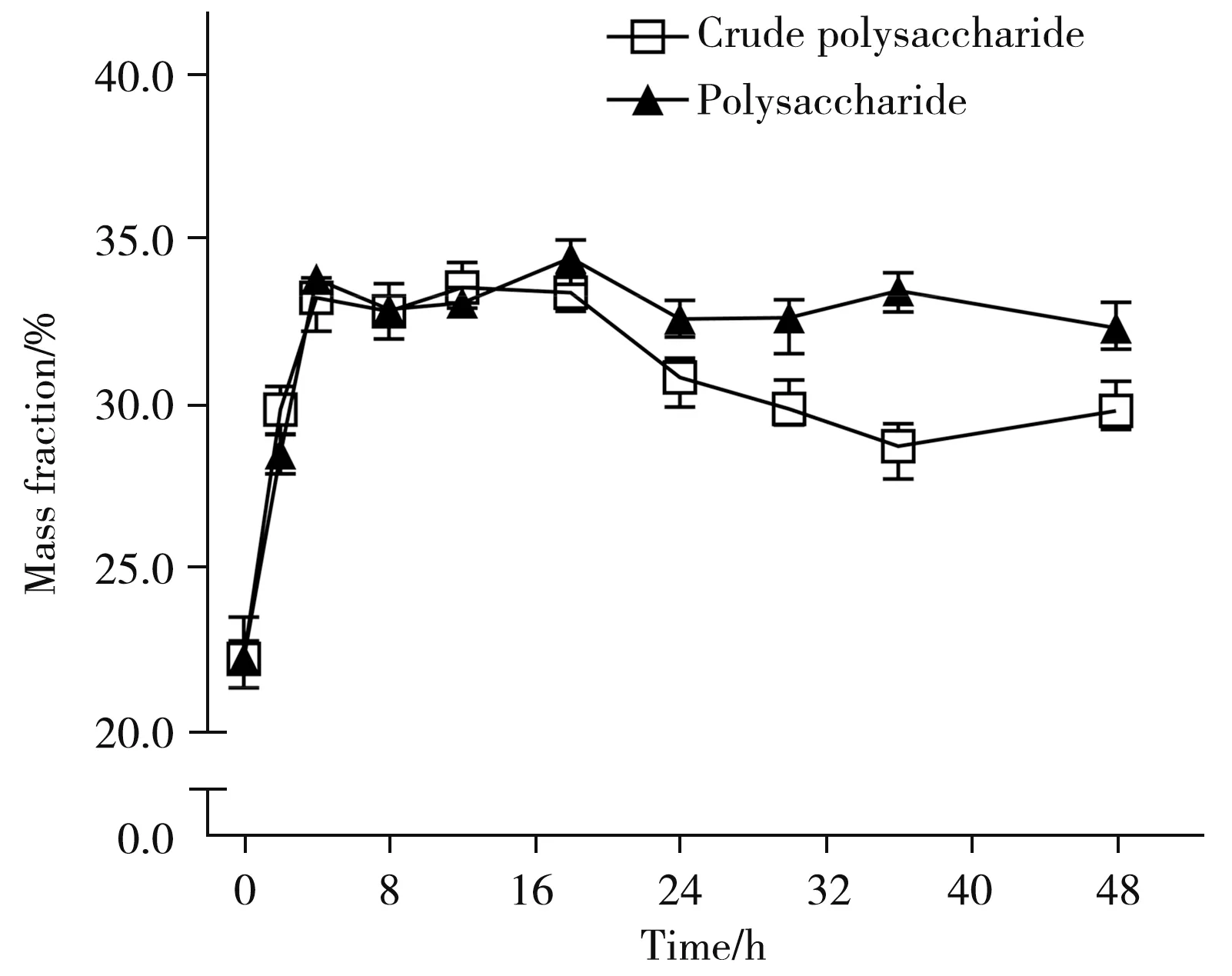
图1 清蒸过程何首乌多糖含量变化Fig.1 Changes of polysaccharide content in Polygoni Multiflori during steaming process
2.3 近红外光谱数据
各样品的近红外光谱如图2A所示。结果显示,何首乌在清蒸过程不同时间点的样品光谱呈现基本相似的趋势,然而由于频带重叠程度较高,导致目标组分的特征波长难以确定。因此,有必要对原始光谱进行预处理,以提高信噪比、消除无效变异、提升模型质量。

图2 不同预处理方式的清蒸何首乌近红外光谱图Fig.2 Near-infrared spectra of steamed Polygoni Multiflori with different pretreatment methods
2.4 预处理方法选择
SG 平滑、SNV、1stDec、2ndDec 是常见的预处理方法,SG 可去除噪声,提高信噪比;导数处理可放大关键信号,减少背景效应对信号的干扰;SNV 可消除因颗粒大小不同或分布不均导致的散射现象对光谱的影响。另外,由于光谱变量较多,无关变量的引入可导致模型预测能力降低[22],需对光谱数据进行筛选。CARS、MCUVE、RF 是较为常用的变量筛选方法。CARS 是一种用于多目标优化的进化算法,鲁棒性高,具有较强的自适应性,但面对高维问题时速度较慢[23]。MCUVE 是一种通用的特征选择方法,该算法不依赖特定的数据,适用于各种类型的光谱数据,亦能处理数据中的干扰因素,提高模型的稳定性,但存在计算复杂性高、容易丢失相关性高的特征数据等缺点,需根据具体情况进行适当调整和评估[24]。RF具有全局搜索能力强、简单和种群多样的优点,但收敛速度慢、参数选择困难且易陷入局部最优,需根据具体问题和需求综合考虑其优缺点,并进行合理的参数设置和调整[25]。
2.5 聚类分析
聚类分析可利用样本的光谱特征,将具有相似或相同特征的样本进行聚类,并根据样本间的相似度来确定聚集顺序。相似度最大的样本将被首先聚集,最终得到不同类别或显著共性特征的聚合结果。本实验采用Ward’s 方法对不同清蒸时间的何首乌样品粉末的光谱进行聚类分析(图3),结果显示各时间点的何首乌样品差异显著,在含量上可能有较大的差异。
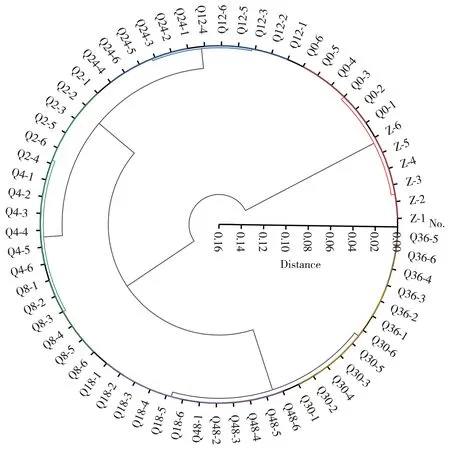
图3 不同清蒸时间何首乌样品聚类分析图Fig.3 Cluster analysis of Polygoni Multiflori with different steaming times
2.6 多糖含量模型分析
2.6.1 样本集划分将不同清蒸时间的何首乌粉末随机取样后测定多糖含量,并测定其光谱数据用于建立多糖含量的定量模型,共得到66个样本。利用K-S算法将样本集划分成校正集和预测集,其中校正集44个样本,预测集22个样本,数据集划分结果如表1所示。校正集的样品数据范围包含了预测集的样品数据范围,说明该数据方法合理有效。

表1 模型样本集分类结果Table 1 Classification results of sample collection
2.6.2 预处理方法优化样品的近红外原始光谱图存在严重的光谱叠加现象,许多吸收峰的吸收强度较弱,可能存在潜在的噪音和基线漂移干扰[26],导致有效的光谱信息被掩盖,难以准确提取。本文选择SG、SNV、1stDec、2ndDec以及两两结合等方法对样品的近红外光谱数据进行预处理,结果如图2所示。
以R2(包括校正集相关系数R2c和预测集相关系数R2p)、交叉验证集均方根误差(RMSECV)和预测集均方根误差(RMSEP)评价模型性能。R2c和R2p越接近1,则预测值和实际值之间的关联越强,预测结果越可靠;R2值大于0.9,则表示模型预测值与目标变量之间的相关性较强,可以很好地解释目标变量的方差;RMSECV 越小则定量模型效果越好;RMSEP 越小则模型的预测能力越强[27]。表2 中列出了经不同方法预处理后的定量模型结果。由表2 可见,对光谱进行导数处理后,模型质量下降,预测能力降低。这可能是由于导数处理放大了噪声信号所致。SG 平滑+SNV 处理的光谱在定量模型方面表现出良好的效果,具有较强的预测能力。但较高的主因子数(LV)可能对模型的稳定性和可解释性有负面影响[28]。因此,需要进行变量筛选去除冗余光谱数据,简化模型,提高模型的鲁棒性。
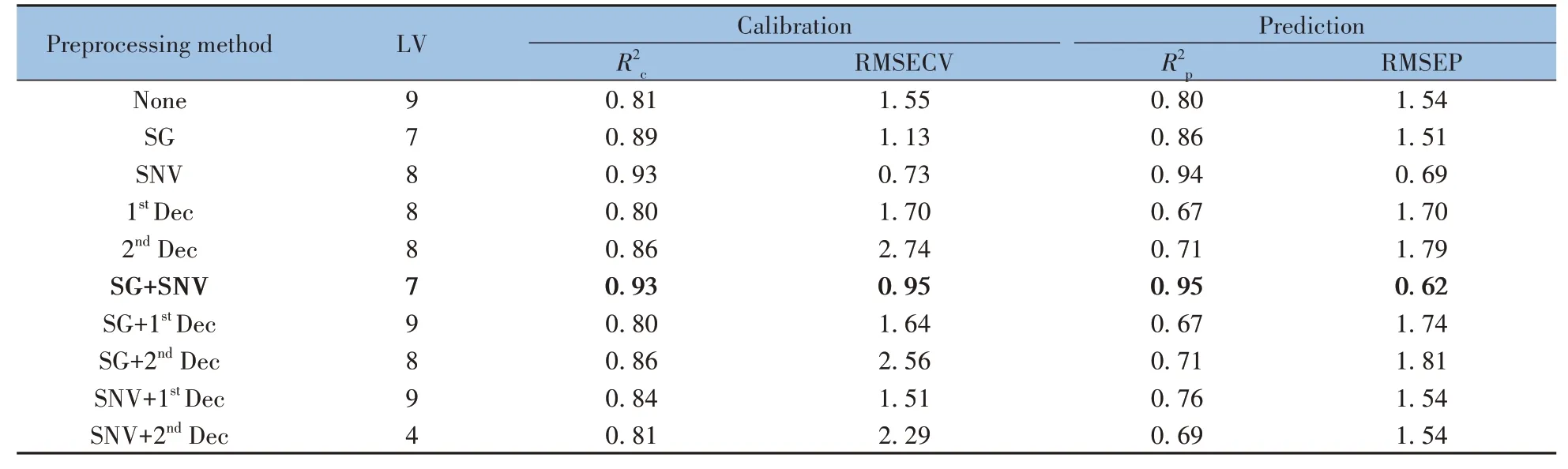
表2 不同预处理方法的PLS模型分析结果Table 2 Results of PLS model analysis with different preprocessing methods
2.6.3 变量筛选方法优化本研究在SG +SNV 预处理的基础上,选择MCUVE、CARS、RF 3 种方法进行变量筛选,模型分析结果及变量分布如表3 和图4(图中红色的部分表示对应算法筛选出的关键变量)所示。结果显示,RF 方法可从1 333 个变量中筛选出50 个重要变量,模型提升结果为R2c=0.96,RMSEC=0.74;R2p=0.96,RMSEP=0.28。模型性能良好。
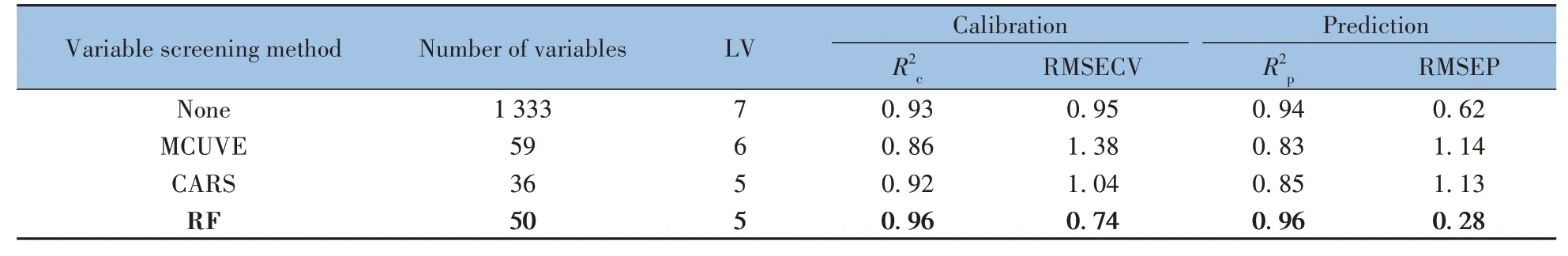
表3 不同变量筛选方法的PLS模型分析结果Table 3 Results of PLS model analysis with different variable screening methods
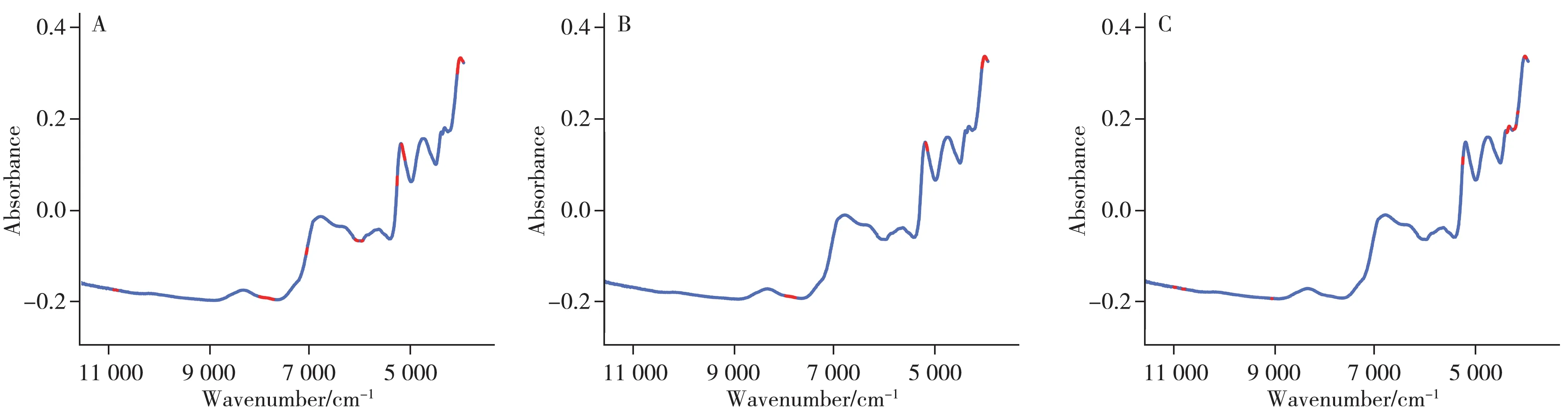
图4 清蒸何首乌样品不同变量筛选后的结果Fig.4 Results of steamed Polygoni Multiflori samples after different variable selection methods
通过对66 批何首乌的原始近红外光谱图进行SG+SNV 处理(图2H),发现在9 000~8 000 cm-1波段,何首乌样品在炮制过程中与生品和制品之间存在较大差异。使用RF 算法筛选出的变量分布在12 000~10 000 cm-1范围,其中包括O—H 伸缩振动以及C—H 伸缩振动。同时,筛选出4 500~4 100 cm-1、6 000~5 500 cm-1和8 000 cm-1附近的变量。其中4 500~4 100 cm-1范围内的波长点主要由C—H 弯曲振动和C—H 伸缩振动的合频以及C—H 弯曲振动和O—H 伸缩振动的合频产生[29];6 000~5 500 cm-1和8 000 cm-1附近的波长点,由—CH2和—CH3中C—H 伸缩振动的第一和第二合频引起[30]。RF 所选定的波长点相对较分散,表明样品的成分非常复杂,每个波段都含有有用信息。然而,要准确地将这些波段分配给特定的成分难度较高。因此,本研究中只列出了粗略的波段分配,详细的波段分配仍需要进一步研究。综上所述,RF算法所筛选出的特征变量准确、合理,说明这些特征变量与目标化合物的结构密切相关。2.6.4 模型验证 将K-S算法划分的22个预测集样品近红外光谱数据导入建立的RF-PLS模型中,得到模型预测值并验证该模型的预测能力。表4 为清蒸何首乌多糖含量模型预测集实际值和预测值的详细数据。结果表明,近红外光谱预测值与实际值基本一致,相对偏差均小于3.0%,表明模型的预测性能较好,能够准确预测未知样本的多糖含量。

表4 预测集多糖含量的参考值与预测值Table 4 Reference and predicted values of polysaccharide content in prediction set /%
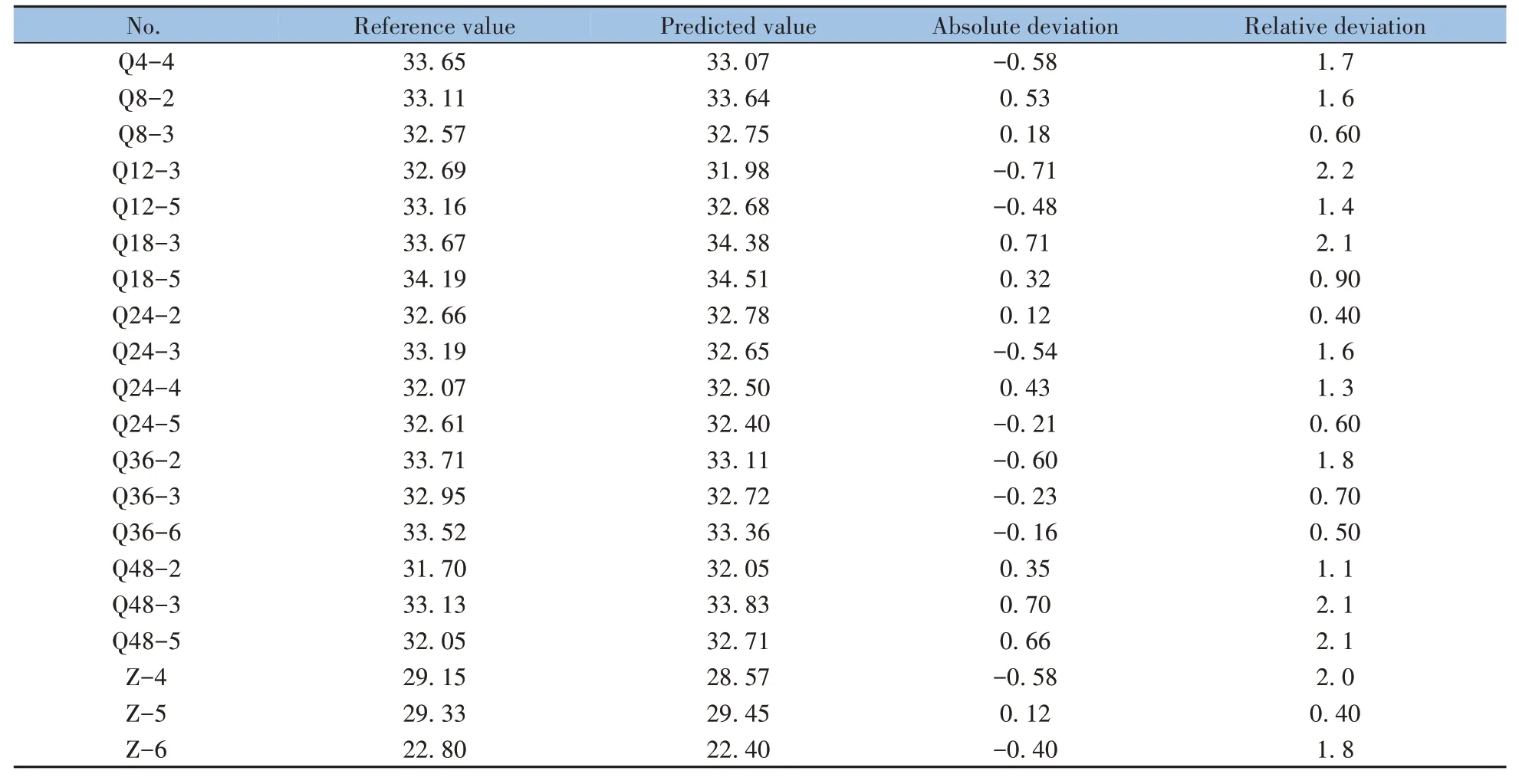
(续表4)
3 结 论
中药质量是影响中药临床疗效、产业发展的重大关键问题[31]。中药的质量控制应着重注意生产过程中的监控,尤其是在线实时分析。近红外光谱技术作为一种绿色的快速分析方法,可以便捷、准确、实时、无损的分析中药炮制过程中成分的含量变化。本研究探讨了清蒸何首乌过程中何首乌多糖的含量变化,并采用近红外光谱技术构建了其含量的快速测定方法,为何首乌的炮制过程研究提供了技术支持。

