菌酶协同发酵对玉米蛋白粉消化率的影响研究
孙华欣,宋春丽,韩赫,王志鹏,孙天颖,任健*,周恪驰
1(齐齐哈尔大学 食品与生物工程学院,黑龙江 齐齐哈尔,161006)2(黑龙江省玉米主食工业化工程技术研究中心, 黑龙江 齐齐哈尔,161006)3(黑龙江省农业科学院克山分院,黑龙江 齐齐哈尔,161000)
玉米蛋白粉是玉米淀粉湿法加工的主要副产物,蛋白质含量约占60%[1],富含各种氨基酸(如丙氨酸、丝氨酸和亮氨酸)[2],具有脂溶性蛋白质含量高[3]、氨基酸不平衡[4]、必需氨基酸含量低[5]、消化性差[6]等缺点。
玉米蛋白粉作为一种高蛋白饲料原料,在动物生产中的应用愈发广泛[7],然而动物采食后难以被胃、肠道吸收利用,导致玉米蛋白粉的利用效果较差。因此,提高玉米蛋白粉的有效利用率,适宜的预处理尤为重要。酶法改性是一种有效的手段,该方法可以有效降低玉米蛋白粉中抗营养因子的产生,从而增加底物的水解度和消化性,但酶解会使玉米蛋白粉产生苦涩味道,影响口感,且存在耐热性差等问题[8]。微生物发酵也能够提高蛋白质的利用率,发酵过程中产生的酶可以酶解底物中的大分子物质,降低抗营养因子的抗原性,并通过产生有机酸和抑菌物质发挥其抑菌活性,但微生物发酵存在菌株性能不稳定、耐受性低的问题[9]。将两种改性方法进行有机结合,微生物发酵能够产生相应功能酶,与体系内酶发挥协同作用,共同促进底物酵解过程,显著缩短发酵周期[10-11],从而使底物分解成更易吸收的小肽。
CHEIK等[12]研究表明菌酶协同发酵小米可以有效提高小米蛋白的消化性,改善口感。徐超等[13]和龙祝[14]研究发现微生物发酵和酶水解预处理可以使玉米蛋白粉的蛋白结构发生改变,并且可以改善氨基酸平衡及动物的吸收和利用。王国艳等[15]研究发现微生物的繁殖和代谢的过程可抑制抗营养因子的产生,进而提高蛋白的可消化性。张新宇等[16]研究发现微生物发酵过程中会引进有机酸,使胃消化环境pH降低,胃蛋白酶活性升高,蛋白消化率升高。
因此,为进一步提高玉米蛋白粉的消化性,以玉米蛋白粉为原料,将乳酸菌发酵与酸性蛋白酶、木瓜蛋白酶水解结合,采用单因素、正交试验确定最佳发酵工艺条件,并对直接影响玉米蛋白粉体外消化性的游离巯基含量、二硫键含量、表面疏水性、氨基酸等理化特性进行分析,以获得更高消化性的菌酶协同发酵产物,为菌酶协同发酵玉米蛋白粉提供技术支撑,为玉米蛋白粉的生产加工和开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
乳酸菌(活力为1×1010CFU/g)、酸性蛋白酶(酶活力为20 000 U/g)、木瓜蛋白酶(酶活力为10 000 U/g),北京默飞生物科技有限公司;玉米蛋白粉(蛋白质含量66%),大连奥肽营养专卖店。
1.2 设备与仪器
ME104E电子天平,梅特勒-托力多集团;ZNCL-GS磁力加热搅拌器,上海凌科实业发展有限公司;RF5301PC荧光分光光度计,日本岛津公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;3-18KS台式高速冷冻离心机,德国Sigma公司。
1.3 试验方法
1.3.1 复合酶酶解产物的制备
通过试验预处理,将玉米蛋白粉进行木瓜蛋白酶(添加量400 U/g、温度55 ℃、pH 6.0、时间3 h)及酸性蛋白酶(温度40 ℃、添加量800 U/g、pH 3.0、时间3 h)复合处理得到复合酶酶解产物。
1.3.2 乳酸菌发酵复合酶酶解产物
利用乳酸菌发酵上述复合酶酶解产物,考察发酵温度(33~41 ℃)、接种量(0.1%~0.5%)、料液比(1∶2~1∶6,g∶mL)、发酵时间(12~36 h)对产物水溶性蛋白质含量的影响。
1.3.3 福林酚法测水溶性蛋白
参照文献[17]采用福林酚法测定产物水溶性蛋白质含量。吸取0.2 mL的玉米蛋白粉水解液,加入0.8 mL蒸馏水、5 mL福林酚甲液,混匀10 min,再加入0.5 mL稀释1倍的福林酚乙液,混匀并水浴(30 ℃、30 min)。然后用紫外分光光度计在最适波长处进行测定(640 nm)。按公式(1)计算水溶性蛋白质含量。
水溶性蛋白含量/(mg/mL)
(1)
1.3.4 游离巯基含量的测定
参考李平等[18]的方法并进行适当的修改。称取400 mg不同改性产物添加量的冻干样品于10 mL的0.2 mol/L Tris-Gly缓冲溶液中,涡旋振荡5 min,离心机离心(5 000 r/min、15 min)。取4 mL上清液与0.1 mL 10 mmol/L的DTNB溶液混匀,静置20 min,用紫外分光光度计在412 nm波长处进行测定,按公式(2)计算游离巯基的含量。
(2)
式中:n,标准曲线纵坐标游离巯基含量,μmol/mL;ρ,样品质量浓度,g/mL;SHF,游离巯基的含量,μmol/mL。
1.3.5 二硫键含量的测定
取1.3.4节中离心后的上清液1 mL,加入0.1 mL β-巯基乙醇和4 mL的0.2 mol/L Tris-Gly缓冲溶液,常温显色1 h,然后添加10 mL质量分数为12%的三氯乙酸,均匀混合1 h,4 500 r/min、离心15 min,保留沉淀,用5 mL 12%的三氯乙酸溶液洗涤沉淀2次,洗涤完全后溶于10 mL 0.2 mol/L的Tris-Gly缓冲溶液,溶解后加入0.1 mL 10 mmol/L DTNB,静止20 min,用紫外分光光度计在412 nm处测定吸光度后,按公式(3)和公式(4)计算总巯基含量[18]。
(3)
式中:n,吸光度经标准曲线计算出的巯基含量,μmol/mL;ρ,样品质量浓度,g/mL;V1,上清液体积,mL;V2,沉淀复溶后体积,mL。
(4)
式中:SHT,总巯基含量,μmol/mL;SHF,游离巯基含量,μmol/mL。
1.3.6 表面疏水性的测定
以10 mmol/L磷酸盐缓冲液,pH值为7.0配制蛋白溶液(0.05、0.10、0.15、0.20、0.25 mg/mL),取2 mL稀释液加入10 μL 8-苯胺萘磺-1-酸盐溶液(8.0 mmol/L)中,并用荧光分光分度计激发波长为390 nm、发射波长为470 nm进行测定,以荧光强度随蛋白浓度变化的斜率表示表面疏水性[19]。
1.3.7 氨基酸组成分析
参照李思锦等[20]的方法,使用氨基酸自动分析仪进行分析。
1.3.8 体外消化率测定
采用体外胃-胰蛋白酶两步法[21]测定菌酶协同发酵产物。称取质量分数为10%的样品于具塞三角瓶,调节pH值至2.0,加入30 mg的胃蛋白酶,39 ℃、120 r/min水浴摇床振荡4 h。调节pH值至7.5,加入30 mg的胰蛋白酶,再振荡3 h,取10 mL消化液添加至质量分数为15%的三氯乙酸中,摇匀后静止30 min,20 000 r/min 离心10 min。取上清液2 g于消化管,凯氏定氮法测定上清液的含氮量,每个样品设置3个平行。体外消化率计算如公式(5)所示:
(5)
2 结果与分析
2.1 乳酸菌发酵复合酶酶解产物
2.1.1 乳酸菌发酵复合酶酶解产物单因素试验
以乳酸菌发酵的发酵温度、接种量、时间、料液比为试验因素,考察各因素对菌酶协同发酵产物水溶性蛋白质含量的影响,结果见图1。
由图1-a可知,随着温度升高,水溶性蛋白质含量整体趋势为先升高再降低,在37 ℃时水溶性蛋白质含量达到最大值。这是因为在37 ℃时乳酸菌生物活性最高。当温度不在该最适温度范围,乳酸菌的生物活性减弱,直接影响乳酸菌的发酵性能[22]。
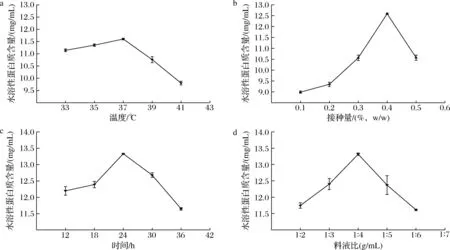
a-发酵温度;b-接种量;c-发酵时间;d-发酵料液比
由图1-b可知,随着接种量的增加,水溶性蛋白质含量呈先升高后降低趋势,这是因为接种量会影响发酵体系内微生物的生长繁殖,随着接种量逐渐升高,发酵体系内微生物生长茂盛,从而使产生的水溶性蛋白质含量升高[22];而接种量过多会使发酵环境中菌与底物比过高,发酵环境中营养物质消耗殆尽,还有可能会产生发酵代谢物,导致发酵环境中产生有毒代谢成分[23]。因此选择0.4%为适宜接种量。
由图1-c可知,随着发酵时间的延长,水溶性蛋白质含量升高,当发酵时间为24 h时,水溶性蛋白质含量达到最高。原因是短时间的发酵不能使玉米蛋白粉发酵完全;而随着发酵时间延长,底物大量消耗,并且发酵产物过多会抑制反应的进行,导致乳酸菌的衰亡[20]。因此选用发酵时间24 h。
由图1-d可知,当料液比在1∶2~1∶4(g∶mL)时,水溶性蛋白质含量逐渐升高,在1∶4~1∶6(g∶mL)时,水溶性蛋白含量逐渐降低。这是因为水分含量的多少会影响乳酸菌的生长,水分含量过低时不利于乳酸菌的生长繁殖;过高时会促进有害菌(梭菌)发酵,抑制乳酸菌生长[19]。因此发酵料液比选用1∶4(g∶mL)。
2.1.2 正交试验设计
在单因素的基础上,采用L9(34)正交表优化乳酸菌发酵复合酶酶解产物的发酵条件。正交因素水平表如表1所示,正交试验结果如表2所示,方差分析结果如表3所示。
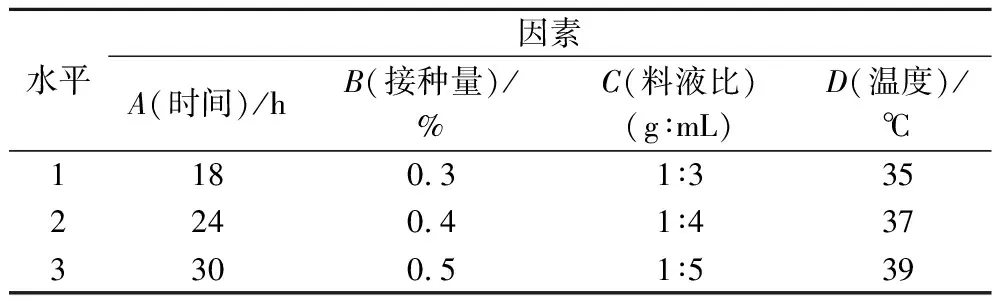
表1 L9(34)正交因素水平表Table 1 Orthogonal L9(34) factor level table
由表2可知,以水溶性蛋白质含量为评价指标,影响极差R大小的主次顺序依次为C>B>D>A,即料液比>加菌量>温度>时间。理论适宜组合为A2B1C2D3。即:发酵时间为24 h,发酵接种量为0.3%,发酵料液比为1∶4(g∶mL),发酵温度为39 ℃。
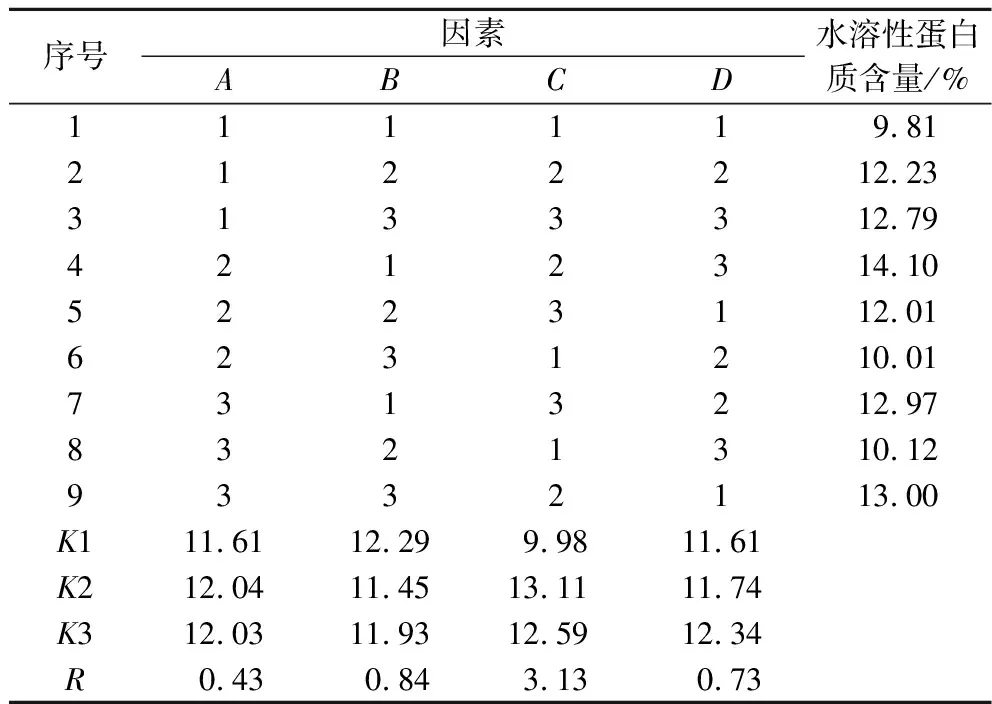
表2 正交试验结果Table 2 Orthogonal experiment results
由表3可知,料液比对水溶性蛋白质含量影响差异显著。将理论适宜因素水平下进行验证试验,水溶性蛋白质含量为15.9 mg/mL,略高于已报道的玉米蛋白粉饲料发酵工艺中水溶性蛋白质含量(13.77 mg/mL)[24],且有效缩短了发酵时间。因此,乳酸菌发酵复合酶酶解产物最佳工艺条件为:发酵时间24 h,发酵接种量0.3%(质量分数),料液比1∶4(g∶mL),发酵温度39 ℃。
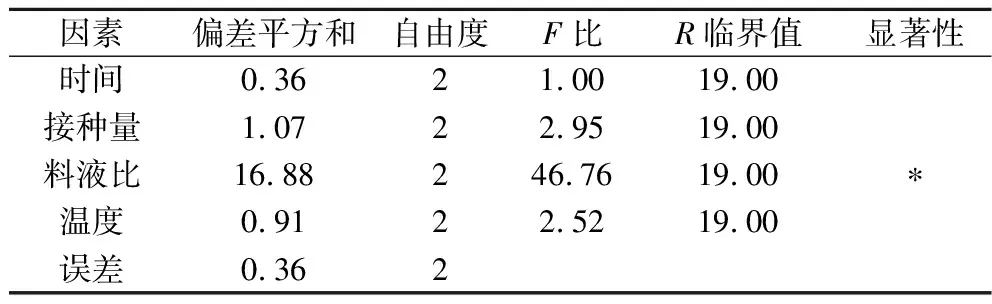
表3 方差分析结果Table 3 Variance analysis results
2.2 菌酶协同发酵对玉米蛋白粉游离巯基、二硫键及表面疏水性含量的影响
巯基和二硫键是反映玉米蛋白品质变化的重要指标[12]。由图2-a可知菌酶协同发酵产物的游离巯基含量由65.43 μmol/g升高至88.42 μmol/g,二硫键含量由67.06 μmol/g降低至44.40 μmol/g,这是因为菌酶协同发酵会使玉米蛋白粉的空间结构发生改变,使连接肽链之间的二硫键打开,导致游离巯基含量上升,玉米蛋白的空间结构松散,蛋白消化率发生改变[25]。
由图2-b可知经菌酶协同发酵后的产物表面疏水性由71.94降低至10.97。这是因为菌酶协同发酵可以打开蛋白质的三、四级空间结构,促使酶与酶切位点结合,剪切长肽链,导致亲水基团从内部暴露出来,蛋白表面疏水性降低[26]。

a-菌酶协同发酵产物游离巯基及二硫键含量; b-菌酶协同发酵产物表面疏水性变化
2.3 菌酶协同发酵对玉米蛋白粉氨基酸组成分析
氨基酸是消化能力大小的重要影响因素,发酵可使产物的氨基酸组成与原蛋白相比发生明显变化。菌酶协同发酵玉米蛋白粉氨基酸含量由表4可知,菌酶协同发酵产物中的氨基酸组成丰富,含15种不同氨基酸,含有苏氨酸、缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸和赖氨酸等6种必需氨基酸。其中必需氨基酸含量为22.54、23.56、25.70 mg/g,总氨基酸含量分别为64.56、66.91、72.27 mg/g。

表4 菌酶协同发酵产物的氨基酸含量 单位:mg/g
此外,菌酶协同发酵产物与玉米蛋白粉相比,必需氨基酸含量升高3.16 mg/g,总氨基酸含量升高7.71 mg/g,亲水氨基酸含量从32.19 mg/g升高至35.25 mg/g。这主要是因为玉米蛋白中多为不溶性的玉米醇溶蛋白,蛋白表面含有大量的疏水性氨基酸,且以二硫键和氢键维持其结构稳定[27]。本研究利用复合酶酶解或者菌酶协同发酵玉米蛋白粉,一方面破坏了二硫键(见2.2节二硫键含量分析结果)和氢键,导致醇溶蛋白表面疏水氨基酸含量减少,从而有利于暴露内部亲水性氨基酸;另一方面,被破坏的疏水性氨基酸又在体系内形成更多新的氨基酸,从而使总氨基酸含量上升[27]。已有研究表明提高亲水氨基酸的含量可提高蛋白质在体内的消化率[28]。由此可知,菌酶协同发酵玉米蛋白粉产物的氨基酸较平衡,消化性能好。
2.4 菌酶协同发酵产物的体外消化率分析
体外消化率可表征营养物质在体内被消化利用的是否完全,还与微生物对饲料的作用能力有关。体外消化率可直接反映采食量和饲料可消化性[29]。由图3可知,菌酶协同发酵可以提高玉米蛋白粉的体外消化率,由60.15%(玉米蛋白粉)升高至80.42%,高于已有报道利用单一发酵所得玉米蛋白粉的消化率(67.10%)[30]。这是因为蛋白原料的空间结构直接影响消化率。研究表明蛋白质疏水作用减弱、二硫键断裂、游离巯基含量上升,会使体外蛋白消化率升高[21]。而由2.2节可知,菌酶协同发酵玉米蛋白粉使疏水作用和二硫键显著下降,游离巯基含量显著上升,综上所述,菌酶协同发酵玉米蛋白粉会使体外消化率显著升高。

图3 菌酶协同发酵玉米蛋白粉的体外消化率Fig.3 In vitro digestibility of the fermented products from corn gluten meal hydrolysates with lactic acid bacteria
3 结论与讨论
菌酶协同发酵使玉米蛋白粉的二硫键含量、表面疏水性降低,游离巯基、氨基酸含量升高,从而显著提高玉米蛋白粉的体外消化率(由60.15%升高至80.42%)。同时,本研究成果为菌酶协同发酵玉米蛋白粉在饲料中的应用提供理论基础,也可为菌酶协同发酵玉米蛋白粉提供技术支撑。

