不同尺寸纳米塑料团聚行为的定量研究
胡婷婷,李志雄,陈家玮
(中国地质大学(北京) 地球科学与资源学院,北京 100083)
塑料被广泛应用于工业、农业及人们日常生活中,塑料制品的大量使用和不当处置引发的微塑料污染问题正在引起高度关注[1-2]。微塑料(Microplastics,MPs)一般是指粒径小于5mm的塑料碎片或微粒[3],它是由工业直接制造或大块塑料经老化破碎形成[4]。这些细小的塑料容易被各个营养级生物摄食,并对生物体产生毒性影响[5-6]。2021年,国家发展和改革委员会、生态环境部正式印发《“十四五”塑料污染治理行动方案》,着力开展塑料和微塑料的污染防治相关技术、方法和管理对策研究。厘清微塑料的地球化学迁移行为和环境归趋是评估和防治微塑料全生命周期环境影响的重要前提,已成为环境领域的研究热点[7-8]。环境中的微塑料,其尺寸大小分布在几十纳米到几毫米的范围内,其中,粒径小于1μm的塑料微粒可进一步定义为纳米塑料(Nanoplastics,NPs)[9-10]。与微米级塑料颗粒相比,NPs与污染物的相互作用更强,生态毒性也更大[11-12]。且NPs更小的尺寸、更强烈的布朗运动以及更高的比表面积等特性导致其表现出明显不同于微塑料的环境行为[13]。因此,需要进一步对NPs的迁移和归宿开展研究。
NPs在水体中的团聚效应是影响其在环境中的迁移和归趋的重要因素[14]。当团聚速率较慢或不发生团聚时,NPs能够悬浮在水体中,随河流发生长距离迁移;相反,如果发生快速团聚,NPs团聚体的粒径将迅速增大,进而更容易沉降到水底[15]。目前动态光散射技术(DLS)是研究纳米颗粒团聚动力学的先进手段,该技术可以实时监测纳米颗粒在水溶液中的粒径分布,得到团聚动力学参数,从而定量评估纳米颗粒在水环境中的分散稳定性[16-17]。近年来,已有学者尝试应用DLS技术研究pH值、离子强度等环境因子对纳米塑料团聚的影响[18-19]。Kim等[20]发现在氯化钠溶液中,50nm聚苯乙烯纳米塑料(PSNPs)的团聚速率随着氯化钠浓度增加而增加,并在离子强度为220mmol/L时达到最大值。Mao等[21]开展了在氯化钠溶液中100nm的PSNPs团聚动力学研究,发现随着pH值从3.5升高至9.5,100nm的PSNPs临界团聚浓度(Critical coagulation concentration,CCC)从180mmol/L增加至695mmol/L,即PSNPs稳定性增强。然而,这些研究并未考虑到纳米塑料尺寸效应带来的影响,环境中的纳米塑料的大小各异,尺寸作为纳米塑料最重要的属性可能会显著影响其团聚行为,但目前有关纳米塑料尺寸变化对团聚行为影响研究还较少。Liu等[22]研究发现50nm和500nm的PSNPs在NaCl溶液中的CCC值,分别为225mmol/L和770mmol/L,认为500nm的PSNPs由于布朗运动较弱、粒子数较少、碰撞几率较低且含有更多的表面负电荷,因此比50nm聚苯乙烯塑料具有更大的CCC值。Li等[23]获得20nm和100nm 的PSNPs在氯化钠溶液中的CCC值分别为311mmol/L和361mmol/L,也说明大粒径的PSNPs更为稳定。然而,结合以上两项工作来看,却发现表面负电荷更少的小粒径20nm聚苯乙烯塑料CCC值(311mmol/L)比大粒径的50nm 聚苯乙烯塑料CCC值(225mmol/L)要高,这与他们的结论互相矛盾。这种不一致性,究竟是不同研究之间实验条件存在差异所导致的,还是纳米塑料固有性质(如尺寸、表面电荷等 )导致的仍未知晓。因此,亟需探明颗粒尺寸大小、离子强度和pH值等内因和外因同时影响的条件下纳米塑料的团聚行为及主要作用机制。
本文应用DLS技术获取50nm、100nm和200nm三种尺寸的聚苯乙烯纳米塑料(PS50、PS100、PS200)在不同pH值及不同浓度氯化钠(NaCl) 电解质溶液中的团聚动力学曲线和Zeta电位(ζ电位)。根据PS50、PS100、PS200在NaCl溶液中的CCC值,定量阐述不同尺寸纳米塑料的稳定性差异,通过Derjaguin-Landau-Verwey-Overbeek理论 (DLVO)分析尺寸效应对纳米塑料团聚行为的影响作用机制。基于PS50、PS100、PS200的团聚行为和表面ζ电位变化情况,结合线性回归分析,探讨在各环境条件下不同尺寸NPs团聚行为的一般规律及主导作用机制,为理解和预测不同尺寸NPs在水环境中的迁移、分布和归宿提供帮助。
1 实验部分
1.1 材料和主要试剂
聚苯乙烯(PS)是应用最广泛的塑料之一[24],本文选取聚苯乙烯塑料(PSNPs)作为研究对象,对比不同尺寸大小PSNPs的团聚行为。 PSNPs原液(5%,w/V)购自上海辉质生物科技有限公司(上海,中国),三种尺寸(50nm、100nm和200nm)聚苯乙烯分别记作PS50、PS100和PS200。
氯化钠(NaCl)、氢氧化钠(NaOH)和盐酸(HCl):均购自北京国药集团化学试剂有限公司。
实验超纯水(电阻率18.2MΩ·cm):使用前过0.22μm水相聚醚砜滤膜。
1.2 材料表征
实验应用透射电镜(JEM2001,日本电子公司)表征PSNPs的初始尺寸大小与微观形貌。 PSNPs在不同水溶液中的水动力直径(Dh)和ζ电位均采用纳米粒度/Zeta电位分析仪(Omni 90型,美国布鲁克海文公司)测量。水动力直径采用动态光散射技术(DLS)测定,即在激光的照射下,利用光电检测器测定散射光强随时间产生的随机涨落,通过计算光强涨落变化的时域自相关函数并作数学变换得到。ζ电位的测量,是在外加电场作用下,通过检测散射光中的频移获取纳米塑料颗粒的电泳迁移率,然后使用斯摩鲁乔夫斯基方程(Smoluchowski)近似计算得到。
1.3 团聚动力学实验
PSNPs团聚动力学实验在室温25℃下进行,不同pH环境、不同浓度氯化钠(NaCl)溶液中测试并计算获得PS50、PS100 和PS200随时间变化的水动力直径(Dh)。简言之,在含有1.25mL(20mg/L)PSNPs悬浮液的样品皿中,加入不同浓度的NaCl电解质溶液1.25mL,置于快速混匀器上1s后立即将样品皿转移到纳米粒度/Zeta电位分析仪仪器样品槽内,测试PSNPs水动力直径。实验采用的散射光接收角度为90°,单次实验测量时间为15min。在不同浓度氯化钠电解质影响PSNPs团聚实验中,未进行pH值调节,经测试,溶液pH稳定在5.5±0.3。在400mmol/L的氯化钠溶液中研究不同pH值(3.0、7.0、10.0)对PSNPs团聚的影响,初始溶液pH值使用0.1mol/L氢氧化钠和0.1mol/L盐酸调节。每种溶液条件均重复实验2次。
1.4 数据分析与处理
1.4.1 团聚动力学参数计算
通过DLS测量得到纳米颗粒水动力直径,可由公式(1)计算多分散性指数(Polydispersivity index,PDI),指示溶液中PSNPs粒径分布均一程度[25]。
式中:σ为所测粒径标准差;ZD为平均水动力直径。
PSNPs在溶液中的团聚速率(Aggregation rate constant,k)由早期团聚阶段的水动力直径(Dh)随时间(t)变化关系,通过公式(2)计算获得[26]。
式中:N0代表PSNPs初始浓度;t代表团聚时间;Dh(t)为t时刻PSNPs水动力学直径。团聚速率k通常由t=0时的Dh(0)到测量值Dh增加到1.5倍Dh(0)的时间范围内计算确定[27]。
附着效率(Attachment efficiency,α)用于量化溶液中PSNPs的团聚动力学,可由公式(3)将团聚速率归一化计算得到[26],取值范围从0到1。
式中:k为反应限制阶段的团聚速率;kfast为扩散限制阶段的最大团聚速率。
临界团聚浓度是评估溶液中纳米颗粒稳定性的重要参数,即完全破坏PSNPs的分散稳定性的最低电解质浓度。一般来说,CCC值越大,表明纳米颗粒不容易团聚、分散稳定性更强。可使用公式(4)拟合附着效率曲线(α-CS),计算得到PSNPs在溶液中的临界团聚浓度CCC值[27]。
式中:α为PSNPs在不同电解质摩尔浓度下的附着效率;CS为电解质溶液的摩尔浓度;β为dlog(α)/dlog(CS)的斜率。
1.4.2 Derjaguin-Landau-Verwey-Overbeek(DLVO)相互作用力计算
DLVO理论常被用来解释胶体的稳定与团聚的机制。控制胶体稳定性的总相互作用能(VTOT)是范德华引力(VVDL)和双层电斥力(VEDL)之和,由以下公式(5)至(8)可以计算获得[28-29]。一般来说,当粒子间距离较远时,范德华引力占据一定优势,总相互作用能为负值;当粒子间距离减小,静电斥力开始产生影响,粒子间总相互作用能逐渐变为正值,并在一定位置达到峰值。峰值代表着限制纳米颗粒团聚的能量壁垒,当能量壁垒消失时的离子强度,即为DLVO理论预测CCC值,此时团聚速率达到最大。
式中:ap为采用DLS技术测得的PSNPs的水动力半径;h为两个PSNPs颗粒之间的分散距离;A为PSNPs的Hamaker常数(1.0×10-20J)[30];ε0为真空的介电常数(8.85×10-12C2J-1m-1);εr为水的介电常数(78.5);kB为玻尔兹曼常数(1.38×10-23J/K);T为温度(298.15K);e为元电荷电量(1.60×10-19C);z为溶液中反离子价态;φp是由DLS技术测量得到的PSNPs的ζ电位;德拜长度(κ,nm-1)是纳米粒子双电层厚度的倒数;I为电解质离子强度;NA为阿伏伽德罗常数(6.022×1023mol-1)。
1.4.3 数据质量控制
使用Microsoft Excel 2021计算两次重复样品的平均值和标准差。使用Origin 2021进行方差分析和t检验并绘制数据图表,p<0.05被认为在统计学意义上存在显著差异。
2 结果
2.1 聚苯乙烯纳米塑料(PSNPs)的表征
三种不同尺寸PSNPs的形貌通过TEM表征可见,如图1中a~c所示,PS50、PS100和PS200均为球形颗粒,大小均匀,平均粒径分别为46.3±6.8nm、94.4±8.3nm和194.4±8.1nm,与样品来源信息相符。图1 中d~f是DLS测量的三种NPs的水动力直径,大小分别为54.3±1.3nm、101.2±2.7nm和196.7±6.9nm。DLS和TEM结果的一致性说明DLS能够快速地对水溶液中PSNPs的粒径大小进行准确表征。由于DLS测得的水动力直径是包括水化层的厚度,因此通过DLS测得的纳米颗粒动力学直径会略高于TEM的观测值[31]。将DLS测量获得的水动力直径,按照公式(1)计算得出三种PSNPs(PS50、PS100、PS200)多分散性指数(PDI),分别为0.045、0.04以及0.007,均小于0.25,表明这三种PSNPs稳定性强,具有高度分散性,在纯水中不易发生团聚,这也与文献中报道的数据[32]相一致。
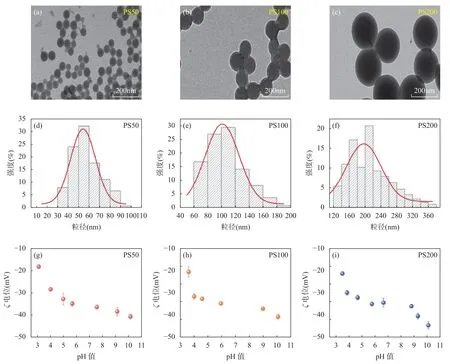
图1 不同尺寸PSNPs的表征:a~c分别为PS50、PS100和PS200的TEM图像;d~f分别为与之对应DLS测量的平均水动力直径;g~i为三种PSNPs的 ζ 电位值随pH值的变化情况Fig. 1 Characterization of the size-dependent PSNPs: a-c represent the TEM images of PS50, PS100 and PS200, respectively;d-f are the corresponding intensity-weighted hydrodynamic diameter distribution (Dh) of 10mg/L PSNPs determined by DLS;g-i show the ζ potentials as a function of pH in deionized water. The morphology of three PSNPs is all sphericity and has good dispersity. All the data present a good consistency.
通过纳米粒度/Zeta电位分析仪测量三种PSNPs在不同pH值水溶液中的ζ电位,结果如图1中g~i所示。PS50、PS100和PS200在去离子水中(pH=5.5±0.3)的初始ζ电位分别为-35.2mV、-35.1mV和-38.2mV,表面的高负电荷抑制它们在去离子水中团聚。有研究表明,在苯乙烯聚合反应中,硫酸盐自由基与苯乙烯单体的双键结合反应生成高分子量的聚苯乙烯链,会导致硫酸盐基团位于聚苯乙烯表面,从而使得PSNPs表面带负电荷[33]。调节溶液初始pH值至3~10,发现三种PSNPs在所有pH测试范围内ζ电位均为负值,且随着pH值增高而明显降低。例如,当pH从3增大至10时,PS50的ζ电位从-18.3mV降低至-40.7mV,这可能是因为随着溶液中OH-浓度升高,PSNPs表面的酸性官能团发生去质子化,导致负电荷增多[18]。
2.2 不同尺寸纳米塑料在NaCl电解质溶液中的团聚动力学
为探究不同尺寸PSNPs(PS50、PS100、PS200)的团聚行为,在接近实际水体环境的条件下(200~800mmol/L NaCl电解质溶液,pH=5.5±0.3),应用DLS技术测试获得三种PSNPs水动力直径随时间的变化情况(图2)。如图所示,三种PSNPs团聚动力学规律相似,随着NaCl浓度增加,团聚速率先增加,之后稳定不变。具体来说,当离子强度小于200mmol/L时,随着时间增加三种PSNPs的水动力直径几乎不变化,团聚速率接近0,说明PSNPs在此浓度条件下不易发生团聚;当离子强度在200~400mmol/L时,三种PSNPs水动力直径随时间增长缓慢,团聚速率逐渐增大;当离子强度大于400mmol/L时,三种PSNPs水动力直径随时间迅速增长,团聚速率达到最大值,不再随着电解质浓度的增加而增大[34]。
为了更进一步厘清不同尺寸PSNPs团聚的差异,根据公式(3)将PSNPs的初始团聚速率归一化,分别得到PS50、PS100和PS200的附着效率(α)随溶液电解质浓度的变化趋势(图3a)。 NPs的团聚过程分为两个阶段:反应限制阶段和扩散限制阶段。在反应限制阶段,随着电解质浓度的增大,纳米颗粒相互碰撞后团聚结合在一起的概率会增加,即附着效率增大(通常小于1)。这是因为随着电解质的加入,体系中反离子浓度增加,减少或中和原来PSNPs所带电荷(电荷屏蔽效应),从而降低颗粒之间的静电斥力。如,随着氯化钠浓度从200mmol/L增加至400mmol/L,50nm PSNPs表面ζ电位从-29.7mV升至-17.7mV,100nm PSNPs表面ζ电位从-33.5mV升至-19.4mV,200nm PSNPs表面ζ电位从-30.6mV升至-21.6mV(图3b)。在扩散限制阶段,纳米颗粒表面电荷完全被屏蔽,附着效率已达到最大值(通常为1),不再随电解质浓度增大而增加。如图3b所示,当氯化钠浓度大于400mmol/L,三种PSNPs 的ζ电位值为-15~-10mV,即使离子强度增加,颗粒表面ζ电位值也不发生明显变化。由反应限制阶段演化到扩散限制阶段的最低电解质浓度,定义为临界团聚浓度(CCC),该浓度为引起纳米颗粒完全失稳的最低电解质浓度值,被广泛用于评估纳米颗粒分散稳定性。根据公式(4)计算获得PS50、PS100和PS200的CCC值分别为325mmol/L、296mmol/L和264mmol/L。尺寸越大的PSNPs其CCC值越小,表明大尺寸的纳米塑料更容易失去分散稳定性发生团聚。

图3 PS50、PS100 和 PS200在不同浓度氯化钠溶液中(0~800mmol/L)的附着效率(a)及ζ电位(b)Fig. 3 Attachment efficiency (a) and ζ potentials (b) as a function of the concentrations of NaCl (0-800mmol/L) for PS50, PS100 and PS200. The CCC values for PS50, PS100 and PS200 were 325mmol/L, 296mmol/L and 264mmol/L, indicating that larger PSNPs are easier to aggregate.
然而,这与此前不同研究[22-23]报道的CCC值与纳米塑料颗粒尺寸之间的关联性并不一致,经过分析对比,发现这些矛盾的结果是因为不同研究中所使用的PSNPs的初始ζ电位存在很大的差异。如Li等[23]研究中所使用的100nm的PSNPs比20nm的 PSNPs具有更多的表面负电荷(-37.4mVvs.-29.5mV),导致100nm的PSNPs粒子间静电斥力和能量势垒更高,会更加稳定。而本研究中PS50、PS100和PS200在去离子水中(pH=5.5±0.3)的初始ζ电位差别不大,分别为-35.2mV、-35.1mV和-38.2mV。需要说明的是,即使在相同质量浓度下,不同尺寸PSNPs的颗粒数目是不同的,理论上同样体积悬浮液中会含有更多的较小尺寸的PSNPs,导致更高的碰撞几率,更易引发团聚。但是在本研究中颗粒数目浓度对CCC值的影响并不明显,可能是因为本实验中使用的PSNPs浓度较低(10mg/L)。例如,Cai等[30]在 10~50 mg/L的浓度梯度下,也未观察到颗粒浓度对PSNP团聚的影响,证实了这一点。
2.3 不同尺寸纳米塑料在不同pH值条件下的团聚动力学
纳米塑料已在多种水体环境中被检出,不同水体的pH值有很大的差别[35-36],而pH值是影响水中纳米颗粒团聚行为的重要因素[28,30]。为探究PSNPs在不同pH水体中的团聚行为,本文选择在400mmol/L 氯化钠溶液中,研究三种PSNPs分别在pH值为 3、7和10条件下的团聚动力学(为更好地观测团聚行为的变化,NaCl浓度的选取超过三种PSNPs的CCC值)。图4中a~c分别为PS50、PS100和PS200在不同pH条件下团聚动力学测试结果,可以看出,三种PSNPs在pH=3时团聚速率最快,之后随着pH值增加,团聚速率变慢。一般来说,ζ电位的绝对值越大,产生的静电排斥力越强,分散性更强。图4中d~f可见,三种PSNPs的ζ电位随pH值的增加而降低,当pH值由3增加到10,PS50的ζ电位从-14.0mV降至-27.5mV,PS100的ζ电位从-7.9mV降至-26.6mV,PS200的ζ电位从-9.9mV降至-27.9mV。ζ电位的绝对值随着pH的增加而变大,也就表示颗粒间的斥力逐渐增大。其原因可能是酸性条件下,PSNPs表面酸性的官能团(如羧基等)受到质子化的作用[37],导致表面电荷损失,斥力势能下降[17]。当pH逐渐增强甚至达到碱性时,PSNPs表面酸性官能团会逐渐去质子化,产生更强的静电斥力,纳米塑料颗粒分散性增强,体系更加稳定[38]。需要强调的是,当pH=7时, PS100和PS200基本保持稳定,但PS50仍发生快速团聚,可能是因为在此条件下PS50的ζ电位仍较小(大约-19.3mV)。

图4 在不同pH条件下(pH=3、7、10)PS50 (a,d)、PS100 (b,e)、PS200 (c,f)在400mmol/L 氯化钠溶液中的团聚动力学和ζ电位值Fig. 4 Effects of pH on aggregation of PS50 (a, d), PS100 (b, e), PS200 (c, f): Hydrodynamic diameter (a-c) and ζ potentials (d-f)(PSNPs concentration was 10mg/L; NaCl concentration was 400mmol/L exceeding the CCC values for the three PSNPs; pH=3,7, and 10). The aggregation rate decreased with the increase of pH due to the deprotonation.
3 讨论
3.1 纳米塑料(PSNPs)尺寸与稳定性关系解析
尺寸和稳定性之间的定量关系,对于理解纳米颗粒在环境中的潜在风险非常重要。本文通过运用DLS技术确定了氯化钠溶液中纳米塑料尺寸与CCC值之间的关系,发现尺寸越小的PSNPs越稳定(图3)。为了进一步探究初始粒径对纳米塑料团聚与稳定性的影响机制,本文利用DLVO理论计算获得三种PSNPs在氯化钠溶液中的总相互作用能(图5)。当离子强度为200mmol/L时,PSNPs最大能量壁垒为正值,说明静电排斥力起主导作用,因此可以推断在这一条件下PSNPs团聚速率较低或几乎不发生团聚。随着离子强度升高,PSNPs最大能量壁垒逐渐降低,由正值变为负值,说明在这个过程中,颗粒间的相互作用能由静电排斥力主导转变为由范德华吸引力为主导,表现为颗粒团聚速率逐渐增大直至达到临界值。当相互作用能不再随着电解质离子强度的增加而改变时,团聚行为完全由范德华吸引力主导,此时团聚速率已经达到临界值,不会继续增大。此外,DLVO理论计算结果表明,当不同尺寸PSNPs的能量壁垒消失时(变为零)氯化钠的浓度范围均为250~300mmol/L(图5)。但是上述团聚动力学实验得到的PS50的CCC值(约325mmol/L)并不在DLVO理论预测的范围内,且明显高于PS100和PS200的CCC值(分别为296mmol/L和264mmol/L)。DLVO理论预测的CCC值与团聚实验获得CCC值的偏差,可能是因为DLVO理论在应用叠加原理计算静电相互作用能时,忽略了带电粒子线性尺寸和双电层厚度之间的关系。Hsu等[39]曾假设不同尺寸球形粒子的表面电位恒定,并考虑到双电层的厚度不一定比粒子的半径小得多,推导了球形粒子间的静电相互作用与粒子尺寸的函数关系,理论计算结果表明当粒子半径大于1μm时,CCC值与粒子的大小无关;而对于小于1μm的粒子,其颗粒尺寸越小,双电层越厚,需要更高的电解质浓度来抑制更强的静电力。在本文研究中,PS50、PS100、PS200的初始ζ电位值几乎相同(图4b),由此可以推测随着PSNPs粒径减小,双电层厚度可能会增加,需要更高的电解质浓度来完全压缩双电层,体现为CCC值更高,这与Hsu等[39]的推论是相一致的。此前对于银纳米颗粒和土壤纳米颗粒的研究[40-41],也报道了类似的结果,表明该结论也许可以广泛应用于其他类型的纳米颗粒。
3.2 不同尺寸纳米塑料的环境归趋
ζ电位作为纳米颗粒重要的界面电化学性质,可以指示特定条件下的(如离子强度和pH值)纳米颗粒间静电相互作用大小,已成为定量评估纳米颗粒稳定性的重要指标[42]。在所有实验条件下以附着效率表示的三种PSNPs的团聚程度与ζ电位之间存在着显著的相关关系(r2=0.70~0.88,p<0.05),具有较低ζ电位绝对值的纳米塑料的附着效率越大,表明环境因子(离子强度和pH值)通过改变PSNPs静电斥力进而影响其分散稳定性。当ζ电位在-30~-20mV时,三种PSNPs均处于轻微团聚状态;当ζ电位逐渐接近0时,三种PSNPs附着效率逐渐增大高,测量到的水动力尺寸也相应增大(图6)。因此,对于PSNPs而言,ζ电位在低于-30mV时,被认为是处于静电稳定状态的标志,ζ电位高于-20mV时是处于完全失稳状态的标志。Lee等[19]在天然河水和海水研究中所得的PSNPs团聚动力学数据及ζ电位也证明了这一点,PSNPs不同温度河水中的ζ电位约为-30~-24mV,处于静电稳定悬浮状态;PSNPs在不同温度海水中的ζ电位约为-15~-5mV处于快速团聚状态。因此,ζ电位可用于初步判定PSNPs在不同环境条件下的稳定性。

图6 在所有实验条件下PS50 (a)、PS100 (b)、PS200 (c)附着效率与ζ电位之间的线性回归模型 (红色区域和蓝色区域分别代表95%置信区间和预测区间)Fig. 6 The linear regression models between attachment efficiency and ζ potential of PS50(a), PS100(b) and PS200(c) under all experimental conditions. The red line zone and blue zone represent the 95% confidence interval and prediction interval,respectively. The correlation coefficients (r2) of PS50, PS100 and PS200 are 0.88, 0.77 and 0.70, respectively, indicating that ζ potential is more favorable for predicting the aggregation behavior of smaller-size PSNPs.
PSNPs在特定条件下的团聚动力学参数,可用于开发预测模型,量化PSNPs在环境中的归趋。离子强度影响实验表明,虽然更小粒径PSNPs需要更高浓度的电解质溶液才能让其完全失稳,但本文研究中获得三种粒径尺寸PSNPs的CCC值均显著高于淡水环境的离子强度(通常单价态盐浓度<10mmol/L)[43],而小于天然海水(盐度约500mmol/L氯化钠)[44]。这意味着粒径范围在50~200nm的PSNPs具有相似的分散团聚性,其环境行为也类似,即容易在淡水系统中分散迁移,当环境变化后如进入咸水、海水等,会容易发生团聚沉降。pH值影响实验表明,pH值降低会促进三种PSNPs的团聚,推测PSNPs在途经中酸性水体时易发生聚沉。
4 结论
本文研究结果表明,化学成分相同但尺寸不同的纳米塑料具有不同的分散稳定性。主要表现为,尺寸越小的纳米塑料其CCC值越高,可能更容易在环境中长距离迁移。这种差异实际上是溶液pH、离子强度以及纳米塑料自身尺寸等因素影响了颗粒表面的ζ电位造成的。由回归分析结果可知,三种尺寸纳米塑料的团聚行为均与ζ电位密切相关(r2=0.70~0.88)。因此,结合纳米塑料的尺寸大小和ζ电位等性质,对纳米塑料在水体团聚行为开展研究,有助于判别预测其迁移行为和环境归趋。
值得注意的是,实际水环境成分复杂,未来研究还需要综合考虑各项环境因子(如共存离子种类、天然有机质等)对纳米塑料团聚行为的影响和改变。例如,环境中广泛存在的天然有机质与纳米塑料相互作用后,除了能改变纳米颗粒的表面电荷,还会产生空间位阻效应,从而显著提高了纳米塑料的分散稳定性,导致其迁移性和潜在风险被低估。因此,针对复杂条件下纳米塑料的团聚行为是今后研究的重点方向。
BRIEF REPORT
Significance:Microplastics (MPs) are defined as plastic fragments or particles with the size of <5mm[3], which are directly manufactured by industry or derived from weathering of large-sized plastic[4]. These tiny plastics are easily ingested by organisms of various trophic levels and have toxic effects on organisms[5-6]. Clarifying the geochemical transport behavior and fate of MPs is a crucial prerequisite for assessing their environmental impacts throughout the entire life cycle, making it a hot topic in environmental research[7-8]. Among all the MPs, those with a size <1μm are defined as nanoplastics (NPs)[9-10]. NPs exhibit stronger interactions with other pollutants and more adverse ecoimpacts on living things than MPs[11-12]. Furthermore, the quantitative analysis of NPs is more challenging than that of MPs. The smaller size, stronger Brownian motion, and higher specific surface area of NPs result in significantly different environmental behaviors from MPs[13]. Therefore, it is necessary to further study the transport and fate of NPs.
The aggregation behavior of NPs in aquatic environments is an important factor influencing its transport and fate[14]. When the aggregation rate is slow, NPs can remain suspended and transport long distances with river currents. Conversely, rapid aggregation leads to a substantial increase in the size of NPs aggregates, making them more prone to settling at the water bottom[15]. In recent years, scholars have investigated the influence of environmental factors such as pH value and ion strength on NPs aggregation by using dynamic light scattering(DLS) technique[18-19]. These studies have not taken into account the effects of NPs size, while the NPs exist as various sizes in the environment. Size, as a paramount property of NPs is likely to significantly impact their aggregation behavior. Currently, there is limited research on how changes in NPs size affect aggregation behavior.Therefore, it is imperative to explore the combined effects of particle size, ion strength, pH value, and other factors on NPs aggregation behavior and elucidate the primary mechanisms involved.
Investigating the general patterns and dominant mechanisms governing the aggregation behavior of differentsized NPs under various environmental conditions, will provide help in understanding and predicting the fate of NPs with different sizes. The study has shown that NPs with the same chemical composition but different sizes have different stability and mobility under the same chemical solution conditions. The critical coagulation concentration(CCC) for NPs increases with the decrease in particle size at a fixed surfaceζpotential, thus the smaller NPs may transport longer distances. Therefore, the effects of solution pH, ionic strength and size of NPs should be considered comprehensively in predicting and evaluating the geochemical behavior of NPs in the natural environment.
Methods:The dynamic light scattering (DLS) technique was used to quantitively measure the aggregation kinetics of three typical polystyrene NPs (PSNPs) with the size of 50nm (PS50), 100nm (PS100) and 200nm (PS200),respectively, under various environmental conditions. The aggregation kinetics experiments of PSNPs were conducted at room temperature (25℃). In brief, samples containing 1.25mL of PSNPs suspension (20mg/L) were prepared in a sample cuvette. Subsequently, 1.25mL of NaCl electrolyte solution was added to the samples. After 1 second of rapid mixing, the sample cuvette was immediately transferred to the sample chamber of a nanoparticle size/zeta potential analyzer to measure the hydrodynamic diameters (Dh) of PSNPs.
To clarify the size-dependent aggregation of NPs, theζpotentials andDhof PS50, PS100 and PS200 were measured in the presence of NaCl (0-800mmol/L). The initial pH value was not adjusted, and the pH of the samples was finally stabilized at 5.5±0.3 after testing. Furthermore, theζpotentials and hydrodynamic diameters of PS50,PS100, PS200 were obtained at the range of pH (3.0-10.0) in a 400mmol/L NaCl solution. The initial pH of the solution was adjusted using 0.1mol/L sodium hydroxide and 0.1mol/L hydrochloric acid. For each set of solution conditions, the experiments were repeated twice. Importantly, the critical coagulation concentration (CCC) and interaction potential energy were calculated.
Data and Results:(1) DLS technique combined with Derjaguin-Landau–Verwey–Overbeek theory (DLVO) was used to investigate the mechanism of the size-dependent aggregation of NPs. The morphology of PS50, PS100 and PS200 were all spherical and had good dispersity in deionized water, as shown in Fig.1. With the increase of NaCl concentration, the aggregation rate of the three NPs gradually increased at 200-400mmol/L. When the NaCl concentration was above 400mmol/L, the aggregation rate of NPs reached the maximum and no longer increased, as shown in Fig.2. To quantify the dispersion stability of different-sized NPs under various solution conditions, the attachment efficiencies (α) of PS50, PS100, and PS200 as a function of solution electrolyte concentration were obtained by normalizing the initial aggregation rate of NPs according to equation (3). The CCC values of PS50,PS100 and PS200 in NaCl solution were 325mmol/L, 296mmol/L and 264mmol/L by fitting the stability profile with equation (4). The results show that larger PSNPs were more likely to aggregate.
Fig.5 shows that the stability profile was in good agreement with DLVO theoretical calculations. For instance,the energy barrier among NPs decreased with increasing NaCl concentration resulting in a higher tendency for NPs to aggregate. As the electrolyte concentration exceeded the CCC, the energy barrier was eliminated, thus the van der Waals attraction forces dominated the particle interactions. However, the CCC values of PS50, PS100 and PS200 obtained by the aggregation kinetics experiment deviated from DLVO theory. The reason for such a deviation may be due to the application of the superposition principle in evaluating the electrical interaction energy[38]. Taking into account the case that the thickness of the electrical double layer isn’t necessarily much smaller than the linear size of the particle, it can be speculated that the smaller NPs had the thicker double electric layer, accordingly, a higher electrolyte concentration is required to completely compress the double electric layer.
(2)ζpotential serves as a crucial parameter for quantitative assessment of NPs stability. Under all experimental conditions, a significant correlation was observed between the attachment efficiency andζpotential (r2=0.70-0.88,p<0.05), as shown in Fig.6. This indicates that environmental factors such as ion strength and pH values affected the dispersion stability of NPs by altering electrostatic interaction. Data obtained by Lee et al.[19]for PSNPs in natural river water and seawater, as well as theirζpotentials, also supported this finding. The PSNPs hadζpotentials in the range of -30mV to -24mV in river water at different temperatures, indicating PSNPs exhibited a relatively stable condition. In seawater, theζpotentials of PSNPs were in the range of -15mV to -5mV, and rapid aggregation occurred. Therefore,ζpotentials can be used to preliminarily assess the stability of NPs.

