中国西沙海域永兴岛—七连屿海域鱼体内有机污染物含量特征与来源解析及风险评价
姚慧敏,陆天启,钟奕昕,寻看雨,颜巧丽,黄磊*
(1. 中国地质调查局广州海洋地质调查局三亚南海地质研究所,海南 三亚 572025;2. 中国地质调查局长沙自然资源综合调查中心,湖南 长沙 410600)
有机污染物具有致癌、致畸、致突变和损害神经和生殖系统的危害[1-3],且具有生物积蓄性、持久性、远距离迁移性等特性[4-6],严重威胁人类健康和社会可持续发展。该类物质虽已禁用多年,但在中美近海、南极和深渊生物体内仍能普遍检出[7-13]。为减少和预防有机污染物污染,国际社会于2001年签订《关于持久性有机污染物的斯德哥尔摩公约》,2017年增加了16种新型有机污染物。中国国务院办公厅于2022年公布《新污染物治理行动方案》,对重点管控新污染物实施严格的环境风险管控措施;生态环境部等六部门2023年公布《重点管控新污染物清单》,仍然将有机氯农药(OCPs)和多氯联苯(PCBs)列入其中。可见,有机污染物因其对人类和生态环境的持久危害仍然受到全世界广泛关注。海洋是多种有机污染物的汇[14-17],海水中的有机污染物含量水平在pg/L~ng/L之间[18-20],尽管在海水中的含量很低,但因其高亲脂性和低生物代谢性[5],可通过水相暴露和食物链传递富集于海洋生物体内,进而影响人类健康。据联合国粮农组织统计,中国南海渔获量约占全球总量的12%,是沿海国约3亿人口的重要蛋白质来源(https://m.thepaper.cn/baijiahao_24290238)。 因此,迫切需要研究有机污染物对海洋生物体的暴露风险。
在中国沿海和中国南海、地中海、意大利沿海、印度沿海、太平洋北部、美国东部沿海、南极等海域鱼体内均发现有机污染物[6,8-9,11,16,21-27],除南极其含量在pg/g数量级外,在其余海域的含量水平平均值在ng/g数量级。Hao等[27]对中国南海北部6个采样点采集45条金线鱼(Nemipterus virgatus),调查其中多溴二苯醚(PBDEs)、双对氯苯基三氯乙烷(DDTs)和PCBs的地理分布特征,PBDEs、DDTs和PCBs含量范围分别为1.3~36.0ng/g(脂重)、2.3~76.5ng/g(脂重)、8.3~228ng/g(脂重),DDTs来源分析表明中国南海北部可能有新输入DDTs,认为食用金线鱼可能不会对沿海居民造成生态风险。Fair等[7]对美国查尔斯顿港口及其支流水域鱼体内的OCPs、PCBs和PBDEs进行检测,PCBs含量范围为5.02~232.20ng/g(湿重),鱼体内PCBs可能对人类造成癌症风险,需限制食用。Hardell等[26]对太平洋北部的阿拉斯加群岛附近海域9种鱼类肌肉组织中的OCPs和PCBs进行检测,PCBs含量范围为104~185ng/g(湿重),也认为需限制鱼类食用次数,从而降低患癌风险。以上报道表明了有机污染物在全球海域鱼体内有不同程度的检出,且部分地区需警惕长期食用的致癌风险。
西沙海域位于中国南海西北部,周边环绕的多个发展中国家曾大量使用有机氯农药用于农业生产,该区域也是重要的电子垃圾拆解中心和海上运输枢纽,这些因素是中国南海有机污染物的潜在来源。有机污染物通过地表径流、雨水冲刷和大气沉降等多种途径进入中国南海,进而影响海洋生物群。目前对中国西沙海域污染物的研究对象主要集中于海水和沉积物样品[17,28-32],鲜有关于中国西沙海域的生物样品污染状况的报道。本文利用气相色谱-质谱法(GC-MS),检测永兴岛和七连屿海域鱼体内OCPs、多环芳烃(PAHs)和PCBs的含量,进而分析其来源,初步评价食用该海域鱼类的生态风险,拟为中国南海远洋生物有机物污染情况提供理论依据。
1 研究区概况
本文研究区域位于海南岛东南向约180海里的宣德环礁,具体为宣德环礁内发育的永兴岛和七连屿两个礁盘。宣德环礁位于中国西沙海域东侧(图1a),其北部为弧形礁盘七连屿,其上发育有10个岛屿,南部礁盘由永兴岛和石岛组成[32]。七连屿的南沙洲与永兴岛相距仅8海里,研究区位于宣德环礁北侧。
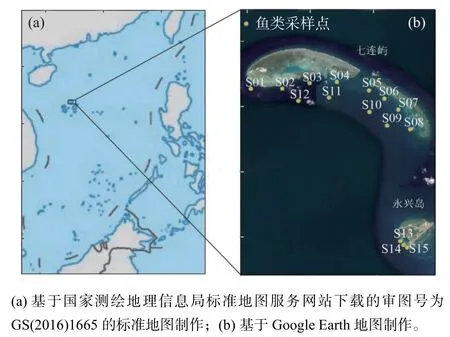
图1 中国西沙海域采样站位图Fig. 1 Sampling stations in Xisha, China.
七连屿位于宣德环礁东北部,由西沙洲、赵述岛等七个岛屿相连而成,位于永兴岛北部,面积约为1.32km2,渔业资源丰富[33](图1b)。永兴岛位于宣德环礁东部,面积约3.16km2[34]。
2 实验部分
2.1 样品采集
2020年10—11月,中国地质调查局广州海洋地质调查局在中国西沙群岛永兴岛和七连屿附近海域,布设海洋生物大面取样站位15个(图1b),包括在七连屿和永兴岛附近海域分别布设12个(图1b中S01~S12)和3个取样站位(图1b中S13~S15)。利用拖网进行鱼类生物取样,共采集了17种鱼类样品。每个站位拖网一次,每次拖网的时间平均为0.5h,拖网速度为3.0~3.5km,每次拖网速度尽量保持恒定。各站位采集的样品在现场进行初步分选后,按照不同种类装进广口塑料瓶或聚乙烯密封袋密封,置于-20℃环境下冷冻保存。海洋生物的样品采集、现场预处理和保存方法参考《海洋调查规范 第6部分:海洋生物调查》(GB/T 12763.6—2007)。
2.2 样品信息
本研究共采集鱼类样品17种50条,即每种鱼类捕获2~4条平行样。所有鱼类体长均在15~30cm,体重范围则变化较大,但最大不超过1400g。本研究所采集的鱼类为中国西沙海域常见物种,且为当地居民日常食物,是反映当地鱼类污染情况和生态风险的代表性物种。这些采集鱼类均为暖水性近岸鱼类,广泛分布于印度洋和太平洋沿岸海域,常栖息于珊瑚礁浅海水域。其中棘尾前孔鲀、眼带蓝子鱼和银蓝子鱼为草食性鱼类,主要以藻类为食;黑身蓝子鱼、污色鹦嘴鱼、三色鹦嘴鱼为杂食性鱼类,以藻类、浮游生物和底栖生物为食;其他则为肉食性鱼类,以小鱼、甲壳类、软体动物等为食。这些珊瑚礁鱼类大多色彩独特,常作为观赏鱼。鱼类样品种类、体长及采样站位等详细信息见表1。

表1 永兴岛—七连屿海域鱼类体型特征及采样点Table 1 Biological information and sampling sites of fish in Yongxing and Qilianyu islands.
2.3 样品处理方法
参考Sun等[21]的方法分离纯化OCPs和PCBs。主要步骤为:鱼样用清洁海水清洗后称取样品10~20g,取120mL正己烷-丙酮溶液(1∶1,V/V)于烧杯中,加入回收率指示物(PCB 30、PCB 65、PCB 204)在65℃恒温水浴条件下进行索氏抽提48h,将提取液旋转蒸发至1.5mL,提取液通过层析柱,用二氯乙烷-正己烷混合溶液(1∶1,V/V)注入层析柱中淋滤,收集淋洗液经旋转蒸发和氮气吹扫浓缩至1mL,待测。采用Han等[35]的方法分离纯化PAHs。主要步骤为:称取鱼类样品50g,取120mL正己烷-丙酮溶液(1∶1,V/V)于烧杯中,加入回收率指示物(萘-d8、苊-d10、菲-d10、䓛-D12、苝-d12)进行索氏抽提48h,使用旋转蒸发仪浓缩至1.0mL,加入3mL正己烷继续浓缩,重复三次后氮气吹扫至1mL,使用从上至下为无水硫酸钠和硅胶的层析柱对浓缩液进行分离纯化,用二氯乙烷-正己烷混合溶液(1∶1,V/V)洗脱层析柱,洗脱液经氮气吹扫至0.05mL,用正己烷定容至1mL,待测。
2.4 实验测试项目与目的
OCPs、PCBs、PAHs三类有机污染物测试项目包括:① OCPs:α-HCH、β-HCH、γ-HCH、δ-HCH、六氯苯、2,4-DDD、2,4-DDE、2,4-DDT、4,4-DDD、4,4-DDE、4,4-DDT、狄氏剂、氯丹、艾氏剂、I-硫丹、异狄氏剂、七氯、灭蚁灵、九氯、氧化氯丹、异狄氏醛、反式环氧七氯、甲氧氯;② PCBs:PCB 18、PCB 28、PCB 44、PCB 49、PCB 52、PCB 70、PCB 82、PCB 101、PCB 105、PCB 114、PCB 118、PCB 128、PCB 138、PCB 151、PCB 153、PCB 156、PCB 170、PCB 171、PCB 177、PCB 180、PCB 183、PCB 187、PCB 191、PCB 194、PCB 195、PCB 209;③ PAHs:萘、一甲基萘、二甲基萘、二氢苊、苊、芴、菲、蒽、荧蒽、芘、苯并[a]蒽、䓛、苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘、印并[1,2,3-cd]芘、二苯并[a,h]蒽、苯并[g,h,i]苝。测试方法均为气相色谱-质谱法。OCPs和PCBs所测项目属《斯德哥尔摩公约》禁止使用的有机污染物,PAHs所测项目则被美国环境保护署(US EPA)列为需严格控制的污染物。本文测试项目对中国西沙海域生态环境评价具有重要的指示意义。
2.5 仪器分析测试与主要试剂
采用电离(Electron impact,EI)离子源模式的Agilent 7890A气相色谱-串联7000C质谱(GCMS/MS)系统(美国Agilent公司)对 OCPs 和 PCBs含量进行测定。
GC-MS/MS 分析采用脉冲不分流进样,进样体积为1μL。载气为氦气,流速1.3mL/min,进样口温度290℃,离子源温度260℃,色谱柱为 HP-5MS(30m×0.25mm×0.25μm,美国Agilent公司)。升温程序:初始温度为80℃保持0.5min,以20℃/min增加至160℃,随后以4℃/min至240℃,保持2min,然后以20℃/min增加至295℃的最终温度,并持续2min。质谱测定方式采用多重离子扫描模式(MRM)。
采用QP2010 Ultra气相色谱-质谱仪(日本Shimadzu公司)对PAHs含量进行测定,采用无分流进样,进样体积2μL。载气为氦气,流速1.0mL/min,进样口温度260℃,离子源温度230℃。色谱柱为DB-17MS(30m×0.25mm×0.25μm,美国Agilent公司)。升温程序:初始温度60℃保持1min,以15℃/min升至110℃保持1min,再以20℃/min升至180℃,随后以2℃/min升至203℃,再以5℃/min升至250℃,2℃/min升至310℃,保持2min。测定方式为选择离子监测(SIM)方式。
标准品包括:OCPs标准溶液和PCBs标准溶液,均购自美国Supleco公司。PAHs标准溶液和回收率指示物PCB 30、PCB 65、PCB 204、萘-d8、苊-d10、菲-d10、䓛-D12、苝-d12均购自美国Accustandard公司。正己烷、丙酮、二氯甲烷均为色谱纯,购自上海安谱公司。
2.6 测试数据质量控制
为保证实验结果的可靠性,本研究中每组测试20个样品以保证质控,其中包括方法空白、溶剂空白、样品加标、平行样测定。基底加标测定回收率来判断准确度。回收率指示剂所测的回收率分别为:PCB 30 (89%±11%),PCB 65 (93%±6%),PCB 204 (91%±7%),萘-d8(84%±12%),苊-d10(96%±14%),菲-d10(108%±15%),䓛-D12(92%±11%),苝-d12(86%±15%);曲线校准:为控制误差进行标准曲线校准,标准曲线的相关系数≥0.995;以20个样品为一组,每组加做一个标准溶液(曲线中间含量),与初始曲线的相对偏差应不大于20%,若大于20%,标准曲线应重新测定。采用三倍噪声法计算OCPs、PCBs和PAHs的检出限分别为0.022~2.88ng/g、0.056~0.54ng/g和0.082~0.56ng/g。
3 研究区有机污染物含量与分布特征分析结果
永兴岛和七连屿海域17种鱼体内OCPs、PAHs和PCBs的含量汇总见表2。其中OCPs检出率为100%,OCPs含量范围为2.23~91.57ng/g,平均值为32.50ng/g,中位数为16.92ng/g。不同种鱼类OCPs含量差距较大,最高值和最低值分别出现在污色鹦嘴鱼和黑鳍粗唇鱼体内。OCPs中六氯环己烷(HCHs)和DDTs使用量大,使用范围广,使用历史长,对水生生物毒害作用强,其指示意义重大。HCHs和DDTs在鱼体内的含量范围分别为未检出(ND)~21.27ng/g和2.13~37.12ng/g,含量均值分别为4.48ng/g和15.13ng/g。DDTs含量普遍高于HCHs,可能与其物化性质有关。由于HCHs较DDTs具更强的生物降解能力和更弱的亲脂性,因此,HCHs不易在生物体内积蓄[36]。
鱼体内PAHs检出率为98%。PAHs含量范围为2.11~31.70ng/g,平均值为17.29ng/g,中位数为13.34ng/g,最高值和最低值分别出现在污色鹦嘴鱼和黑鳍粗唇鱼体内。二环芳香物在所有检出物中占比最高,含量为1.19~23.25ng/g,平均值为10.19ng/g;三环、六环、四环、五环芳香物含量依次递减,分别为3.43ng/g、1.89ng/g、1.88ng/g、1.13ng/g。这一结果与前人在浙江沿海鱼体内[8]和永兴岛土壤部分站点[17]一致,二环和三环PAHs主要来自石油泄露、化石燃料的低温燃烧和成岩过程,四环以上PAHs则来自燃料高温热解[37-38]。鱼体内累积低环PAHs,推测与化石燃料的中低温燃烧有关。
PCBs检出率为100%。PCBs含量范围为1.55~54.04ng/g,平均值为18.79ng/g,中位数为7.61ng/g,污色鹦嘴鱼PCBs总含量最高,达54.04ng/g;黑身蓝子鱼、红裸颊鲷PCBs总含量次之,分别为52.88ng/g、34.22ng/g;黑鳍粗唇鱼内PCBs总含量最低,为1.55ng/g。其中五氯联苯含量最高,平均值为5.98ng/g;七氯联苯、八氯联苯、六氯联苯、十氯联苯、四氯联苯和三氯联苯含量分别为5.63ng/g、3.52ng/g、2.32ng/g、1.98ng/g、1.68ng/g和0.68ng/g,这一研究结果与Yang等[39]对中国沿海鱼和贝壳的调查结果相近,高氯代PCBs比低氯代具有更强亲脂性,因此,生物体内高氯代(五氯代)含量要高于低氯代。而更高氯代(十氯代)含量低,可能是由于化合物分子体积更大,难以通过细胞膜而导致低积蓄水平。
三种有机污染物均在污色鹦嘴鱼体内含量最高,推测与其栖息环境和生活习性有关。污色鹦嘴鱼是一种颜色鲜艳的珊瑚礁鱼类,主要分布于太平洋暖温带水域,栖息在岩礁或珊瑚礁区,具有鹦鹉般的下弯嘴型,适合刮食珊瑚礁附近藻类。有研究表明,类似海域珊瑚礁及共生藻类中有机污染物含量较高,如中国南海涠洲岛珊瑚组织和共生虫黄藻中PAHs含量分别为2487.58±1375.33ng/g、2496.76±979.26ng/g[4],据此推测本研究区污色鹦嘴鱼体内有机污染物高含量与其刮食珊瑚礁藻类有关。
4 讨论
4.1 研究区鱼体内有机污染物的组成及来源
4.1.1 鱼体内OCPs的组成及来源
本研究中鱼体内HCHs的4种异构体中,β-HCH的检出率最高(64%),其次为γ-HCH(48%)和δ-HCH(32%),α-HCH检出率最低(16%)。β-HCH虽然在HCHs中含量较低,但由于其抗生物分解能力最强[40],HCHs的残留时间与β-HCH的含量成正比。鱼体内β-HCH检出率达64%,暗示HCHs部分来源于历史残留,部分源自新近吸收。
DDTs/[双对氯苯基二氯乙烯(DDE)+双对氯苯基二氯乙烷(DDD)]比值,可应用于判断是否有新DDTs类农药输入[41-43]。若DDTs/(DDE+DDD)>1,表明存在新的DDT类农药输入[8]。研究区鱼体内DDTs/(DDE+DDD)比值范围为0.36~3.73,平均值为1.36。在本文研究的鱼类中,50%样品的DDTs/(DDE+DDD)>1。因此,本文认为DDTs在发生生物降解作用的同时,存在新的DDTs类农药输入。傅飘儿等[44]对西沙海槽XH-CL16柱状沉积物的稀土元素特征进行分析,判断该区域沉积物主要表现为陆源特征,来自珠江和红河的陆源碎屑可能是西沙海槽区沉积物的主要来源。而中国南部沿海一带水体中的OCPs污染较为严重[45],陆源OCPs经地表径流、海洋洋流和大气沉降等多种形式到达西沙海域。此外,永兴岛上种植蔬菜由来已久,永兴岛和七连屿海域鱼体内OCPs可能是陆源输入和永兴岛农业种植活动的综合作用。
4.1.2 鱼体内PAHs和PCBs的组成及来源
PAHs、菲(PHE)和蒽(ANT)是石油类产品燃烧过程中产生的同分异构体。有研究表明,可根据PAHs的组分及结构差异判断其来源[46-47]。若ANT/(ANT+PHE)<0.1,说明PAHs主要来源于石油类的污染;若ANT/(ANT+PHE)>0.1,则说明PAHs来自燃烧源的污染[48]。若FL/(FL+PYR)<0.4(芴,FL;芘,PYR),为典型的石油源污染;若0.4<FL/(FL+PYR)<0.5,表明由燃油排放的尾气造成;若FL/(FL+PYR)>0.5,说明PAHs来源于木柴、煤的不完全燃烧[46,49]。本文实验结果(图2)表明,仅黑鳍粗唇鱼和黄带副鲱鲤的ANT/(ANT+PHE)<0.1,其余15种鱼的ANT/(ANT+PHE)>0.1,表明88%鱼样中的PAHs来源于化石燃料燃烧;所有鱼样的FL/(FL+PYR)>0.5,说明PAHs由植物、木材和煤燃烧造成。汪伟薇等[17]对永兴岛土壤中PAHs的来源分析也证实了这一点。近年来,永兴岛人为开发活动较强烈,大范围燃烧化石燃料可能是永兴岛七连屿海域鱼体内PAHs的主要来源。
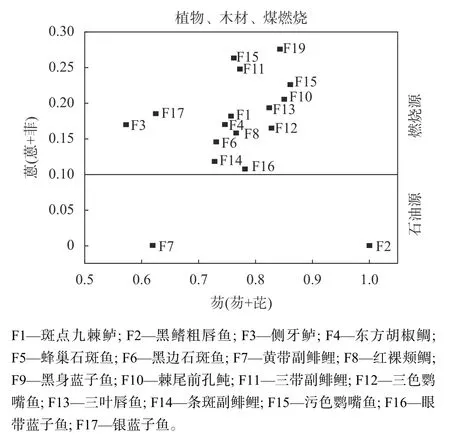
图2 永兴岛—七连屿海域鱼体内多环芳烃来源分析Fig. 2 Source analysis of PAHs in fish from Yongxing and Qilianyu islands. Fossil fuel combustion might be the main source of PAHs.
海洋环境中PCBs主要来源于工业污染和生活污水等点源和面源污染。本文鱼样检测的6种指示性PCBs中,五氯联苯占比最大,推测是由于微生物将高氯代PCB降解为低氯代产物所致。
4.2 国内外海域鱼体内有机污染物含量对比分析
本研究区鱼体内DDTs含量低于中国浙江和广东沿海、美国索尔顿水域、美国查尔斯顿港口、韩国沿海(干湿比按30%计)、意大利那不勒斯湾、地中海这些沿海水域,推测是由于本文采样点位于远洋公海远离污染源,低于阿拉伯海亚丁湾的鲨鱼体内含量,则与采样点位置和生物营养级同时相关,高营养级的鲨鱼更易积蓄DDTs;约为Wang等[6]在中国南海七连屿(脂湿比按4%计)所测DDTs含量的20倍,推测与采集鱼种有关。Wang等[6]采集4种鱼类包括两种肉食性鱼类孔雀石斑鱼(Cephalopholis argus)和金斑鲷(Gnathodentex aureolineatus),以及另两种草食性鱼类日本刺尾鱼(Acanthurus japonicus)和条纹外刺鱼(Ctenochaetus striatus),采集鱼类种类较少,代表性不强,且未包含污色鹦嘴鱼等刮食珊瑚礁藻类鱼种。与中国南海涠洲岛和印度喀拉拉邦Calicut地区相比,本研究区DDTs含量持平或略高(表3)。
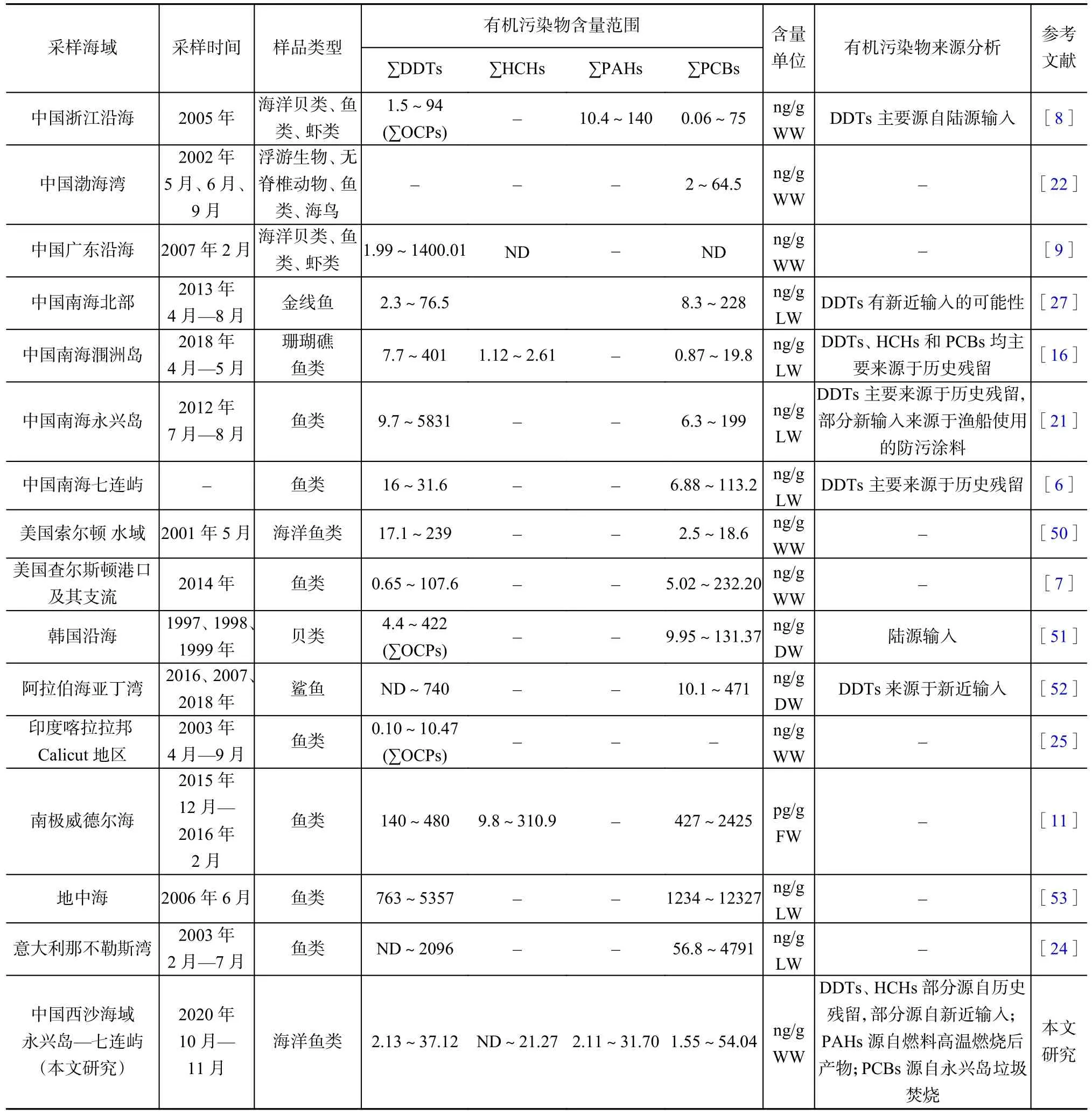
表3 国内外海域鱼体内有机污染物含量及来源Table 3 The concentration and source of organic pollutants in fish in domestic and foreign sea. The concentrations of organic pollutants in marine fish in study area were low.
目前鲜见关于国内外海域鱼体内PAHs的研究,本文研究区PAHs含量低于中国浙江沿海,推测同样是中国西沙海域远离污染源所致。
本研究区鱼体内PCBs含量约为美国查尔斯顿港口、地中海和意大利那不勒斯湾鱼类、阿拉伯海亚丁湾鲨鱼体内含量的1/10,推测与周边工业发展水平相关,而阿拉伯海亚丁湾的鲨鱼体内PCBs含量则与其营养级相关;美国索尔顿水域鱼体内PCBs含量约为美国查尔斯顿港口含量的1/10,则与其为美国西南部内陆湖,湖区周边无发达工业有关。与中国南海涠洲岛、中国南海永兴岛、中国南海七连屿和中国南海北部这些相近海域相比,本研究区PCBs约为相近海域的10倍,推测是由于这些研究仅测定PCBs在鱼体内的脂重,而鱼类脂肪含量仅占4%左右,数据存在一定局限性。
总体来看,中国西沙海域永兴岛—七连屿鱼体内有机污染物含量水平处于国内外海域的低端。
4.3 研究区鱼体内有机污染物生态风险评价
研究区鱼体DDTs总量范围为2.13~37.12ng/g,未超欧盟限值(50ng/g)[54],与US EPA的DDTs总量限定标准(14.4ng/g)相比,有41.2%鱼样超标;参考中国《海洋生物质量》(GB18421—2001)一类质量标准(10ng/g)和二类标准(100ng/g),41.2%鱼样高于一类标准,但低于二类标准。HCHs总量大多远低于中国一类标准(20ng/g)和欧盟限值(10ng/g),仅污色鹦嘴鱼HCHs总量(21.27ng/g)超出欧盟限值,但远低于中国海洋生物二类标准(150ng/g),食用海产品时应重点关注该类鱼种。鱼体OCPs生态风险并不高,但来源分析显示OCPs部分源自新近输入,建议进一步禁止中国南海周边国家和永兴岛居民使用OCPs,警惕鱼体内积蓄OCPs进而影响人体健康。
采用等效毒性量(TEQ)方法来评估PAHs风险,即PAHs的其他化合物相对于苯并芘的潜在致癌风险因子,PAHs的含量乘以等效毒性系数(TEF)得到TEQ值,计算公式为:
式中:Ci为某种PAHs的含量;TEFi为组分i的毒性因子。
TEQ可用来评估不同生物对人类的潜在致癌风险。本研究采用US EPA方法计算生物样品中PAHs的等效毒性量(图3a)。PAHs中苯并[a]芘、二苯并[a,h]蒽的TEF值为1.0,印并[1,2,3-cd]芘、苯并[b]荧蒽、苯并[a]蒽为0.1,苯并[k]荧蒽为0.01,䓛为0.001。鱼类中PAHs的TEQ 值范围为0.000457~1.35ng/g,其中黑身蓝子鱼的TEQ值为最高,达1.35ng/g,污色鹦嘴鱼、红裸颊鲷、三色鹦嘴鱼、蜂巢石斑鱼也有较高的TEQ值,分别为1.32ng/g、1.05ng/g、0.93ng/g、0.76ng/g。采用US EPA的PAHs终生癌症风险(Incremental lifetime cancer risk,ILCR)评价食用健康风险[48],公式为:

图3 永兴岛—七连屿海域鱼体内(a)PAHs的TEQ值和(b)PCBs的TEQ值Fig. 3 (a) The TEQ value of PAHs and (b) the TEQ value of PCBs in fish from Yongxing and Qilianyu islands. The ecological risks of PCBs in fish were low.
式中:TEQ为等效毒性量,ng/g;IR为食物暴露水平,g/d,按照推荐值40g/d计;EF为暴露频率(365d/y);ED为暴露时间(y),取2019年中国居民平均寿命77y;SF为化学致癌物的致癌斜率系数,经口暴露取值为7.3(mg/kg)/d;BW为平均体重(kg),按成人体重70kg计;AT为有效致癌时间(70y×365d/y);10-6为转换因子。
本次调查的海洋鱼体内PAHs的ILCR值与TEQ值(图3a)分布模式相近,US EPA建议的ILCR限值为1.0×10-6[55,56]。蜂巢石斑鱼(3.49×10-6)、红裸颊鲷(4.82×10-6)、黑身蓝子鱼(6.21×10-6)、三色鹦嘴鱼(4.26×10-6)、三叶唇鱼(1.37×10-6)、污色鹦嘴鱼(6.06×10-6)、银蓝子鱼(1.63×10-6)的ILCR值均超过限值。表明上述鱼体内的PAHs对人体健康存在风险,不建议长期食用。物质来源解析显示PAHs来自燃烧源,需减少永兴岛化石燃料燃烧,建议开发海洋能等清洁新能源,从而降低PAHs生态风险。
PCBs同族体中的12种单体毒性比其他同分异构体强,被称为“二噁英类PCBs”。根据WHO推荐用于人类健康危险评价的二噁英类PCBs的TEF值计算鱼类的TEQ值(图3b),其中PCB 118的TEF值为0.0001,PCB 105、PCB 114、PCB 156为0.0005,PCB 180为0.00001[57]。研究区结果表明,鱼类的TEQ值范围为0.0785~3.58pg/g,其中黑身蓝子鱼(3.58pg/g)和污色鹦嘴鱼(2.63pg/g)的TEQ值较高,鱼体内PCBs的TEQ值均低于欧盟水产品TEQ 限值(4pg/g)[58]。可见研究区鱼体内PCBs生态风险低,但已接近限值,需引起重视。
5 结论
利用气相色谱-质谱法对中国西沙海域永兴岛—七连屿海域17种50条鱼体内OCPs、PAHs和PCBs的含量进行测定。结果表明研究区DDTs和PAHs含量低于国内外海域,推测与研究区远离污染源有关,PCBs含量约为欧美国家海域的1/10;来源解析显示OCPs部分源自新近输入,结合前人对中国南海西沙海域沉积物物源的研究,推测研究区OCPs为陆源输入和永兴岛农业种植活动的综合作用,PAHs主要为燃烧源,PCBs则可能来源于局部工业活动;生态风险评价显示,研究区鱼体内OCPs和PCBs均无生态风险,但包括蜂巢石斑鱼在内的7种鱼体内PAHs的终生癌症风险ILCR值超过US EPA限值,揭示长期食用这些鱼类存在潜在致癌风险。
本研究为低纬度热带海域珊瑚礁鱼体内有机污染物生物地球化学行为提供了基础数据,同时为中国西沙海域生态环境质量评价提供依据。但仅采集鱼类样品,未能采集鸟类和贝类等其他生物样品,未来将对有机污染物在西沙海域生态系统中的传递、放大、富集作用开展深入研究。
致谢:中国地质调查局广州海洋地质调查局陈梅高级工程师和张江勇教授级高级工程师对本文提出建设性修改意见,在此致以诚挚的谢意。
BRIEF REPORT
Significance:OCPs, PAHs and PCBs pose a serious threat to human health and sustainable development due to their persistence, bioaccumulation and toxicity, and have attracted great attention worldwide for decades. Although organic pollutants have been banned for many years, they can still be widely detected in organisms near the coast of China and the United States, Antarctica, and the abyss. In order to reduce and prevent organic pollutants, the Ministry of Ecology and Environment and six other departments have released the “Key Control New Pollutant List(2023 Edition)” which still includes OCPs and PCBs. According to statistics from the Food and Agriculture Organization of the United Nations, fish catching in the South China Sea accounts for about 12% of global catches,which is an important protein source for the approximately 300 million coastal countries’ residents(https://m.thepaper.cn/baijiahao_24290238) indicating that the determination and analysis of organic pollutants in fish are of great significance. Xisha is located in the northwest of the South China Sea (SCS), surrounded by multiple developing countries that have extensively used organochlorine pesticides for agricultural production. It is also an important center for electronic waste disposal and a maritime transportation hub, and these factors are potential sources of organic pollutants in the SCS. Organic pollutants enter the SCS through surface runoff,rainwater erosion and atmospheric deposition, thereby affecting marine biota. The marine organisms in Xisha, are rich and diverse. Currently, research on pollutants in Xisha, mainly focuses on seawater and sediment samples[17,28-32],which cannot represent the pollution status of marine biota. Therefore, bioaccumulation of organic pollutants in marine organisms from Xisha, is urgently needed for risk evaluation.
Methods:OCPs, PAHs and PCBs were determined by GC-MS in marine fish. 50 fish were collected, including the honeycomb grouper (Epinephelus merra), red bare cheeked bream (Lethrimus rubrioperculatus), and black bodied bluefish (Siganus punctatissimus)-17 species of fishes. The ratio of DDTs/[dichlorophenyl dichloroethylene(DDE)+dichlorophenyl dichloroethane (DDD)] was used to determine the source of dichlorophenyltrichloroethane(DDTs), the ratio of anthracene (ANT)/[ANT+phenanthrene (PHE)] and fluorene (FL)/[FL+pyrene (PYR)] was used to determine the source of PAHs, and the lifelong cancer risk (ILCR) model was used for ecological risk assessment of fish.
Data and Results:OCPs, PAHs and PCBs concentrations in fish ranged from 2.23-91.57ng/g ww, 2.11-31.70ng/g ww and 1.55-54.04ng/g ww, respectively, average concentrations were 32.50ng/g ww, 17.29ng/g ww and 18.79ng/g ww, respectively, and median concentrations were 16.92ng/g ww, 13.34ng/g ww and 7.61ng/g, respectively. The DDTs concentrations in coastal fish of the United States and Europe ranged from 0.65-107.6ng/g ww, and 763-5357ng/g ww, respectively. The PAHs concentrations in coastal fish in Zhejiang, China ranged from 10.4-140ng/g ww. The PCBs concentrations in fish collected from Mediterranean, Italian coast and the Charleston Harbor in the United States ranged from 1234-12327ng/g lw, 56.8-4791ng/g lw, and 5.02-232.20ng/g ww, respectively. DDTs PCBs and PAHs of the study area were at the lower end of the global range.
DDTs/(DDE+DDD) were used to determine the source of DDTs, and the ratios of DDTs/(DDE+DDD) were >1 in 50% of fish. The ratio of ANT/(ANT+PHE)>0.1 indicated that PAHs were the combustion source, while the ratio ANT/(ANT+PHE)<0.1 indicated that PAHs were the petroleum source. The ratio of ANT/(ANT+PHE) was >0.1 in 88% of fish, indicating that PAHs originated from fossil fuel combustion. The sources of PCBs might be related to local industrial activities on Yongxing Island. The ecological risk assessment showed that the ecological risk of OCPs and PCBs in fish was low, but the ILCR values of PAHs in honeycomb grouper (Epinephelus merra, 3.49),red bare cheeked bream (Lethrimus rubrioperculatus, 4.82), black bodied bluefish (Siganus punctatissimus, 6.21),tricolor parrotfish (Scarus tricolore, 4.26×), cloverleaf lip fish (Cheilinus trilobatus, 1.37), dirty colored parrotfish(Scarus sordidus, 6.06), and silver bluefish (Siganus argenteus, 1.63) exceeded the standard recommended by the US EPA.

