黄精多糖提取工艺优化及其吸湿、保湿性能研究
程茜菲,张玩涛,王飞娟,李娟花,彭修娟,王 静,韩文冬,刘 峰,4*
(1.陕西国际商贸学院,陕西 西安 712046;2.陕西省中药绿色制造技术协同创新中心,陕西 西安 712046;3.临潼区中医院,陕西 西安 7 106003;4.陕西步长制药有限公司,陕西 西安 710075)
黄精(Polygonati Rhizoma)为百合科(Liliaceae)植物滇黄精(Polygonatum kingianumColl. et Hemsl.)、黄精(Polygonatum sibiricumRed.)或多花黄精(Polygonatum cyrtonemaHua)的干燥根茎[1]。自古以来,黄精就被认为是药食同源之品,久服可轻身不老,益寿延年。黄精多糖为黄精中主要成分,是其抗疲劳、抗氧化作用以及延缓衰老的主要活性物质[2]。天然植物的多糖提取物具有低刺激性、安全、营养成分丰富等特性,应用于化妆品可以产生保湿、抗紫外线、抗菌消炎、抗氧化和延缓衰老等功效[3]。
本研究采用热回流法,并运用正交设计进行了黄精多糖提取工艺优化;并对黄精多糖的吸湿保湿、护肤性能进行研究;采用双指数、一级过程、零级过程等6 种数学模型探索了黄精多糖的吸湿机制[4-6],从而为黄精多糖等多糖生产企业和研究者提供理论依据。
1 材料与方法
1.1 材料与仪器
黄精,购自西安中药材市场,经陕西国际商贸学院雷国莲教授鉴定为百合科植物黄精(Polygonatum sibiricumRed.)的干燥根茎;D-无水葡萄糖(202109,中国药品生物制品检定所);乙醇、无水乙醇、苯酚、浓硫酸、甘油以及透明质酸为分析纯。
TU - 1810 紫外分光光度计(北京普析通用有限公司);SHH - 500GSD - 2T综合药品稳定性试验箱(重庆康诚永生试验设备有限公司);Milli - Q Reference超纯水仪(默克化工技术上海有限公司)。
1.2 方法
1.2.1 样品前处理
将黄精药材在60℃条件下干燥4 h后,粗碎。
1.2.2 多糖含量测定
称取D-无水葡萄糖适量,加纯化水溶解制成质量浓度分别为每升含17、25、34、42、51 mg的标准品溶液。分别吸取标准品溶液2 mL,加入2 mL 体积分数为5%苯酚溶液和5 mL 浓硫酸,摇匀静置30 min。应用紫外分光光度仪在490 nm 处测定吸光度值,以吸光度值为Y轴,浓度为X轴,得线性回归方程Y= 0.068 2X- 0.0007,R2= 0.999 5。吸取样品溶液2 mL,加入2 mL 体积分数为5%苯酚溶液和5 mL 浓硫酸,摇匀静置30 min。在490 nm 处测定吸光度值,结合线性回归方程计算样品多糖含量。
1.2.3 黄精多糖提取工艺优化
1.2.3.1 单因素实验
将回流提取时间固定为30 min,提取次数固定为1 次,考察料液比1 ∶ 10、1 ∶ 15、1 ∶ 20、1 ∶ 25 和1 ∶ 30 (g/mL)对结果的影响。将料液比固定为1 ∶ 20 (g/mL),提取次数固定为1 次,考察回流提取时间(30、60、90、120 和150 min)对结果的影响。将料液比固定为1 ∶ 20 (g/mL),回流提取时间固定为120 min,考察提取次数(1、2、3、4 和5 次)对结果的影响。试验过程中,平行试验均3次。
1.2.3.2 正交试验设计
根据单因素结果,采用正交设计L9(34)进行提取工艺优化试验方案设计,根据试验方案进行试验,提取液进行适宜的稀释。
1.2.3.3 工艺验证
根据最优提取工艺条件,平行试验3 次,计算3次试验结果的RSD值。
1.2.4 吸湿率测定及拟合
1.2.4.1 吸湿率测定
精密称定黄精多糖、甘油、透明质酸各0.5 g,置于已恒重的称量瓶中,平行3 份。再分别置于综合药品稳定性试验箱中(25℃,相对湿度43%;25℃,相对湿度81%),放置1、2、3、4、5、6、12、36、48、60、72 h后取出,称定质量,计算吸湿率,式1。
1.2.4.2 拟合
以时间为横坐标、吸湿率为纵坐标做吸湿曲线图,采用SPSS 24 软件,按照表1 中6 种模型进行拟合。

表1 吸湿过程模型Tab.1 Hygroscopic process mode
1.2.5 保湿率测定
精密称定黄精多糖、甘油、透明质酸各0.5 g,置于称量瓶中,分别加入纯水0.5 g,平行3 份,置于装有干硅胶箱(25℃)中48 h,称重,计算保湿率,式2。
注:y为吸湿百分率;x为时间;y0为初始含水率;y∞为平衡吸水率;A、B、C为模型参数;k为吸湿速率常数。
1.2.6 人体皮肤水分测试
供试品制备:将质量浓度为2 g/L的黄精多糖溶液添加到市售常用面霜中,且使得面霜中黄精多糖溶液的质量分数分别达到5%,10%,15%和20%,以质量分数为5%的透明质酸液(2 g/L)、质量分数5%的甘油溶液制成的面霜为对照。
测试方法:受试者为20 ~ 35 岁的志愿者,受试者人数为11。试验前,受试者净洗左右前臂并搽干,平衡30 min(22℃,RH = 50% ~ 65%的环境中),于受试者左右前臂上划出测试区域(3 cm × 3 cm),测定各受试区域的皮肤水分含量,每个区域测3 个部位,以平均值作为最终测试值。
1.3 数据处理
采用SPSS 24 统计软件完成数据分析,多组间比较采用方差分析,组间两两比较采用多重比较分析,P< 0.05表示差异有统计学意义。
2 结果与分析
2.1 单因素实验
图1 ~ 3分别为液料比、回流提取时间和提取次数对黄精多糖提取率影响的折线图,并对数据进行多重比较分析。由图可知不同料液比对提取率的影响呈先增大后减小的趋势,当料液比为1 ∶ 20 (g/mL)时多糖提取率最高,该水平与其它水平均有显著性差异(P< 0.05);回流提取时间对提取率的影响呈先增大后减小的趋势,当提取时间为120 min时多糖提取率最高,该水平与其它水平均有显著性差异(P< 0.05);提取次数对提取率的影响呈先增大后减小且趋平的势态,提取次数为2 次时多糖提取率最高,该水平与其它水平均有显著性差异(P< 0.05),综上得出因素水平表见表2。
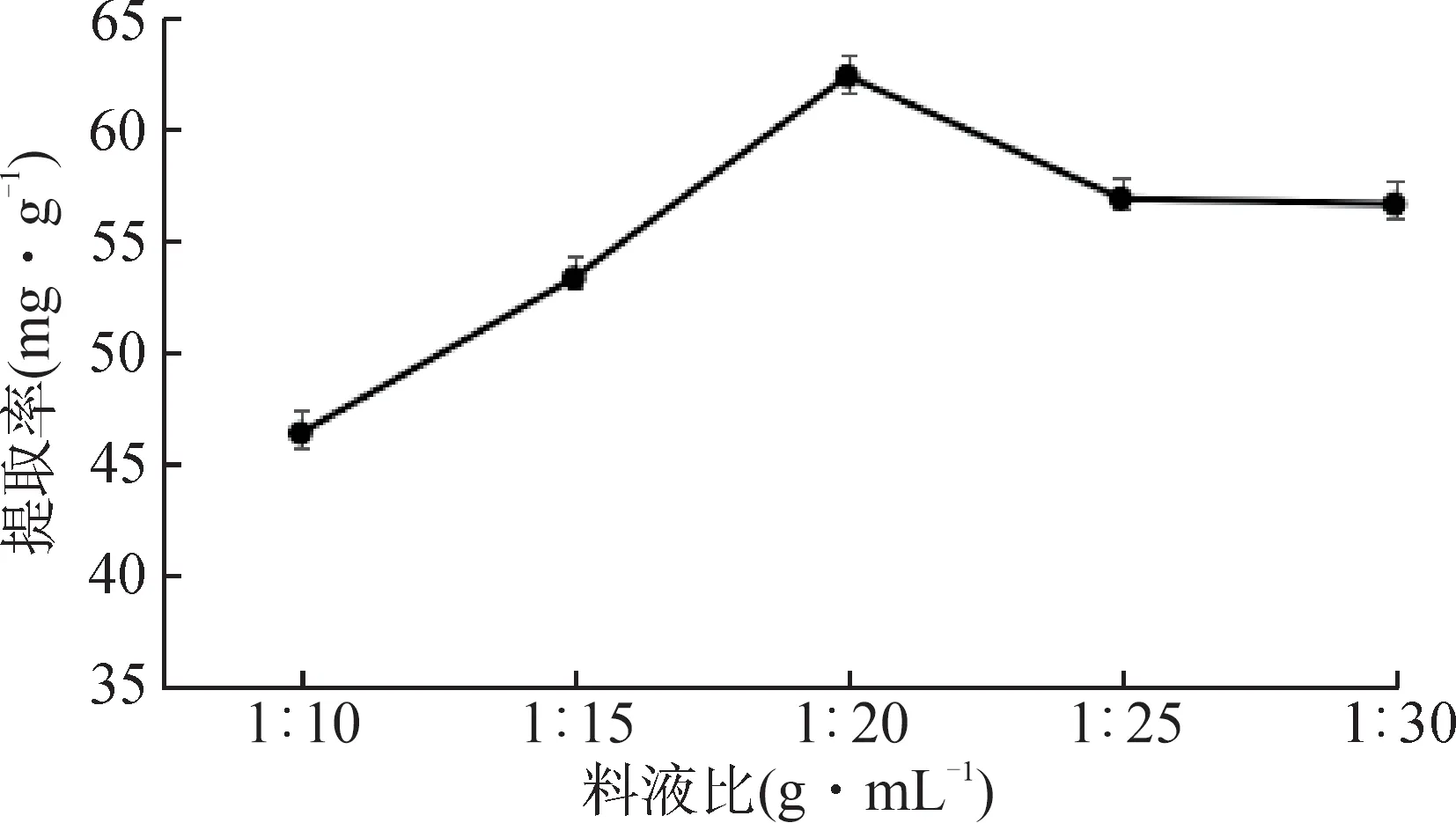
图1 液料比对黄精多糖提取率的影响Fig.1 Effect of liquid-to-material ratio on extraction rate of Polygonati Rhizoma polysaccharides

图2 回流提取时间对黄精多糖提取率的影响Fig.2 Effect of reflux extraction time on extraction rate of Polygonati Rhizoma polysaccharides

图3 提取次数对黄精多糖提取率的影响Fig.3 Effect of extraction times on extraction rate of Polygonati Rhizoma polysaccharides

表2 正交试验因素水平表Tab.2 Orthogonal test factor level table
2.2 正交试验
黄精多糖提取工艺优化实验方案及结果见表3。

表3 试验方案及结果Tab.3 Test plan and results
通过表3 中R 值分析,料液比影响最大,其次为提取时间,最小为提取次数。运用方差分析法计算的F提取次数值为0.033,小于临界值19(α = 0.05),说明提取次数对黄精多糖提取率的影响不显著,考虑生产过程中操作便捷性、安全性和经济环保性,确定最佳提取工艺条件为料液比是1 ∶ 25 (g/mL),提取时间是150 min,提取次数为1 次。
按照最佳提取工艺条件,平行试验3 次,黄精多糖平均提取率为68.93 ± 1.27 (mg/g),RSD 值为1.85%,该工艺重复性和可操性较强。
2.3 吸湿性能
根据1.2.4 方法测定,以吸湿率% - 时间做吸湿动力曲线,见图4、5。从图可以看出,3 种样品初始阶段吸水速率均较快,大约24 h 后黄精多糖和透明质酸吸水速率变慢。相对湿度43%条件下,黄精多糖、透明质酸和甘油3条吸湿曲线0 ~ 3 h基本重合,说明吸湿行为一致,3 ~ 24 h 时3 条曲线分离、吸湿率相差较大,24 h时黄精多糖、透明质酸吸湿率趋近平衡。相对湿度81%条件下,3 条吸湿曲线分布趋势与相对湿度43%相似。

图4 相对湿度43%下样品吸湿率随时间的变化Fig.4 Changes of sample moisture absorption with time at 43% relative humidity

图5 相对湿度81%下样品吸湿率随时间的变化Fig.5 Changes of sample moisture absorption with time at 81% relative humidity
在不同湿度下,黄精多糖均表现出了一定的吸湿性能。因为黄精多糖及透明质酸的多羟基大分子结构有利于其与水分子形成氢键从而吸收水分,但其表面吸收水分后很容易溶胀,从而阻止其内部分子继续吸收水分。因此,与甘油相比,黄精多糖与透明质酸更容易达到吸湿平衡。
相对湿度43%、81%下,6 种吸湿模型的拟合结果见表4。R2越接近1,RSS 越接近0,则模型对试验数据拟合的越好[7],因此相对湿度43%、81%下双指数模型最佳。双指数模型是根据物质质量守恒定律和费克扩散第一定律建立的中药提取物吸湿过程动学模型,从表4 拟合结果可以看出,模型参数A、B 均大于零,因此表面吸湿速率常数k1> 内部扩散速率常数k2,而黄精多糖在不同的相对湿度环境下,表面吸湿速率常数k1(0.602、0.339)、内部扩散速率常数k2(0.067、0.028)有明显差异。因此,黄精多糖吸湿量主要由内部扩散决定。

表4 6种吸湿模型拟合结果Tab.4 Fitting results of six moisture absorption models
2.4 保湿性能
根据1.2.5方法测定并绘制图,见图6。由图知,黄精多糖、透明质酸和甘油48 h 保湿性能强弱顺序为透明质酸 > 黄精多糖 > 甘油,并进行单因素方差分析,3 种物质保湿性有显著性差异(P< 0.05)。黄精多糖中的亲水基团能更好地降低水分有效扩散系数,导致水分扩散能力减弱,从而具有良好的持水保湿作用。当黄精多糖与甘油合用时保湿性低于单一物质,说明两者合用具有拮抗作用,同时对数据进行多重比较分析,结果显示两者合用与单一物质保湿性有显著性差异(P< 0.05);多糖与透明质酸合用时保湿性高于单一物质,说明两者合用具有协同作用,多重比较结果显示两者合用与甘油的保湿性有显著性差异(P< 0.05)。这表明黄精多糖具有潜在的替代昂贵天然保湿剂透明质酸的价值。

图6 在干燥硅胶条件下样品的保湿率Fig.6 The moisture retention rate of the samples under dry silica gel condition
2.5 对皮肤水分含量影响
根据1.2.6方法测定并绘制图7,由图看出,随着黄精多糖的质量分数从5%增加到20%,皮肤水分含量变化不明显,但明显高于空白面霜皮肤含水量,采用F 检验法对实验数据进行方差分析,结果F > F0.05,涂抹不同浓度黄精多糖溶液的受试区域与空白面霜有显著性差异,说明黄精多糖能够有效地促进皮肤水分含量增加。添加黄精多糖、甘油、透明质酸的面霜在相同时间段测量的皮肤含水量均高于空白面霜,采用F 检验法对实验数据进行方差分析,结果F < F0.05,说明加黄精多糖、甘油、透明质酸的面霜相互间没有明显差异。

图7 不同样品对皮肤含水量影响随时间的变化Fig.7 Influence of different samples on skin moisture content over time
3 讨论与结论
3.1 黄精多糖吸湿、保湿性
根据文献报道银耳多糖[8]、山药多糖、白及多糖[9]等植物多糖具有良好的吸湿保湿性能。多糖这一性能可能与其分子结构中含有大量的羟基有关,另外多糖还可在皮肤表面形成一层均匀的薄膜[10]。本研究发现黄精多糖在不同相对湿度环境下,表面吸湿速率常数k1、内部扩散速率常数k2有明显差异,因此,可通过环境相对湿度来控制黄精多糖的吸湿率,在相对湿度较大的环境中,黄精多糖含水量明显上升。
3.2 探索黄精多糖在护肤品中的应用
报道显示,50 mg/mL石莲花多糖溶液涂抹于皮肤,1 h 内可以保持不错的水分含量,在60 min 内具有良好的保湿效果[12];1%的铁皮石斛多糖溶液涂抹于皮肤在 30 min 内保湿能力较10%甘油更强[13]。本研究结果显示,黄精多糖溶液具有良好的保湿性,且在12 小时内其保湿效果与甘油、透明质酸无显著差异。石莲花多糖、铁皮石斛多糖和黄精多糖均为植物多糖,植物多糖的分子结构能够与水形成大量的氢键,在皮肤表面形成“锁水膜”防止皮肤水分流失,达到持久保湿效果[11]。通过本研究可进一步为植物多糖应用于化妆品领提供理论支撑。
3.3 现状与展望
查阅文献知,黄精多糖现有研究主要包括提取工艺、结构特征、抗氧化、药理作用等方面,未见其吸湿保湿性能和护肤应用两方面的研究,但其他多糖应用于护肤品中已有报道。
植物多糖具有保湿、抗氧化、抗衰老等作用,可用于化妆品中起到改善皮肤环境、美肤护肤的效果[14]。透明质酸是护肤品常用天然成分之一,但其价格较高,通过本研究结果表明,黄精多糖有望部分替代天然成分透明质酸,为黄精又增加了一新用途,为黄精种植户可增加一定的经济收入;此外黄精多糖吸湿动力学研究可为其生产企业生产、保存的环境提供数据参考。
本研究应用的黄精多糖为粗制品,研究结果显示其吸湿保湿及护肤性能较好,由此可初步推断纯化后的黄精多糖活性或可更高,在后续的研究中将进一步对黄精多糖进行分离、纯化,并对纯化品进行深入研究。

