免疫制剂卡瑞利珠单抗联合同步放化疗治疗局部晚期NSCLC的临床研究
国 兵 吕玉凤
(1.泰安市中心医院放疗科,山东 泰安,271000;2.泰安市中心医院肿瘤微创科,山东 泰安,271000)
非小细胞肺癌(Non-Small Cell Lung Cancer,NSCLC)是肺癌的主要类型之一,占据了肺癌病例的大多数。相对于小细胞肺癌,NSCLC的病情通常发展较缓慢。包括多种亚型,其中最常见的亚型包括腺癌、鳞癌和大细胞癌,这些亚型在组织学和分子特征上有所不同,因此可能对治疗和预后产生影响[1-2]。在治疗局部晚期非小细胞肺癌(NSCLC)的过程中,同步放化疗是目前的标准治疗方案之一。然而,由于NSCLC在初诊时多数患者已失去手术机会,其治疗效果仍面临一定的挑战[3]。因此,寻找新的治疗策略以提高患者的生存率和生活质量变得尤为重要。近年来,免疫疗法作为肿瘤治疗的一项重要领域,取得了显著的进展。卡瑞利珠单抗作为一种PD-1抗体,在多种恶性肿瘤的治疗中展示出了潜在的疗效。其通过抑制PD-1与其配体PD-L1的结合,激活患者自身的免疫系统,增强对肿瘤细胞的攻击能力。在局部晚期NSCLC的治疗中,越来越多的学者开始将卡瑞利珠单抗与同步放化疗相结合,以期提高治疗效果[4-5]。然而,对于该联合治疗方案的疗效、安全性以及对患者生存率的影响仍需要进一步的研究和探索。本文将2020年5月—2022年2月泰安市中心医院收治的80例局部晚期NSCLC患者作为研究对象,现报道如下。
1 资料与方法
1.1 一般资料
选取2020年5月—2022年2月泰安市中心医院收治的80例局部晚期NSCLC患者作为研究对象,根据中心随机法将其分为研究组和对照组,每组40例。对照组中,男性25例,女性15例;年龄50~77岁,平均年龄(61.45±2.57)岁;身体质量指数(BMI):18~29 kg/m2,平均BMI(23.32±1.34)kg/m2;肿瘤分期:Ⅲa期26例,Ⅲb期14例;病理类型:腺癌23例,鳞癌17例。研究组中,男性24例,女性16例;年龄51~76岁,平均年龄(61.34±2.63)岁;BMI:18~28 kg/m2,平均BMI(23.26±1.32)kg/m2;肿瘤分期:Ⅲa期25例,Ⅲb期15例;病理类型:腺癌24例,鳞癌16例。两组患者的一般资料比较,差异均无统计学意义(P>0.05),具有可比性。患者及其家属对本研究内容知情并签署知情同意书。本研究获得泰安市中心医院医学伦理委员会审批通过。
1.2 纳入与排除标准
纳入标准:①经病理证实均为局部晚期NSCLC患者,且EGFR驱动基因无突变,符合第八版《内科学》[6]相关标准;②根据AJCC癌症分期标准肿瘤分期均处于Ⅲa~Ⅲb期;③均身体状况良好,可耐受放化疗及免疫治疗;④近期无其他治疗;⑤预计生存期限在3个月以上。
排除标准:①伴有其他恶性疾病;②过敏体质,对相关治疗过敏;③肝肾功能障碍;④精神障碍;⑤存在禁忌证。
1.3 方法
对照组实施同步放化疗。放疗:运用医用直线加速器(6 MV-X),行强调放射治疗。首先,勾画出肿瘤靶区及危及器官,常规进行分割放疗,单次放疗剂量2 Gy,5次/周,总照射剂量为60 Gy。化疗方案:对于腺癌患者以PC方案进行,21 d/周期,第1天静脉滴注注射用培美曲塞二钠(生产企业:扬子江药业集团有限公司,国药准字H20143380,规格:0.5 g)500 mg/m2,第1~3天静脉滴注顺铂注射液(生产企业:广东岭南制药有限公司,国药准字H20183341,规格:10 mL:10 mg)75 mg/m2;对于鳞癌患者以EP方案治疗,即顺铂+依托泊苷。顺铂注射液静脉滴注75 mg/m2,静脉滴注依托泊苷注射液(生产企业:江苏恒瑞医药股份有限公司,国药准字 H32025583,规格:5 mL:100 mg)100 mg/m2;一个周期21 d,共治疗6个周期。放疗周期中的第1天和第29天同步2个周期静脉化疗,放疗结束后以相同的方案进行化疗4个周期。
观察组在对照组基础上联合免疫制剂卡瑞利珠单抗治疗。放疗开始后的每三周进行一次免疫治疗,放疗结束后以同样的方案维持免疫治疗。注射用卡瑞利珠单抗(生产企业:江苏恒瑞医药股份有限公司,国药准字 S20190027,规格:200 mg/瓶),第1天,静脉注射200 mg,每三周1次。1个周期21 d,共治疗6个周期。
1.4 观察指标
①治疗前后两组血清肿瘤标志物比较:分别在治疗前及治疗6个周期后对其肿瘤标志物进行检测,抽取患者静脉血,标本5 mL,离心10 min,离心半径10 cm,收集上层血清,以酶联免疫吸附试验进行检测,包括糖类抗原125(Carbohydrate antigen 125,CA125)、癌胚抗原(Carcinoembryonic antigen,CEA)、细胞角质素片段抗原21-1(Cytokeratin-fragment antigen 21-1,CYFRA21-1)。②两组近期疗效比较:参考《实体瘤的疗效评价标准》[7],其中,完全缓解:经周期性治疗后,其症状完全消失,肿瘤病灶消失,实验室检查结果恢复正常,维持时间在30 d以上;部分缓解:肿瘤病灶较治疗前缩小30%及以上,且保持时间4周以上;疾病稳定:治疗后,肿瘤病灶较治疗前缩短不足30%或者增加了20%;疾病进展:与治疗前比较,肿瘤病灶没有缩小,增加了20%及以上,甚至出现了新的病灶。客观缓解率(ORR)=(完全缓解+部分缓解)例数/总例数×100%;疾病控制率(DCR)=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%。③两组不良反应发生率:包括骨髓抑制、皮肤损伤、脱发、胃肠道反应、放射性食管炎、放射性肺炎(包括免疫性肺炎)、毛细血管增生症。不良反应发生率=(骨髓抑制+皮肤损伤+脱发+胃肠道反应+放射性食管炎+放射性肺炎+毛细血管增生症)例数/总例数×100%。
1.5 统计学方法
运用专业统计学软件SPSS 26.0对其数据进行分析,计量资料以(±s)表示,两组间比较方差齐且符合正态分布时采用t检验;计数资料以[n(%)]表示,结果行χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后两组血清肿瘤标志物比较
治疗前,两组CA125、CEA、CYFRA21-1水平比较,差异无统计学意义(P>0.05);治疗6个周期后,两组CA125、CEA、CYFRA21-1水平均降低,且研究组各项指标均低于对照组,差异有统计学意义(P<0.05),见表1。
表1 治疗前后两组血清肿瘤标志物比较 (±s)
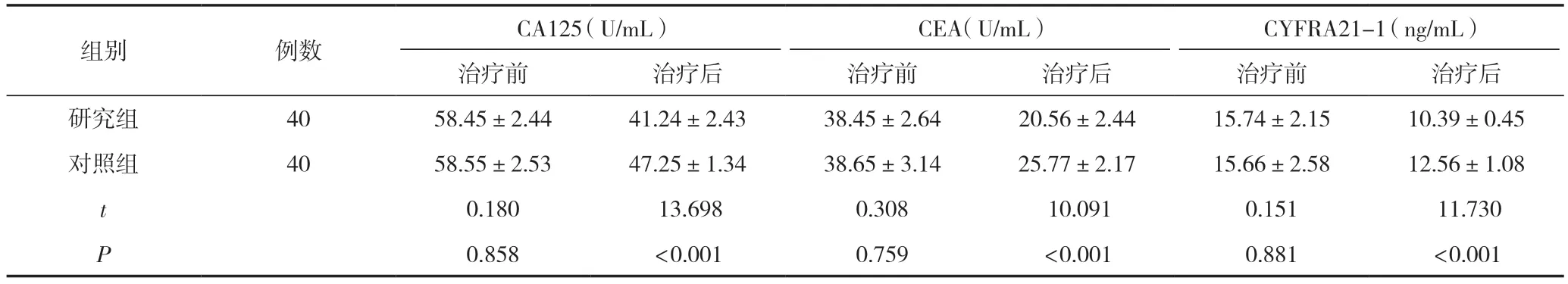
表1 治疗前后两组血清肿瘤标志物比较 (±s)
CA125(U/mL)组别例数CEA(U/mL)CYFRA21-1(ng/mL)治疗前治疗后治疗前治疗后治疗前治疗后研究组4058.45±2.4441.24±2.4338.45±2.6420.56±2.4415.74±2.1510.39±0.45对照组4058.55±2.5347.25±1.3438.65±3.1425.77±2.1715.66±2.5812.56±1.08 t 0.180 13.6980.308 10.0910.151 11.730 P 0.858<0.0010.759<0.0010.881<0.001
2.2 两组近期疗效比较
研究组客观缓解率(ORR)、疾病控制率(DCR)均高于对照组,差异有统计学意义(P<0.05);且无进展生存时间(PFS)(10.54±2.45)个月长于对照组的(7.45±1.34)个月,t=6.998,差异有统计学意义(P<0.05),见表2。
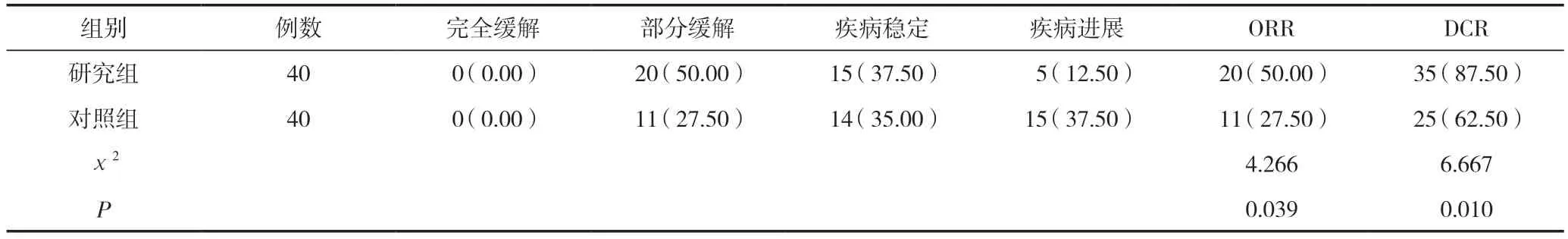
表2 两组近期疗效比较 [n(%)]
2.3 两组不良反应发生率比较
两组不良反应发生率比较,差异无统计学意义(P>0.05),见表3。

表3 两组不良反应发生率比较 [n(%)]
3 讨论
3.1 局部非小细胞肺癌及同步放化疗治疗分析
对于新诊断的非小细胞肺癌(NSCLC),大约有20%~25%的病例处于局部晚期阶段。在这些局部晚期NSCLC中,约有30%的患者在首次诊断时已经失去了手术切除的机会[8]。局部晚期非小细胞肺癌是指肺癌在初诊时已经扩散到肺部附近的淋巴结或周围组织,但尚未远处转移至其他器官。通常,局部晚期NSCLC被分为Ⅲa期和Ⅲb期,具体取决于肿瘤的大小、淋巴结受累情况和扩散范围。其特点是肿瘤已经超出肺部的局限性,并可能侵犯到邻近的结构和组织。临床上,对于局部晚期NSCLC的治疗,由于其病变范围较为广泛,肿瘤局部进展到周围组织或淋巴结,无法通过手术完全切除,故临床上多采取同步放化疗作为主要治疗方案。化疗可以通过杀死肿瘤细胞和抑制肿瘤生长来减小肿瘤负担,而放疗可以通过辐射杀死肿瘤细胞和控制肿瘤局部进展。这两种治疗方法的协同作用可提高治疗效果,延长生存期。通过化疗和放疗的联合应用,以达到减少肿瘤负荷、控制局部病变和减少远处转移的目的。另外,NSCLC常常具有转移倾向,即肿瘤细胞可以通过血液或淋巴系统扩散到身体其他部位。化疗可以通过靶向肿瘤细胞的全身治疗药物,预防或减少转移的发生。同时,放疗可以通过辐射杀灭潜在的转移病灶,减少转移的风险。然而,即使经过同步放化疗治疗,部分局部晚期NSCLC患者仍可能无法完全切除肿瘤或存在治疗失败的情况,因此,近年来,越来越多的研究和临床实践开始将免疫疗法与同步放化疗相结合,以期提高治疗效果。
3.2 局部非小细胞肺癌免疫疗法分析
免疫疗法通过激活患者自身的免疫系统来攻击肿瘤细胞,具有潜在的治疗优势[11]。其中,PD-1/PD-L1抑制剂是一类免疫疗法药物,用于治疗多种恶性肿瘤,例如常用于非小细胞肺癌(NSCLC)。在正常情况下,PD-1与PD-L1的结合可以抑制免疫细胞的活化,从而防止免疫系统对自身组织的攻击。PD-1/PD-L1抑制剂的作用机制是通过抑制PD-1与PD-L1的结合,重新激活免疫细胞,增强它们对肿瘤细胞的攻击能力。在局部晚期NSCLC的治疗中,PD-1/PD-L1抑制剂常常与同步放化疗联合使用。其目的是通过放化疗来减少肿瘤负荷和局部病变,并通过PD-1/PD-L1抑制剂激活免疫系统,增强免疫细胞对肿瘤细胞的杀伤能力[12]。这种联合治疗方案在一些局部晚期NSCLC患者中显示出了显著的治疗效果和生存益处。
3.3 卡瑞利珠单抗联合同步放化疗治疗局部晚期NSCLC的有效性分析
在肿瘤标志物方面,肿瘤标志物是肿瘤疾病发生及进展期间所产生的物质,其水平能够反映患者疾病的发生发展情况,定期对其指标进行检测,对治疗效果的评价具有重要的意义。CA125是肺癌疗效评价及评估预后的有效指标;CEA可反映出肺癌转移的情况,是临床上常用的一种评价恶性肿瘤的标志物;CYFRA21-1属于一种细胞角蛋白,在局部晚期NSCLC中呈现出高表达,且病变越严重,其表达水平越高[13]。本文研究结果显示,经治疗6个周期后,研究组CA125、CEA、CYFRA21-1水平均低于对照组,差异有统计学意义(P<0.05)。由此可知,卡瑞利珠单抗与同步放化疗联合治疗局部晚期非小细胞肺癌(NSCLC)可加快肿瘤标志物水平恢复正常,说明病情得到有效控制。这是因为,卡瑞利珠单抗是一种PD-1抑制剂,通过与PD-1结合,阻断PD-1/PD-L1信号通路的激活,使肿瘤细胞难以逃避免疫监视,从而降低CA125、CEA、CYFRA21-1水平。此外,卡瑞利珠单抗还能够纠正T细胞增殖异常,增强内源性抗肿瘤免疫效应,进一步抑制肿瘤的进展。
在有效率方面,研究组客观缓解率(ORR)、疾病控制率(DCR)均高于对照组,差异有统计学意义(P<0.05);且无进展生存时间(PFS)长于对照组,差异有统计学意义(P<0.05)。由此可知,卡瑞利珠单抗与同步放化疗联合治疗局部晚期非小细胞肺癌(NSCLC)可有效提高疾病控制率并延长生存期限。这是因为,与传统的化疗方案相比,将卡瑞利珠单抗与同步放化疗联合使用可以协同增效,通过不同的作用机制阻止肿瘤的生长,并且能够避免化疗对免疫功能的降低。这种联合治疗方案的优势在于综合了放化疗的局部控制作用和卡瑞利珠单抗的免疫增强作用,从而显著改善了患者的治疗效果和预后[14-15]。
在不良反应方面,两组不良反应发生率比较,差异无统计学意义(P>0.05)。由此可知,卡瑞利珠单抗与同步放化疗联合治疗局部晚期非小细胞肺癌(NSCLC)具有较高的安全性,不增加不良反应,进一步说明卡瑞利珠单抗不良反应少,且多数具有可逆性,只要早期做好识别并及时干预,可保证患者治疗的安全性。不过需要注意的是,在使用免疫抑制剂治疗局部晚期NSCLC时,药物通过激活免疫系统来对抗肿瘤细胞,但有时会导致免疫系统攻击肺部组织,引发肺炎症状,故应密切监测患者肺功能,降低免疫性肺炎的风险。
综上所述,免疫制剂卡瑞利珠单抗结合同步放化疗治疗局部晚期非小细胞肺癌(NSCLC)的临床效果良好,可进一步改善血清肿瘤标志物水平,不增加不良反应,值得应用。

