一氧化氮供体型药物对牙龈卟啉单胞菌体外抗菌活性的影响
江玉梅 张紫薇 王吉天 杨 宇*
(1.京东口腔医院综合科,北京 101200;2.首都医科大学附属北京朝阳医院口腔科,北京 100043)
近年来,随着口腔种植学的迅猛发展,种植体修复已经被越来越多地应用于临床。种植体周围炎是导致种植体失败的主要原因之一,其患病率高达11%~47%[1-2]。牙龈卟啉单胞菌(Porphyromonasgingivalis,P.g)是种植体周围炎的主要致病菌,并主要以菌斑生物膜形式附着在种植体表面。如何有效抑制或清除P.g附着以控制感染已经成为维护种植体周围组织健康、减少种植体周围骨吸收、降低种植体周围炎发生率的重要策略[3]。
目前科研工作者针对P.g的抗抑菌做了大量的研究工作,概括起来主要有两种主流方法:一是通过金属离子(银离子、铜离子等)杀灭P.g,但铜、银等金属离子对人体同样存在较大危害[4];二是通过抗生素药物杀灭P.g,然而,抗生素的长期和不正当使用容易导致P.g产生耐药性[5]。因此,寻找一种不仅能有效杀灭P.g而又不会令P.g产生耐药的药物是目前种植体周围炎的一个热点研究方向。
一氧化氮(nitric oxide,NO)是一种半衰期短的多效分子,广泛存在于人体各种组织和细胞中,参与调节各种生理过程[6]。NO具有高度的生物活性,可通过细胞膜快速扩散,在体内半衰期只有3~6 s,作用过程中不易产生耐药性和不良反应[7]。基于NO的以上特点,近期针对NO抗菌性能的研究受到了广泛的关注。研究[8]表明,NO与牙周病、口腔黏膜病、口腔癌以及唾液腺疾病等口腔疾病的发生发展密切相关,与NO有关的生物学途径研究将有望成为治疗口腔疾病的新靶点。本研究旨在探究不同浓度NO对P.g的体外抗菌活性及其可能的抗菌机制,为临床应用NO供体型药物预防和治疗种植体周围炎提供新的理论依据。
1 材料与方法
1.1 菌种准备
P.g(ATCC33277)购于美国典型菌种收藏中心。厌氧环境下培养P.g(ATCC33277)至对数生长期,将生长良好的P.g挑一个单克隆在脑心浸液(brian heart infusion,BHI)培养基中培养12 h后,用酶标仪检测菌液A600值大约为1.0左右,然后用新鲜的BHI培养基将A600为1.0的菌液稀释为A600为0.1左右,此时的细菌浓度大约为1.5×108CFU/mL用于后续实验。
1.2 S-亚硝基-N-乙酰基-DL-青霉胺(S nitroso N acetylpenicillamine,SNAP)、乙酰青霉胺(N-acetylpenicillamine,NAP)、佐剂溶液的制备和分组
用0.9%(质量分数)的氯化钠注射液(以下简称生理盐水)将SNAP稀释,配制为10、30、50 mmol/L 3 个浓度,分别加入佐剂,标记为SNAP-10、SNAP-30、SNAP-50。经过滤器除菌后,放于37 ℃ 培养箱放置5 h,备用。
1.3 NO供体处理P.g实验
(1)将状态良好的P.gATCC33277(A值为0.1左右),分别取1 mL菌液放置于5支灭菌后的15 mL离心管中。
(2)将SNAP-10、SNAP-30、SNAP-50、NAP、佐剂分别取4 mL加入到步骤1)中的5支无菌离心管中,并做好标记分别为SNAP-10组、SNAP-30组、SNAP-50组、NAP组、佐剂组。
(3)以上溶液在37 ℃厌氧环境下分别孵育1.5 h和3 h,离心、缓慢洗涤3遍后,加入1 mL BHI液体培养基,将菌团块吹打均匀。
(4)将菌悬液按照梯度稀释法处理后,分别涂布在固体培养基上,放在厌氧环境37 ℃恒温培养箱中孵育5 d,取出统计菌落数。每组至少涂布3个培养皿,实验至少重复3次。
存活率=(实验组CFU/对照组CFU) × 100%
1.4 NO供体对P.g的抗菌活性研究
1.4.1 NO供体处理P.g细菌悬液后总NO定量分析
(1)将A600值为0.1左右的P.g菌液与SNAP按照1∶4的比例混合后,在37 ℃厌氧环境下孵育3 h,离心、洗涤后备用。
(2)根据实验结果确定好最佳的稀释浓度后,加约1 mL去离子水至 5 mg 还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH) 中,颠倒混匀溶解后,再用去离子水定容至3 mL,配制成 2 mmol/L NADPH。
(3)取出试剂盒中的Griess ReagentⅠ和Ⅱ溶液,按照表1加入标准品、样品和各种检测试剂,进行相应的检测。
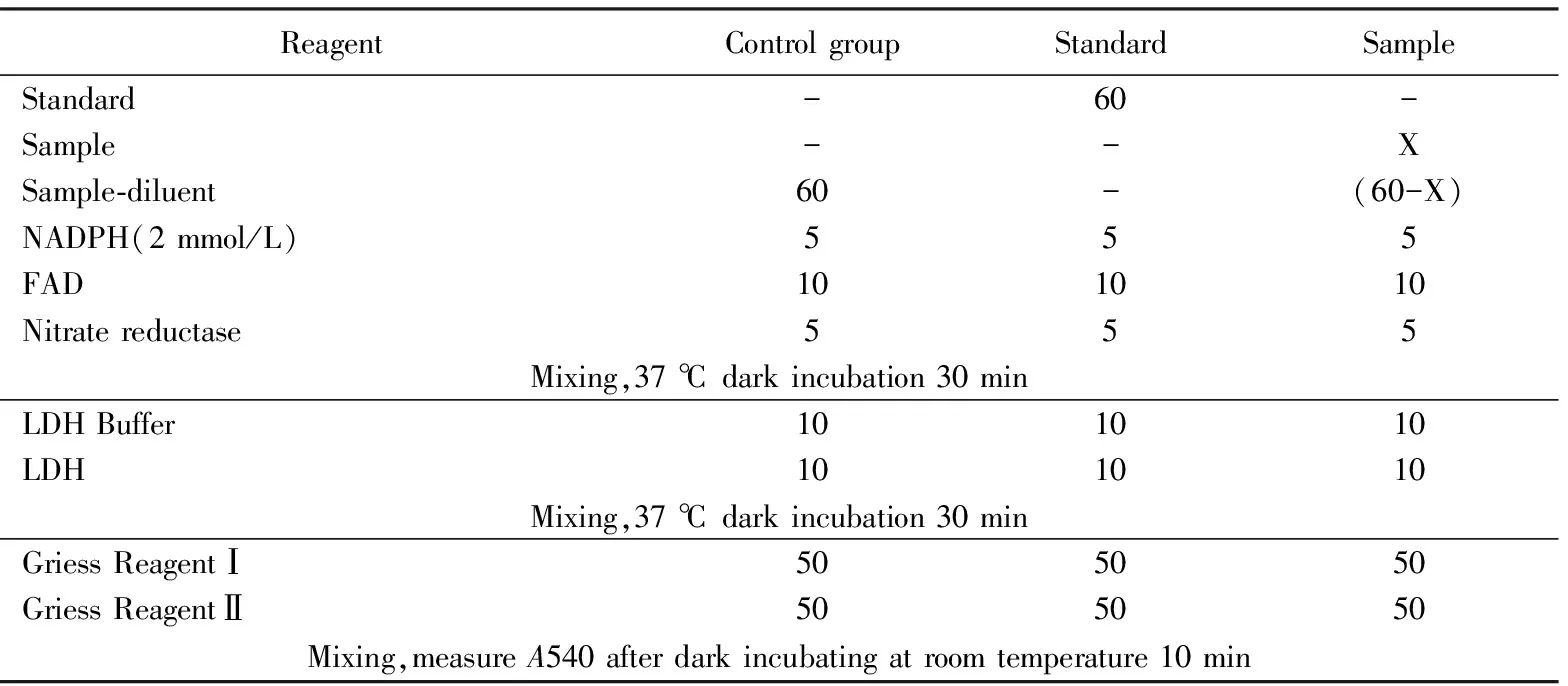
表1 总一氧化氮定量分析实验过程
(4)通过酶标仪对细菌悬液中的总NO进行定量试验分析。实验重复3次,每次独立实验中每个检测组至少保证有3个平行样品。
1.4.2 NO处理P.g后胞内活性含氧基团(reactive oxygen species,ROS)浓度的变化
(1) 装载ROS荧光探针:分别将对照组(NAP、佐剂组)、SNAP-10组、SNAP-30组、SNAP-50组与菌液进行反应30 min,比例按照细菌∶SNAP=1∶4进行反应。
(2)按照1∶1 000的比例稀释ROS活性氧检测试剂盒-2′,7′-二氯荧光素二乙酸酯(2′,7′-Dichlorodihydrofluorescein diacetate DCFH-DA,S0033,碧云天生物技术公司),使其终浓度为10 μmol/L。加入1 mL DCFH-DA到各个实验组,在37 ℃恒温箱中厌氧培养20 min。每隔5 min摇动一下细菌,让探针充分与细菌接触。
(3)ROS上机检测将上述样品分别放在激光共聚焦显微镜上直接观察,显微镜的工作检测参数为488 nm激发波长,525 nm发射波长。
1.4.3 NO供体处理P.g后胞内钙离子(Ca2+)的变化
(1)取适量的Ca2+荧光探针(Fluo-4 AM,S1060,碧云天生物技术公司)母液,用PBS稀释至4 μmol/L当作工作液,吸取大约200 μL左右Fluo-4 AM工作液分别与对照组(NAP、佐剂组)、SNAP-10、SNAP-30、SNAP-50组和菌液进行反应30 min,比例按照细菌∶SNAP=1∶4进行反应。在37 ℃厌氧环境下孵育20 min进行荧光探针的装载,这个过程需要进行避光处理。
(2) 探针装载结束后加入500 μL PBS溶液将细菌覆盖,在37 ℃厌氧环境下孵育20 min,确保AM基团在胞内的完全去脂化作用。
(3) 用流式细胞仪(CytoFLEX,Beckmancoulter公司,美国)进行定量检测,激发波长494 nm,发射波长516 nm。
1.5 统计学方法
2 结果
2.1 NO供体对P.g的抗菌性能
在SNAP与P.g反应比例控制在4∶1的体系下,经过不同SNAP组处理1.5 h后,SNAP-10组、SNAP-30组、SNAP-50组细菌的存活率分别为(99.60±0.28)%、(77.03±3.66)%、(66.95±3.82)%,表明其对P.g有微弱的抗菌活性。5 mol/L佐剂、50 mol/L NAP对P.g无抗菌作用。检验结果显示,SNAP-10组与佐剂组及NAP组比较差异无统计学意义(P>0.05),SNAP-30、SNAP-50与佐剂和NAP组比较差异有统计学意义(P<0.01)。且SNAP-10、SNAP-30、SNAP-50两两比较差异均有统计学意义(P<0.01,图1A)。

图1 NO供体处理P.g实验结果
经过不同浓度的SNAP处理3 h后。SNAP-10组、SNAP-30组、SNAP-50组细菌的存活率分别为(78.30±1.15)%、(47.35±2.20)%、(36.40±3.10)%,表明其对P.g有较强的抗菌作用。5 mol/L佐剂、50 mol/L NAP对P.g无作用。检验结果显示,SNAP-10、SNAP-30、SNAP-50与佐剂和NAP组比较差异有统计学意义(P<0.01)。且SNAP-10、SNAP-30、SNAP-50两两比较差异均有统计学意义(P<0.01,图1B)。
经过SNAP-10、SNAP-30、SNAP-50处理P.g3 h后,细菌的存活率与处理1.5 h相比,差异均有统计学意义(P<0.01,图1C)。
2.2 NO供体处理P.g细菌悬液后总NO定量分析结果
SNAP处理P.g后细菌悬液含有大量的总NO,而且总NO的浓度随着SNAP浓度加大逐渐升高。检验结果显示SNAP-10组[(87.51 ±2.04)μmol/L]、SNAP-30组[(110.37±3.10)μmol/L]、SNAP-50组[(130.58±2.86)μmol/L]与佐剂组[(4.48±0.70)μmol/L]和NAP组[(5.01±0.81)μmol/L]差异均有统计学意义(P<0.01)。且SNAP-10、SNAP-30、SNAP-50两两比较差异均有统计学意义(P<0.01)(图2)。
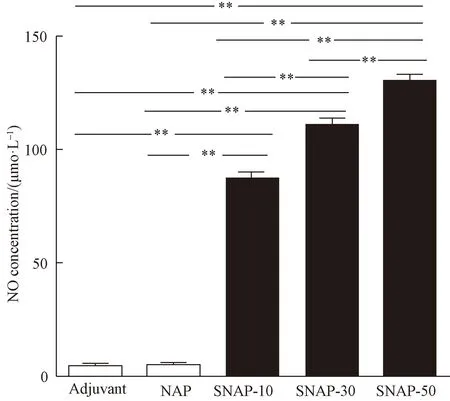
图2 NO供体处理P.g细菌悬液后总NO定量分析结果
2.3 NO处理P.g后胞内ROS浓度的变化
SNAP-50组荧光强度相较于对照组而言明显上升。随着SNAP浓度逐渐加大,细菌内部的ROS含量呈现升高趋势(图3)。

图3 SNAP处理P.g胞内ROS浓度的变化情况
2.4 NO供体处理P.g后胞内Ca2+的变化结果
SNAP处理P.g后,胞内Ca2+浓度随着SNAP浓度的增加,明显升高。SNAP-10与对照组的Ca2+浓度差异无统计学意义,SNAP-30和SNAP-50与对照组相比,差异均有统计学意义(P<0.05,图4)。

图4 NO供体处理P.g后胞内钙离子的变化
3 讨论
种植体周围炎是导致种植体松动失败的主要原因,及时有效抑制或清除P.g菌斑黏附可有效控制种植体周围炎的发展,提高种植体成功率[9]。目前对种植体周围炎的治疗方法主要包括手术治疗、药物治疗和激光治疗等。但这些方法在临床应用中都存在不少问题,比如,手术治疗程序复杂、创伤较大,增加了患者的治疗费用及治疗痛苦;抗生素的频繁使用容易导致P.g等致病菌产生耐药性,增大治疗难度;激光治疗可能导致邻近组织热损伤等[10-11]。
NO作为信使物质或效应分子,生物学效应广泛,在肿瘤、心血管、神经和免疫等诸多系统都发挥了重要作用[12]。近年来,NO供体型药物研究和设计逐渐得到重视。目前,已有十多种NO供体型药物处于不同临床研究阶段,在抗肿瘤、抗血栓、抗肝硬化以及抗菌等领域都展现出广泛的应用前景[13]。此类药物具有不良反应小、便于新陈代谢、不易产生耐药性等优点[14]。2019年,Yang等[15]在小鼠模型上完成了可释放NO聚合物材料的体内抗菌活性研究,发现可释放NO聚合物材料实现了对P.g菌的完全杀灭,进一步提示NO在口腔疾病治疗中的潜在临床应用价值。基于以上考虑,本研究使用SNAP作为NO供体,依次分别通过菌落计数法、总NO检测试剂盒、ROS检测试剂盒、Ca2+荧光探针Fluo-4 AM等技术手段研究不同浓度的NO(10、30、50 mmol/L)对P.g的体外抗菌性能,以及对P.g胞内活性氧水平和Ca2+浓度的影响。
NO对P.g的体外抗菌活性实验结果提示NO浓度越大,对P.g的抗菌活性越高。进一步延长NO处理P.g作用时间至3 h后,结果表明NO的处理时间越长,对P.g的抗菌活性越高(P<0.01)。综上实验结果不难发现,NO对P.g有显著的体外抗菌活性,并且其抗菌性能与NO药物浓度和作用时间呈现明显的正相关性(P<0.05)。笔者的这一研究结果与之前研究的结论一致,如刘晓宇等[16]同样发现SNAP对表皮葡萄球菌、大肠杆菌等致病菌都具有抑制作用,其抑菌作用与SNAP呈浓度依赖性。此外,Estes等[17]研究证实SNAP对金黄色葡萄球菌也具有显著的抗菌活性。由此可见,NO对包括P.g在内的众多致病菌都有较好的广谱抗菌活性。
在NO生成量的实验中,笔者利用Griess reagent定量分析了不同浓度SNAP作用下P.g菌悬液总NO的变化情况。结果显示,SNAP处理P.g后菌悬液内有大量的NO产生,而且NO的生成浓度随着SNAP浓度的增高而增加(P<0.01)。一般情况下,种植体表面没有抗菌能力,种植体周围炎患者的病变区隐藏着大量的革兰阴性厌氧杆菌,容易引起P.g致病菌的大量黏附从而导致种植体周围炎的产生。笔者在本研究中发现SNAP可以定量生成浓度可控的NO,对抑制P.g的黏附和治疗种植体周围炎都具有深远意义。在实验中笔者通过改变SNAP浓度和NO作用时间,均可以显著提高SNAP对P.g的抗菌活性。de Farias 等[18]的研究同样指出,NO在不同的病理生理过程中扮演着重要的角色,包括在体内参与内环境稳定、骨的形成和吸收、抑制细菌和肿瘤的生长等,笔者的实验结果与该研究一致。
为了进一步探究SNAP产生的NO的可能抗菌机制,笔者分别检测了NO对P.g胞内ROS和Ca2+的浓度影响情况。结果显示,SNAP处理后显著提高了P.g胞内ROS水平和Ca2+浓度(P<0.05)。目前国际上有研究[19]表明,NO主要通过直接毒性和间接免疫反应来发挥抗菌作用。结合本文获得的实验结果和国内外的相关研究,笔者猜测NO对P.g的抗菌活性可能主要通过以下几种相互联系的非特异路径来实现:①高浓度的NO能显著提高P.g胞内Ca2+浓度,最终触发钙信号,破坏DNA,从而导致致病菌死亡[20]。②高浓度的NO产生多种活性基团进入P.g体内,胞内ROS水平迅速升高,进而引起一系列的氧化应激反应,导致P.g活性下降[21]。③在灭活P.g生物膜的过程中Ca2+与ROS相互促进,起到协同增效作用。大量的ROS和NO最后导致P.g结构改变和细胞内钙升高,使细菌发生凋亡样改变,与细胞死亡关系密切[22]。④NO可能与P.g体内某些关键酶结合,使其失活从而抑制P.g生长[23]。
综上研究表明,NO供体型药物对P.g具有高效的体外抗菌活性。随着NO浓度和作用时间的不断增加,抑菌能力逐渐增强(P<0.05)。并且,NO处理后显著提高了P.g胞内ROS水平和Ca2+浓度(P<0.05)。简言之,NO能够高效抑制P.g的活性和生长能力,并通过引起P.g胞内ROS和Ca2+代谢紊乱,以实现抗抑菌功能。NO供体型药物对种植体周围炎具有潜在的治疗作用和临床应用价值。但具体的作用机制仍需进一步深入研究。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明江玉梅:提出研究思路,设计研究方案,撰写论文;张紫薇、王吉天:实施试验过程,把控方案可行性,获取数据;张紫薇:分析数据;杨宇:总体把关,审定论文。

