基于生物电阻抗方法分析血液透析患者内脏脂肪面积与腹主动脉钙化的相关性研究
王小琪 袁 丹 邵 枫 周晶晶 杨 帆 李忠心
(首都医科大学附属北京潞河医院肾病中心,北京 101149)
血液透析是终末期肾病患者重要的肾替代治疗方法之一,维持性血液透析(maintenance hemodialysis,MHD)患者的营养状态也越来越受到重视。近年来研究[1-2]表明MHD患者合并营养不良、肌少症,往往有更高的血管钙化水平,是患者病死率增加的独立危险因素。然而,对于非营养不良的MHD患者而言,营养过剩易合并肥胖,也提示预后不良。仅仅依靠体质量或者体质量指数(body mass index,BMI)等传统指标,不足以全面反映MHD患者的营养状态,如何更好地评估患者的营养状况以及指导治疗,愈来愈受到人们的关注。内脏脂肪面积(visceral fat area,VFA)作为评估脂质代谢紊乱的新近临床指标,与BMI、腹围、腰臀比等传统反映肥胖的临床指标相比,VFA与患者的肾脏病进展、心血管疾病发病率、病死率关系更为密切[3-4],与糖尿病患者动脉硬化、冠状动脉钙化的发生相关[5]。在非营养不良的MHD患者中,VFA与腹主动脉钙化(abdominal aortic calcification,AAC)的相关性尚不清楚。综上,本文采用横断面研究方式,探讨非营养不良MHD患者VFA水平与AAC相关性,并分析这类患者发生AAC的危险因素及VFA水平对发生AAC的预测价值。
1 对象与方法
1.1 研究对象
选取2019年4月至2020年5月于首都医科大学附属北京潞河医院规律血液透析且保留完整数据的患者,并进行人体成分分析。纳入标准:①年龄≥18岁;②透析龄≥3个月,每周透析3次,每次透析4 h;血流量200 mL/min以上;膜面积1.4 m2以上;③能够自主站立; ④预计生存期>1年。排除标准:①合并营养不良者(患者BMI<18.5 kg/m2,或在无明确时间段内体质量非人为因素下降>10%,或者3个月内体质量下降>5%[6]);②合并恶性肿瘤、严重感染性疾病、自身免疫病、原发性甲状腺疾病患者;③合并严重心、肝、肺等脏器功能障碍者;④合并淀粉样变性、获得性免疫缺陷综合征、多发性骨髓瘤、肉瘤样结节病变等可能影响血管及软组织钙化的疾病者。本研究均取得患者知情同意,并经过首都医科大学附属北京潞河医院伦理委员会批准(批件号:2020-LHKY-002-01)。
1.2 研究方法
1.2.1 患者一般资料及实验室检查
收集所有患者的性别、年龄、透析龄、原发病、是否有合并症(包括高血压、糖尿病)。采用标准皮尺及体质量计测量患者的身高及体质量,计算BMI(BMI=体质量/身高2)。在透析前采集患者空腹静脉血标本,送至本院检验科,检测指标包括血白细胞计数、超敏C反应蛋白、血红蛋白、血白蛋白、血尿酸、血肌酐、血尿素氮、血磷、血钙、全段甲状旁腺素 (intact parathyroid hormone,iPTH)、血三酰甘油、总胆固醇、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)等。
1.2.2 人体成分分析
采用人体成分测量仪,应用生物电阻抗分析法(bioelectrical impedance analysis,BIA)进行人体成分分析,在患者透析下机后立即进行,测量前嘱被测者排空膀胱,取下佩戴的金属物体。患者赤脚正位、双脚分开站立在仪器表盘,自然分开双腿,使肢体与躯干皮肤避免相互接触。双臂微微下垂,以适当的力量握住身前手柄,脚底对应电极片,由协助者在旁边登记患者年龄、性别、身高等基本资料。注意测量前保证避免线路接触被测者、地面及金属物体,清洁皮肤后连接电极。测量后通过仪器表盘记录患者VFA,必要时重复测量。
1.2.3 腹主动脉钙化评估标准
腹主动脉的钙化可反映患者血管钙化的情况。本研究选择腹部侧位X射线平片作为评估AAC的检测手段。根据Kauppila评分标准[7]计算腹主动脉钙化评分(Abdominal Aortic Calcification Score,AACs),选择两个椎间隙的中点,以第1~4节腰椎对应的腹主动脉前壁、后壁钙化斑块长度情况进行评估,得出相应评分:无钙化为0分;钙化0~1/3为1分;钙化1/3~2/3为2分;钙化2/3~1为3分。各个节段得分相加可得到0~24分,根据患者AACs分组,0分为无钙化组,1~4分为轻度钙化组,5~15分为中度钙化组,AACs≥16分为重度钙化组。钙化评分经两位放射科医师评估,所取得的钙化评分取平均值。
1.3 统计学方法
2 结果
2.1 4组患者的基本临床特征比较
本研究共纳入152例MHD患者,平均年龄(57.47±12.79)岁,其中96例(63.2%)为男性,56例(36.8%)为女性。依据AACs评分将患者分为4组,无钙化组(n=32)、轻度钙化组(n=45)、中度钙化组(n=54)以及重度钙化组(n=21)。4组患者的年龄、性别、透析龄、病因、是否合并高血压、BMI、血钙、血红蛋白、血白蛋白、血肌酐、尿素氮、血尿酸、总胆固醇、三酰甘油、LDL-C、空腹血糖、超敏C反应蛋白、血白细胞计数等差异均无统计学意义。4组患者的血磷、iPTH、HDL-C、VFA以及是否合并糖尿病指标比较,差异有统计学意义(P<0.05)。进一步两两比较显示:中度钙化组患者的血磷、VFA、合并糖尿病的比例明显高于无钙化组(P<0.01);重度钙化组的血磷、iPTH高于无钙化组(P<0.01);重度钙化组患者HDL-C低于无钙化组以及轻度钙化组(P<0.01),详见表1。
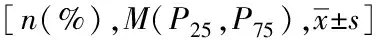
表1 4组患者临床基线资料比较
2.2 腹主动脉钙化与其影响因素的相关性
Spearman相关分析结果显示,MHD患者AACs评分与是否合并糖尿病、血磷、iPTH、VFA水平等均呈显著正相关(r=0.188、0.208、0.223、0.392,P<0.05);与HDL-C水平呈显著负相关(r=-0.228,P<0.05),详见表2。
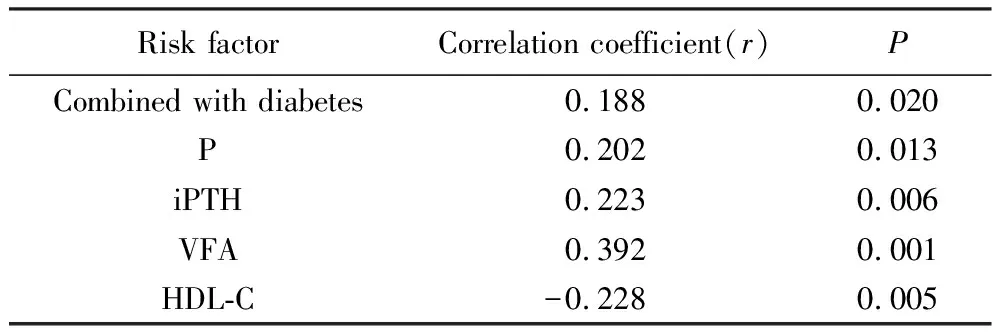
表2 AACs评分的影响因素的单因素相关分析
2.3 非营养不良MHD患者腹主动脉钙化的影响因素分析
将年龄、性别、是否合并糖尿病、血磷、iPTH、VFA、HDL-C水平作为自变量,将MHD患者是否有钙化(轻、中及重度=1,无=0)作为因变量,纳入多因素Logistic回归模型,结果显示,VFA以及血磷为MHD患者发生腹主动脉钙化的独立危险因素(P<0.05),详见表3。

表3 非营养不良MHD患者腹主动脉钙化的多因素Logistic回归分析
2.4 VFA水平对MHD患者腹主动脉钙化的预测效能
ROC曲线显示,非营养不良的MHD患者体内VFA预测腹主动脉钙化的曲线下面积(area under the curve,AUC)为0.725(P<0.05),具有较高的预测价值。以ROC曲线靠左上方约登指数的最大切点96.45 cm2作为最佳临界值,该点预测灵敏度为74.17%,特异度为75.0%,详见表4、图1。
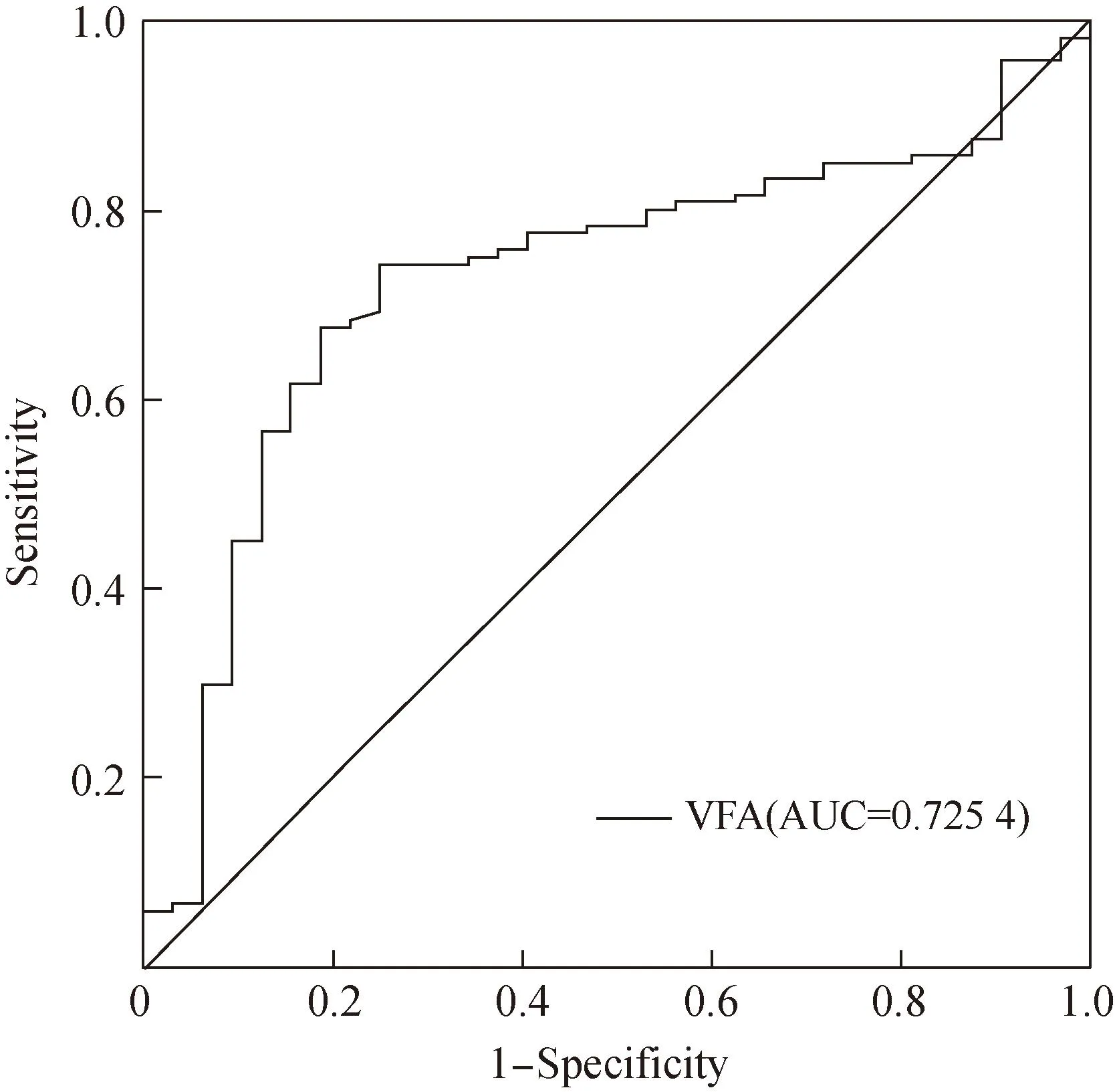
图1 非营养不良MHD患者VFA水平预测腹主动脉钙化ROC曲线图

表4 VFA水平对非营养不良MHD患者腹主动脉钙化的预测效能
3 讨论
MHD患者血管钙化发生率高,其钙化范围和程度与心血管疾病发病率相关,是MHD患者心血管病死亡及全因病死率增加的独立危险因素[8],基于Kauppila评分标准[7]的AACs可以良好反映MHD患者血管钙化情况[9],与患者的不良预后相关[10]。众所周知,除了矿物质代谢紊乱造成的血钙、磷被动沉积外,MHD患者的血管钙化更是一个细胞介导的主动调节过程,血管平滑肌细胞(vascular smooth muscle cells,VSMCs)、内皮细胞、间充质细胞和造血干细胞相互作用且对各种钙化因素刺激发生反应,激活骨发生信号导致血管钙化的发生。脂肪组织不仅以脂肪的形式储存能量,而且被认为是重要的内分泌器官[11],与血管钙化的发展密切相关。内脏脂肪组织分泌的多肽和代谢物涉及多种生理过程的正常调节,被称为脂肪因子,可通过调节血管炎症、细胞成骨分化、细胞凋亡以及钙、磷在血管壁上的异常沉积,对血管钙化的病理过程具有重要影响[12-13]。虽然适量的脂肪组织对身体健康是必要的,然而,当内脏脂肪组织的快速增殖和过度肥大超过血管新生时便会诱发一系列病理生理过程。首先,由于血液供应相对不足,将导致脂肪细胞和VSMCs缺氧。缺氧条件下的VSMCs分化为成骨细胞,并发生凋亡。另一方面,内脏脂肪细胞在缺氧条件下会释放促炎的脂肪因子,比如白细胞介素-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),刺激VSMCs的氧化应激、成骨细胞分化、凋亡和增殖,且VSMCs的增殖可能进一步加重缺氧,最终诱导血管钙化[14]。其次,内脏脂肪细胞分泌的趋化因子也会刺激巨噬细胞等免疫细胞浸润,浸润的巨噬细胞和凋亡的VSMCs都具有分泌基质囊泡的能力,也会诱导VSMCs的成骨分化,并将未矿化的基质转化为矿化的基质[15]。最后,内皮细胞在某些脂肪因子(如TNF-α)刺激下也表现出向成骨细胞转化的趋势,进一步加剧血管炎症和钙化的程度[16]。
为了探寻非营养不良的MHD患者内脏脂肪组织与腹主动脉钙化的相关性,笔者用BIA法对患者体内的VFA进行分析。虽然目前研究[17]显示电子计算机断层扫描(computed tomography,CT)和磁共振成像是测量VFA最准确的方法,但受限于成本以及高辐射的风险,难以在一般人群中普及。BIA具有准确度及重复性高,操作简便、无放射性、价格不高等优点,最近的研究[18]表明,BIA在测量VFA方面与腹部CT相比具有良好的效度。
本研究发现与AACs无或低的MHD患者相比,AACs较高的患者体内有更高的VFA,却没有更高的BMI水平,提示与BMI相比,VFA与患者发生血管钙化的关系更为密切,在其他研究[19-20]中也有类似发现。既往研究[21]也表明,在合并糖尿病的MHD患者中,VFA升高与更高的臂踝脉搏波速度以及颈动脉内膜中层厚度相关,提示内脏脂肪堆积可能与动脉硬化和动脉粥样硬化有关。
本研究表明,对于非营养不良的MHD患者而言,按照腹主动脉钙化程度分组比较,各组患者的VFA、血磷、HDL-C、iPTH以及是否合并糖尿病均存在差异。而相关性分析显示,VFA水平与AACs评分呈显著正相关,提示MHD患者VFA水平与AAC的严重程度相关。应用多因素Logistic 回归分析显示,在非营养不良的MHD患者中,只有VFA、血磷是患者发生AAC的独立危险因素。这与Maruyama等[22]以及Biyik等[23]的研究结果类似。进一步ROC曲线显示,VFA预测非营养不良的MHD患者发生AAC的AUC为0.725,具有较高的预测价值,截断值为96.45 cm2,该点预测灵敏度、特异度分别为74.17%、75.0%,提示VFA可能对非营养不良的MHD患者发生AAC有一定预测价值。本研究为单中心横断面研究,仅研究VFA与AAC之间的关系,尚不能明确在治疗中增加对MHD患者VFA的干预措施是否有助于预防、缓解患者的腹主动脉钙化。
综上所述,对于非营养不良的MHD 患者来说,VFA升高与腹主动脉钙化的严重程度相关,是腹主动脉钙化的独立危险因素,可能成为预测患者发生腹主动脉钙化的生物学指标。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明王小琪:提出研究思路,设计研究方案,论文撰写;袁丹、邵枫:病例资料收集、测量指标;周晶晶、杨帆:数据整理、统计分析;李忠心:总体把关、审定论文。

