新发每日持续性头痛18F-FDG PET脑代谢特点
关皓琳 袁紫瑜 袁磊磊 陈 谦 王永刚 艾 林*
(1.首都医科大学附属北京天坛医院核医学科,北京 100070;2.首都医科大学附属北京天坛医院头痛科,北京 100070;3.首都医科大学附属北京天坛医院神经病学中心,北京 100070)
新发每日持续性头痛(new daily persistent headache,NDPH)是一种罕见的原发性头痛,主要表现为突发性的、24 h内持续不缓解的头痛,属于每日慢性头痛(chronic daily headache,CDH)中的一种。《国际头痛疾病分类》(第3版)(the third edition oftheInternationalClassificationofHeadacheDisorders,ICHD-3)[1]对NDPH描述为具有每日持续的特征,可以表现为紧张型头痛(tension-type headache,TTH)或偏头痛,伴有或不伴有其他相关症状,如畏光或恶心。NDPH在人群中的发病率极低,患者疾病负荷高、预后差,甚至可能高度致残。但由于目前NDPH的病理机制还不明确,未能得到强有效的诊治手段[2]。随着氟-18-脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG )正电子发射型计算机断层扫描显像(positron emission tomography,PET)及功能磁共振成像(functional magnetic resonance imaging,fMRI)等功能性成像手段的发展,头痛的中枢神经系统机制得到了关注,研究[3]表明大脑是头痛发作的主要来源。目前关于NDPH的神经影像学研究主要集中在MRI,关于PET的研究仍少之又少。在此背景下,本项研究回顾性地分析了20例成年NDPH患者的PET图像数据,旨在探究NDPH患者疾病相关脑区,并为探究NDPH的临床表现及其并发症的病理机制提供脑功能代谢方面的帮助。
1 对象与方法
1.1 研究对象
以2021年5月至2023年7月在首都医科大学附属北京天坛医院核医学科接受PET检查,依据ICHD-3诊断标准临床诊断为NDPH的20例患者为研究对象。其中男性12例,女性8例;年龄19~80岁,平均年龄(31.3±17.6)岁,病程0.5~33年,平均病程(8.0±9.3)年;头痛程度采用视觉模拟评分法(Visual Analogue Scale,VAS)评分表示,患者头痛程度2~10分,平均(5.5±2.0)分。所有参与者均为初次诊断为NDPH的患者,无其他神经系统疾病或神经系统发育异常。纳入标准:于本院确诊NDPH并于本科室行18F-FDG PET检查,图像质量达到进一步分析研究标准;年龄大于18岁,以往无其他头痛病史;无其他神经系统相关基础疾病或先天性发育异常。本研究利用的研究信息不含有使受试者的身份被直接识别或通过与其相关的识别物识别的信息,免除伦理审查。
1.2 PET显像
本研究入组患者均在首都医科大学附属北京天坛医院核医学科进行18F-FDG PET脑显像,所有患者均按照相同方法进行18F-FDG PET图像采集。患者行18F-FDG PET图像采集前1~2 d避免做剧烈运动,检查前4~6 h禁食,停服一切不必要的药物,环境气温较低时应注意保暖。注射18F-FDG前空腹血糖应控制在11.1mmol/L以下。通过肘静脉注射18F-FDG溶液,放化纯度>95%,注射活度为3.7 MBq/kg。注射后患者在安静、黑暗环境中等待40~60 min,之后进行图像采集,采集范围为1个床位,采集时间为8~10 min。患者采取仰卧位,在整个检查过程中保持静止。患者PET图像采集使用PET/MR一体化扫描仪(Discovery750w,GE Healthcare公司,美国),MRI采集序列包括① 3D BRAVO T1WI:TE = 3.0 ms,TR = 7.9 ms,层厚为1mm;② T2WI:TE = 140 ms,TR = 6 000 ms,层厚为5mm;③T2 FLAIR:TI = 2 500 ms,TE = 115 ms,TR = 6 500 ms,层厚为1mm,采集矩阵为256×256,FOV = 24 cm;④弥散加权成像:TE = 70 ms,TR = 5 800 ms,b = 1 000,层厚为5mm,矩阵128×128。⑤3D动脉自旋标记:TE = 10.71 ms,TR = 4 876 ms,PLD=2.0,采集矩阵为256×256,FOV = 24cm。采用零回波时间(zero echo time,ZTE)方法对PET图像进行衰减校正。PET/MR多模态数据采集后图像传送至GE AW Volume Share 4工作站进行图像重建和数据测量。
1.3 PET图像分析
目视评估后,将18F-FDG PET图像导入到工作站上的Cortex ID工具箱(GE Healthcare公司,美国)中进行皮质代谢分析,得到的数据与软件中提供的年龄匹配的正常对照组进行比较。通过三维立体定向表面投影(stereotactic surface projection,SSP)显示18F-FDG在皮质区的摄取。利用Cortex ID软件生成的体素Z评分,对感兴趣的前额叶皮质(外侧和内侧)、感觉运动皮质、扣带回皮质(前后)、楔前叶皮质、顶叶皮质(上下)、枕外侧皮质、初级视觉皮质和颞叶皮质(外侧和内侧)进行双侧计算。Z评分计算公式如下:
Z评分=[对象平均值-数据库平均值]/数据库SD
基于体素的颜色编码被用来描述平均每个特定的大脑区域Z评分的代谢变化范围。在此定量分析中,Z评分阈值高于2(基于双尾检验-1.96),对应的P值为0.05(双尾),被认为是显著异常的临界值。Z值为正表示与脑桥相比代谢率较高。所有数值均通过目视检查进行验证。
1.4 统计学方法
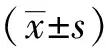
2 结果
2.1 NDPH患者的基本特征
在20例患者中,共有18例(90.0%)患者为双侧头痛,其余2例(10.0%)患者为单侧头痛;所有患者的头痛范围均累及多个脑叶,其中头痛累及额叶者有10例(50.0%),累及颞叶者占11例(55.0%),累及顶叶者有13例(65.0%),累及枕叶者有15例(75.0%);共有6例(30.0%)患者出现全头痛,详见表1。
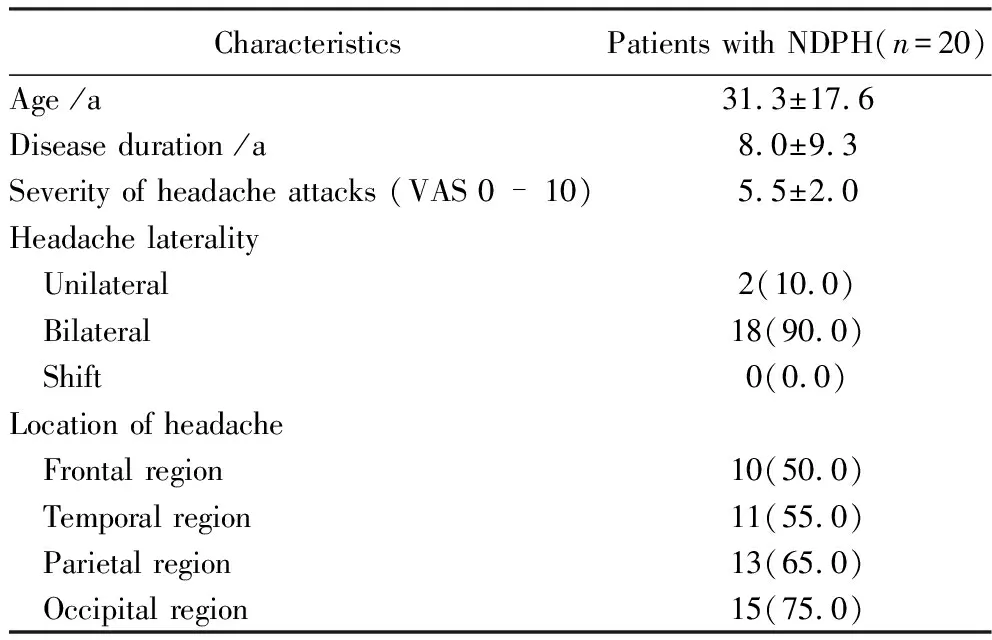
表1 NDPH患者人口统计学数据和头痛情况
2.2 NDPH患者不同脑区代谢特征分析
NDPH患者在颞叶中线、顶叶下部和脑桥等区域呈现显著低代谢,上述脑区Z评分降低。SSP和脑区Z评分详见图1。
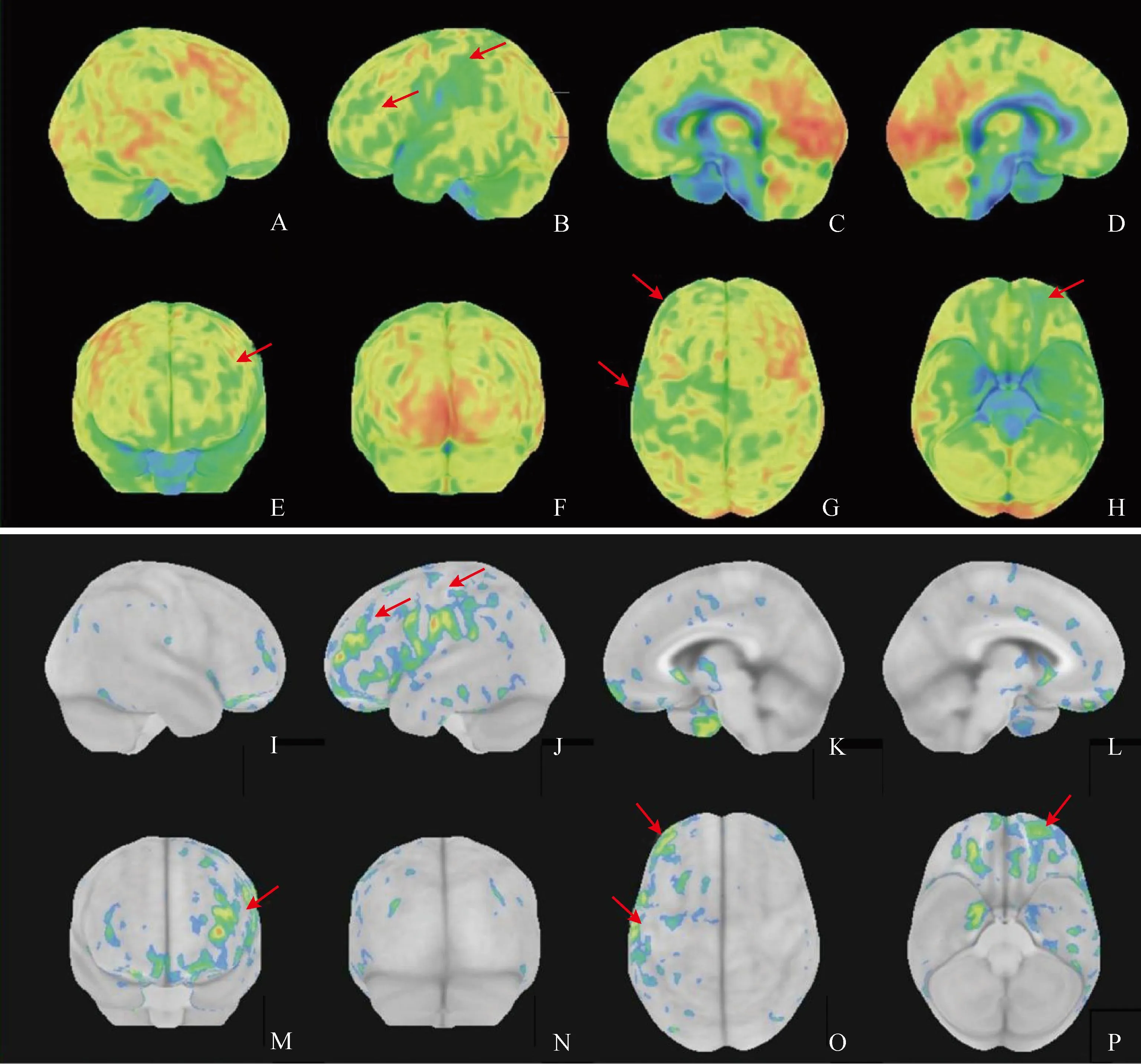
图1 NDPH患者脑代谢可视化图
与软件中提供的年龄匹配的正常对照数据库(Z=0)相比,NDPH患者的Z评分在右侧颞叶外侧、右侧运动整合区、右侧主要视觉区、左侧主要视觉区、右侧前额外侧区、左侧楔前叶、右侧颞叶中线区、左侧颞叶中线区及全小脑的差异无统计学意义 (P>0.05)。在左、右前额内侧(P=0.004、P=0.009)、右侧扣带回后侧(P=0.003)、右侧楔前叶(P=0.003)、左侧运动整合区(P=0.036)、右侧扣带回前区(P=0.040)、左侧扣带回前区(P=0.037)、左侧扣带回后区(P=0.037)、右侧顶上小叶(P=0.002)、左侧顶上小叶(P=0.019)、左侧额叶前外侧(P<0.001)、左、右侧顶下小叶(P<0.001)、左、右颞叶中线区(P<0.001 )和右侧颞叶外侧(P<0.001)、脑桥(P<0.001)差异具有统计学意义,其中左、右前额内侧(P=0.004、P=0.009)、右侧扣带回后侧(P=0.003)、右侧楔前叶(P=0.003)、右侧顶上小叶(P=0.002)、左侧额叶前外侧(P=0.000)、左、右侧顶下小叶(P=0.000)、左、右颞叶中线区(P=0.000)和右侧颞叶外侧(P=0.000)、脑桥(P=0.000)等差异更为显著,详见表2。
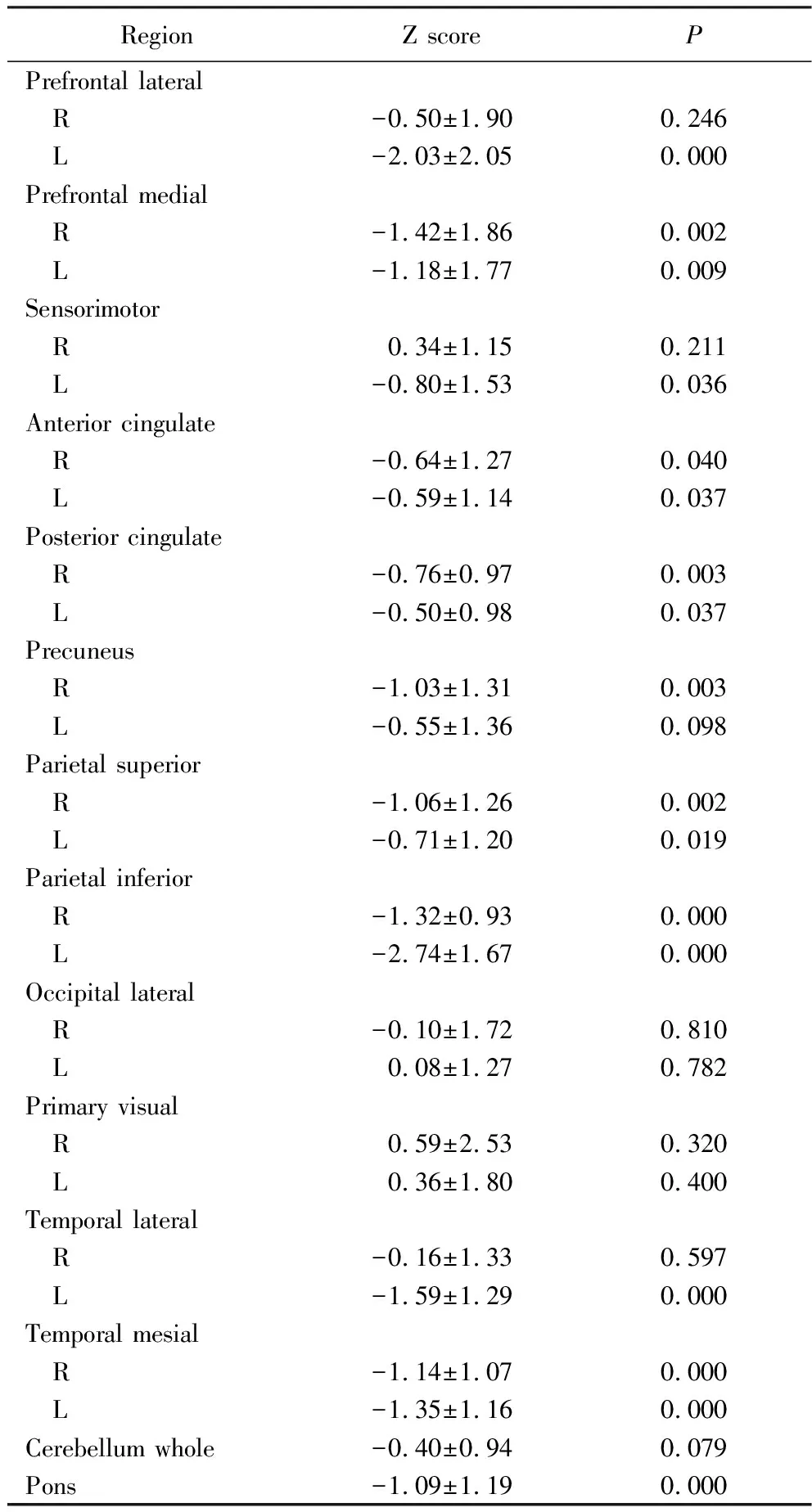
表2 NDPH患者各脑区Z 评分分布
2.3 NDPH的脑区间相关性
NDPH的26个脑区间相关性以热图测定。在NDPH的26个脑区中,右侧主要视觉区与左侧主要视觉区、左侧扣带回前区与右侧扣带回前区、右侧前额内侧区与左侧前额内侧区呈极强正相关;双侧枕叶与双侧主要视觉区、左侧颞叶外侧区及左侧顶下小叶与左侧前额外侧区、左侧前额内侧区与左侧前额外侧区呈强正相关;左侧前额内侧区与右侧枕叶呈极强负相关;左侧前额外侧区与双侧主要视觉区、双侧枕叶及全小脑呈强负相关;双侧前额内侧区与双侧枕叶呈强负相关(图2)。
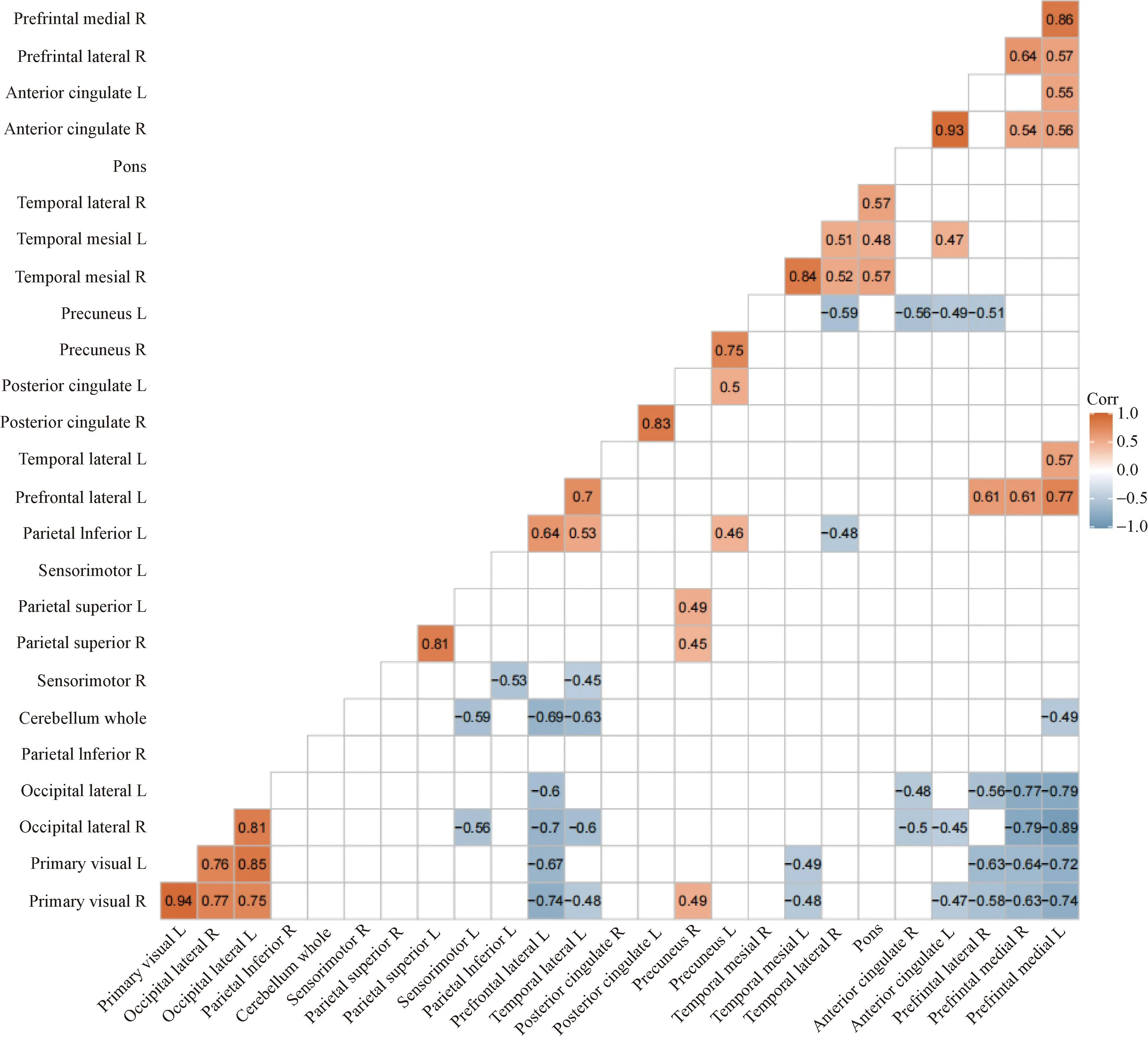
图2 NDPH患者26个脑区间相关性热图
3 讨论
NDPH是一种十分罕见的原发性头痛,诊断主要依据其典型的临床病史和表现[1]。目前,NDPH发病机制仍未有定论[2],随着功能性显像的发展,研究[3]表明大脑是头痛发作的主要来源。然而,现如今关于NDPH疾病相关脑区的研究主要采用fMRI手段,脑区代谢状况仍不明确。目前,PET显像已广泛应用于阵发性及慢性偏头痛、药物过度使用性头痛等的研究中[4],但关于NDPH的PET研究仍少之又少。
关于NDPH患者是否存在脑结构改变,目前的研究存在争议。脑区局部皮质厚度减少可以导致局部代谢降低。近期一项针对青少年NDPH患者的研究[5]显示,双侧颞上回、左侧额上回和额中回区域的皮质厚度减少,这与本次研究发现的部分代谢降低区部分重合。局部脑代谢降低可以反映神经功能及局部血供情况。有研究[6]表明,血管收缩可能被认为是 NDPH 样头痛的触发因素,既往研究[7]显示,NDPH患者的右侧眶后回、右侧枕中回、右颞上回颞极和右侧丘脑腹侧前核局部脑血流量降低,这与本次研究发现的部分代谢降低区部分重合。由此推测,血管收缩导致局部脑灌注降低而产生头痛,在 PET上表现出局部脑代谢降低;而持续头痛反过来也可以导致局部脑灌注减少,表现为PET图像上局部脑代谢降低。
NDPH的典型临床表现为从发病开始每日持续不缓解的头痛[1]。本次研究显示,双侧后扣带皮质与右侧楔前叶代谢降低,左侧楔前叶与双侧后扣带皮质之间存强正相关,与既往发现的疼痛相关的内侧前额叶皮质-后扣带皮质/楔前叶功能性连接相吻合[8],其可能与NDPH头痛机制相关。已有研究[9]表明,前扣带皮质在慢性疼痛状态中起着重要作用,其与维持疼痛相关的情绪、焦虑相关,神经性疼痛形成的机制也与前扣带皮质中长时程增强作用的表达有关。本次研究中NDPH前扣带皮质代谢降低是否与长时程增强作用相关仍需进一步研究。
NDPH可以合并睡眠障碍、头晕、视力模糊、颈部僵硬、注意力不集中、麻木或刺痛等感觉障碍、眩晕、嗜睡和其他非特异性综合征[10]。本次研究显示,NDPH楔前叶、前扣带皮质与运动整合区代谢降低,与既往研究[11]发现的睡眠质量相关的脑区相符,由此可推测楔前叶、前扣带皮质与运动整合区代谢降低可能与头痛并发的睡眠障碍有关。有研究[12]提出,慢性疼痛可能会调节注意力特异性网络,该网络包括背外侧前额叶皮质、前扣带皮质、后扣带皮质、后顶叶皮质和内侧额叶皮质,与本次研究脑区间相关性结果高度重合,因此NDPH背外侧前额叶皮质、前扣带皮质、后扣带皮质、后顶叶皮质和内侧额叶皮质代谢降低可能与NDPH患者注意力不集中相关。此外,NDPH患者的抑郁症状、焦虑、躯体形式障碍等精神病合并症也非常常见(32.7%~85.5%)[13]。内侧前额叶皮质、外侧眶额皮质、背外侧前额叶皮质、前扣带和后扣带皮质、楔前叶皮质和颞叶皮质已被证实与抑郁情绪相关[11],右侧额叶皮质、右侧前扣带皮质、双侧壳核和左侧颞叶中、上回已经证实与焦虑相关[14],因此,可以推测此次研究中上述脑区的代谢降低或与NDPH合并焦虑、抑郁相关。
曾有研究[15]显示,NDPH可能是中枢神经系统炎症的表现,最近有病例也支持了NDPH可能是由急性感染引起的中枢神经系统炎症的表现的假说[16]。然而,FDG PET对于炎症显像的特异性不足,本研究结果不足以支持该假说,需进行炎症探针显像进一步验证。
本研究仍存在一些局限性。由于NDPH 病例在临床实践中较为罕见,因此本研究样本量相对较小,可能会导致研究结果的偏倚。本研究是一项初步的研究,旨在探讨NDPH患者各个脑区的脑代谢改变。在进一步研究中,笔者团队将增加样本量、细化NDPH分型,以便在未来的研究中验证结果的准确性。除此之外,进一步的研究将会关注 NDPH患者与其他类型慢性头痛的脑代谢差异以及与临床症状的相关性,并应用多类型探针进一步验证其病理机制。
本研究显示,18F-FDG PET可以显示出NDPH患者不同脑区的代谢变化。笔者通过皮质代谢分析发现NDPH患者在颞叶中线、顶叶下部和脑桥等区域呈现显著低代谢,这可能为NDPH及其并发症的发生提供相关的代谢信息。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明关皓琳:提出研究思路,设计研究方案,实施研究过程,撰写论文;袁紫瑜:数据的获取、提供与分析;袁磊磊、陈谦:论文总体把关、审定;王永刚、艾林:提出研究思路,论文总体把关、审定。

