丙型肝炎病毒抗体化学发光免疫分析法 ≥ 95%阳性预测值最佳吸光度/临界值建立方法学和重要性探讨
韩金育 郭晶晶 孟 欢 陈 瑾 王雅杰,*
(1.北京大学地坛医院教学医院检验科,北京 100015;2.首都医科大学附属北京地坛医院检验科,北京 100015)
丙型肝炎病毒(hepatitis C virus,HCV)感染是引起慢性肝病的主要诱因[1],部分患者可发展为肝硬化、肝细胞癌,全球约有1.6%的人口感染HCV,每年大约有40万人死于HCV感染相关疾病,对公众生命健康造成严重威胁[2]。因此,对HCV感染进行早期筛查、准确诊断尤为重要。由于HCV抗体检测操作简便、具有较高灵敏度等优势,可作为实验室HCV筛查的首选方法,然而在方法学上不可避免地容易出现假阳性,尤其是弱阳性患者,给临床诊断造成了困扰,降低了检验报告的准确性。美国疾病预防控制中心[3]建议对于HCV抗体阳性的患者进行更多确证试验来证实。重组免疫印记试验(recombinant immunoblot assay,RIBA)因其特异度较高曾被广泛作为HCV 抗体的补充确证试验,但自2010年,RIBA试剂盒在美国停止生产后,不再推荐RIBA作为抗体补充确证试验。HCV抗体阳性的患者进行HCV RNA检测,但HCV RNA阴性并不能排除HCV感染。
丙型肝炎病毒抗体吸光度/临界值(signal-to-cutoff,S/CO)值越高,抗体真阳性率越高[3-4],近些年的研究表明抗体S/CO值在预测病毒血症、诊断HCV感染中具有重要价值[5],可根据最佳S/CO值来限制非必要进行补充确证试验的人数[6]。目前,由于不同医院及实验室所应用的仪器试剂以及方法学不同,尚无法统一HCV抗体的诊断临界值。基于以上所述,本研究对抗体初筛为有反应性的样本进行确证实验,并通过受试者工作特征(receiver operating characteristic,ROC)曲线,得到本实验室抗体阳性预测值 ≥ 95%的最佳S/CO值完善检验报告,协助临床诊断。同时为探索不同系统丙型肝炎病毒抗体检测试剂95%阳性置信区间建立方法学。
1 对象与方法
1.1 研究对象
本研究选取2021年7月至2022年2月在首都医科大学附属北京地坛医院应用雅培抗HCV抗体检测试剂盒(chemiluminescence analysis,CLIA)进行初筛检测同时进行HCV RNA检测的患者血浆样本共282例,其中男性138例、女性144例,患者年龄21~84岁,平均年龄(52.46±13.20)岁,丙型肝炎的临床诊断符合中华医学会肝病学分会、中华医学会感染病学分会制订的《丙型肝炎防治指南》2019年版[7]。纳入标准:① 进行HCV抗体初筛;② 具有HCV RNA检测结果。排除标准:① 哺乳、妊娠期妇女;② 合并人类免疫缺陷病毒(human immunodeficiency virus,HIV)及其他肝炎病毒感染;③ 合并其他恶性肿瘤等疾病。该研究经首都医科大学附属北京地坛医院伦理委员会批准(文件编号:DTEC-KY2022-027-01),并获得免知情同意。
1.2 方法
1.2.1 HCV抗体检测
采用购自美国雅培公司的ARCHITECT i2000SR全自动免疫分析仪(CLIA法)对丙型肝炎病毒抗体进行初筛。
CLIA法阳性判定:按照雅培说明书进行判断,S/CO ≥ 1为有反应性。
1.2.2 HCV RNA检测
采用购自瑞士罗氏生物公司的cobas AmpliPrep仪器进行核酸提取,并采用购自瑞士罗氏生物公司的cobas TaqMan分析仪进行自动扩增并检测。
HCV RNA检测:线性范围为15.0~1.0×108IU·mL-1,分析灵敏度为9.2 IU·mL-1。
1.2.3 RIBA 检测
采用北京万泰生物药业股份有限公司生产的丙型肝炎病毒抗体确证试剂盒对丙型肝炎病毒抗体初筛为阳性的血浆样本中的抗体进行确认。
RIBA法阳性判定:根据各条带显色强度判断结果阴、阳性。至少出现两种HCV抗体特异条带(Core,NS3,NS4和NS5)强度1+及以上,结果判读为阳性;未出现HCV抗体特异条带强度1+及以上,结果判读为阴性;仅出现一种HCV抗体特异条带(Core,NS3,NS4和NS5) 强度1+及以上,结果判读为不确定,详见图1。

图1 RIBA结果
1.2.4 实验结果解释
对本研究纳入的282例研究对象查阅其HCV RNA检测结果,并收集其血浆样本进行RIBA试验,若HCV RNA、RIBA检测结果均为阴性,考虑HCV抗体结果为假阳性;若HCV RNA、RIBA检测结果均为阳性,临床诊断为真阳性(HCV现症感染)[8];若HCV RNA结果为阴性,RIBA结果为阳性,包含两种情况:①临床诊断为真阳性(HCV既往感染);②对于无明确HCV感染史、无法证明其HCV感染的患者,则认为偶然因素导致RIBA结果为阳性,暂不纳入研究;若HCV RNA结果为阴性,RIBA结果为不确定,则通过查阅患者病史、肝功能或既往抗体、HCV RNA检测结果进行综合判断。
1.3 统计学方法
应用SPSS 23.0软件进行数据分析。计数资料用百分率进行描述,组间率比较采用χ2检验。HCV抗体S/CO值与抗体真阳性率之间相关性进行Spearman相关系数计算,并应用Graphpad 8.0软件进行ROC曲线分析,得到最佳ROC曲线下面积(area under the curve,AUC)、灵敏度、特异度、约登指数及最佳S/CO值。以P< 0.05为差异有统计学意义。
2 结果
2.1 HCV抗体初筛检测患者临床实验室特征
在282例进行HCV抗体初筛的患者中,男性138例、女性144例,患者年龄21~84岁,221例患者(78.37%)HCV RNA结果为阴性,61例患者(21.63%)为HCV RNA阳性;78例患者(27.66%)RIBA结果为阴性,162例患者(57.45%)RIBA结果为阳性,42例患者(14.89%)RIBA结果为不确定,详见表1。
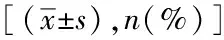
表1 HCV抗体初筛检测患者临床实验室特征
2.2 HCV抗体初筛检测患者HCV感染状态判断
HCV抗体初筛结果为阴性的患者经HCV RNA及RIBA检测后均为真阴性;在252例HCV抗体初筛阳性的患者中,HCV RNA、RIBA均阴性的患者48例,临床考虑为HCV抗体假阳性;HCV RNA阳性、RIBA阳性的患者61例,临床诊断为真阳性,为HCV现症感染;HCV RNA阴性、RIBA阳性的患者共101例,通过查阅患者病史、肝功能结果、既往HCV抗体、HCV RNA检测结果最终确定病毒已清除的HCV既往感染患者共95例,亦为HCV抗体真阳性;剩余6例患者无明确的HCV感染史,无法确定是否HCV感染,因此暂不纳入研究;HCV RNA阴性、RIBA不确定的患者共42例,经过查阅病史及既往检测结果,最终确定HCV既往感染患者32例,10例患者无法证明是否HCV感染,故暂不纳入研究,详见图2。
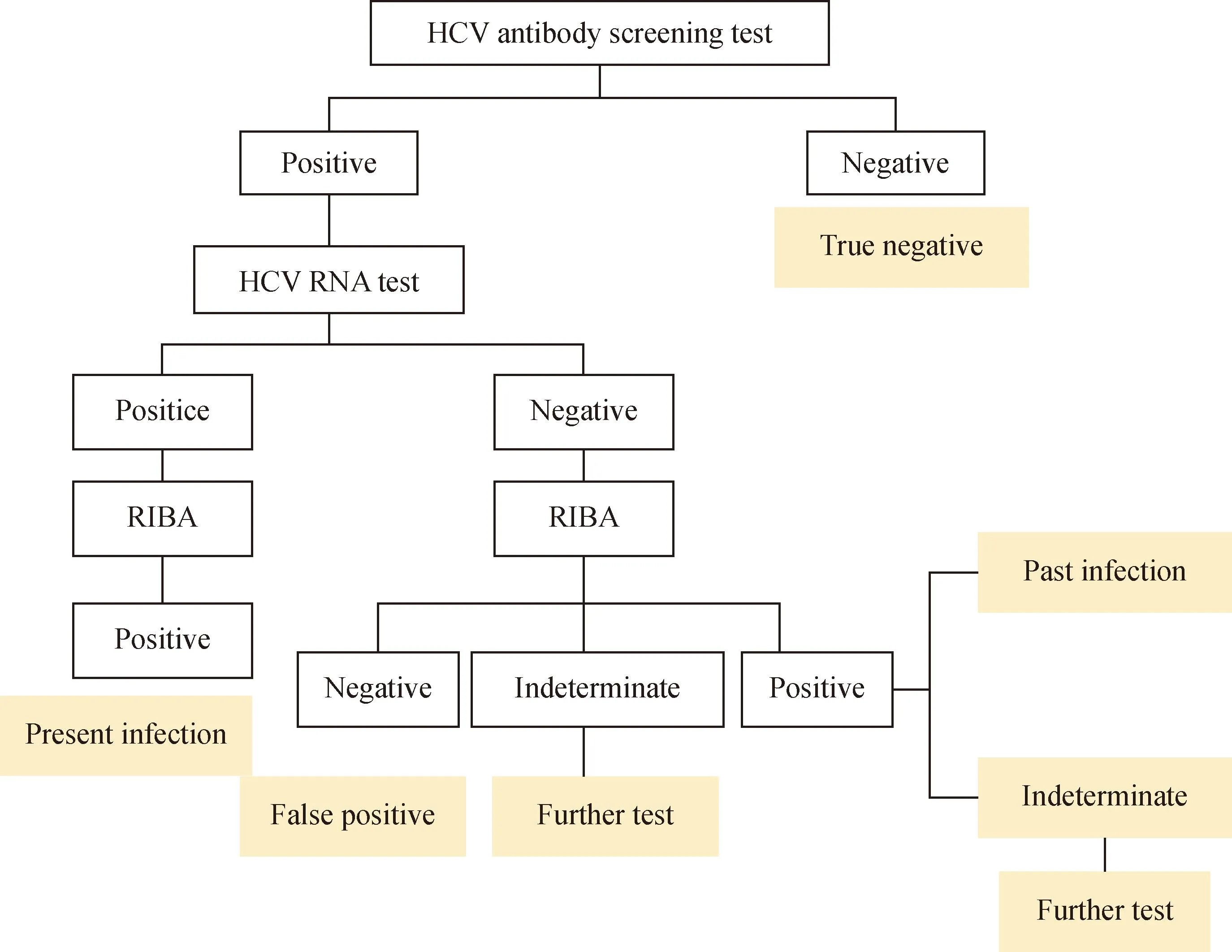
图2 HCV抗体初筛检测患者感染状态判断
2.3 HCV抗体不同S/CO区间HCV RNA、RIBA结果分析
本研究将HCV抗体初筛为有反应性(S/CO ≥ 1)的样本分成不同区间,分别统计不同S/CO区间的真阳性率,分析抗体S/CO与真阳性率之间的相关性。结果表明S/CO值越高,真阳性率越高。详见图3。进一步进行Spearman相关系数计算,r=0.608,P<0.000 1,呈正相关,结果提示HCV抗体S/CO值越高,真阳性率越高。详见表2。
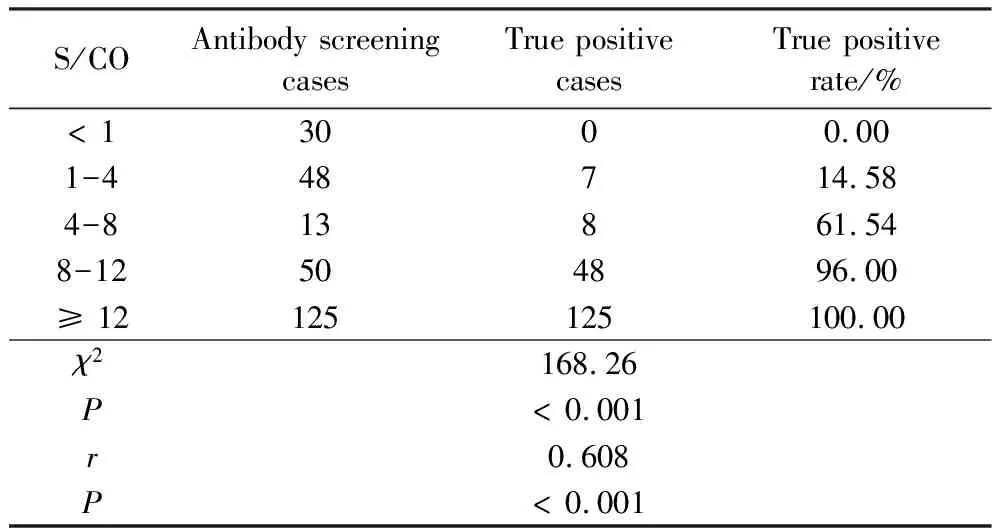
表2 HCV抗体不同S/CO区间HCV RNA、RIBA结果分析
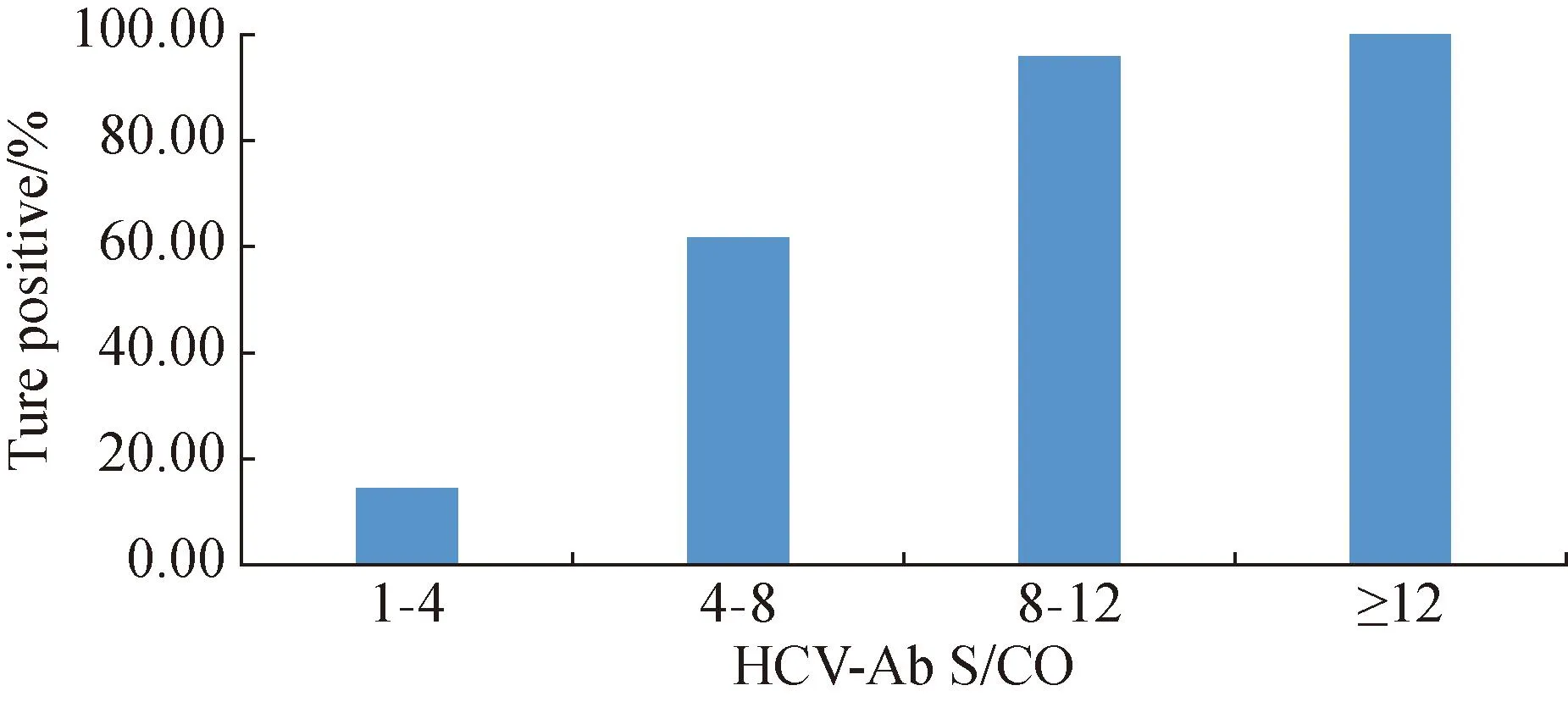
图3 HCV-Ab S/CO与真阳性率的相关性分析
2.4 ROC曲线分析确定HCV抗体最佳S/CO值
将HCV抗体检测结果与HCV RNA与RIBA结果进行比较,通过ROC曲线分析确定HCV抗体阳性预测值 ≥ 95%的最佳S/CO值为7.83,此时灵敏度为93.09%,特异度为95.83%,AUC为0.98,详见图4。随后本研究对HCV抗体S/CO ≥ 7.83的175例样本进行分析,其中HCV RNA、RIBA结果同时阳性(HCV现症感染)有56例,HCV RNA阴性、RIBA阳性有92例(均为HCV既往感染),HCV RNA、RIBA结果均阴性(假阳性)有2例,HCV RNA阴性、RIBA结果为不确定共25例,通过查阅病史或既往实验室结果确定其均为HCV既往感染,上述提到本研究HCV RNA阳性即HCV现症感染共61例,而有91.8%(56/61)的HCV现症感染患者其抗体S/CO在7.83以上。此结果提示当HCV抗体S/CO ≥ 7.83且HCV RNA为阳性时意味着高风险活动性HCV感染,对于HCV RNA阴性、S/CO ≥ 7.83的患者极有可能为HCV既往感染,详见表3。

表3 HCV抗体S/CO ≥ 7.83区间HCV RNA、RIBA结果分析

图4 ROC曲线分析
3 讨论
HCV感染是引起慢性肝病的主要原因,全球约有7 000万人感染HCV,是全世界不容忽视的公共卫生问题[9],因此,对HCV感染进行及时而准确的诊断十分重要。HCV感染的诊断基于实验室检测,HCV抗体检测因其操作简便,灵敏度高成为HCV感染筛查的首选方法,然而HCV抗体阳性并不能明确区分HCV现症感染、HCV既往感染以及抗体假阳性,HCV抗体阳性结果提示HCV活动性感染、病毒清除的HCV既往感染或HCV抗体假阳性[10-12]。研究[5]显示,对于HCV低流行率的人群以及抗体弱阳性的人群,其抗体假阳性的概率更高。在实际工作中,常会遇到HCV抗体弱阳性的样本,其抗体检测结果往往是造成临床诊断困惑的主要原因,同时也降低了检验报告的准确性。HCV抗体阳性的患者是否需要进一步处理一直是困扰临床的难题[13],RIBA因其高特异性曾被广泛作为HCV抗体的补充确证试验[14],现阶段对于HCV抗体阳性的患者进行HCV RNA检测证实HCV 抗体结果,但HCV RNA阴性并不能排除HCV感染[15]。因此对HCV抗体阳性结果的准确解释,区分HCV现症感染、既往感染与假阳性是亟须解决的。近些年,有研究[3-4]证实HCV抗体S/CO值可预测病毒血症,S/CO越高,抗体阳性率越高,对预测HCV感染具有重要价值。实验室可确定抗体检测临界值来预测临床诊断的真阳性[16]。不同实验室由于所用仪器、试剂及方法学不同,因此尚无法统一抗体弱阳性临界值,因此本研究拟确定本实验室医学决定水平,确定阳性预测值≥95%的最佳S/CO值,提高检验报告的准确性,协助临床诊断,最大限度缩小非必要进行抗体补充确证试验的人数。同时为探索不同系统丙型肝炎病毒抗体检测试剂95%阳性置信区间建立方法学。
本研究收取了2021年7月至2022年2月于首都医科大学附属北京地坛医院进行雅培化学发光免疫分析法检测抗体同时进行HCV RNA检测的患者血浆样本共282例,进行RIBA确证试验并查阅其HCV RNA结果,并统计HCV RNA及RIBA结果的分布情况,接下来根据实验室检测结果对HCV感染状态进行区分,确定HCV抗体真阳性。根据丙型肝炎病毒实验室检测结果解读指南[3],HCV RNA、RIBA结果均阳性样本61例,临床诊断为HCV现症感染,为真阳性。HCV RNA及RIBA结果均阴性样本48例,临床考虑为抗体假阳性,当1
实验室检测对于HCV感染的诊断至关重要,其中HCV抗体检测由于其灵敏度高、操作简便等优势成为HCV感染筛查的首个环节。但其方法学上存在假阳性,给临床诊断造成一定的困惑。因此对于HCV抗体阳性的患者需进一步进行补充确证实验来证实。近些年,有研究[3]证明HCV抗体S/CO值对于诊断HCV感染至关重要,疾病预防控制中心亦推荐不同实验室应确定阳性预测值 ≥ 95%的S/CO临界值,预测HCV感染,协助临床诊断同时减少假阳性报告的出现,同时临床可根据实验室确定的S/CO临界值做出正确决策,由此可见本研究具有很好的临床价值。
由于不同的实验室HCV抗体检测的仪器试剂不同,尚无统一的S/CO临界值,因此各实验室均应建立本实验室的医学决定水平。本研究也希望为探索不同系统丙型肝炎病毒抗体检测试剂95%阳性置信区间建立方法学。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明韩金育:进行实验,数据分析,论文撰写;郭晶晶:文章润色;孟欢、陈瑾:临床数据收集,协助数据分析;王雅杰:研究命题的提出,论文总体把关、审定。

