石墨烯及其衍生物在骨组织工程中的研究进展
常新代 孙苏静 彭东新 王小慧 张振琳
1燕山大学亚稳材料制备技术与科学国家重点实验室,材料科学与工程学院,河北秦皇岛 066004;2军事科学院军事医学研究院卫生勤务与血液研究所,北京 100850
1 引言
随着世界人口老龄化增加,对骨修复和再生的需求呈急剧上升趋势。创伤、先天性骨畸形和其他疾病引起的骨缺损每年多达20万人[1-3]。骨组织具有自然的愈合能力,但较严重的骨缺损需要人工干预才能愈合。常见的骨修复方法包括用同种异体或自体骨移植物替换有缺陷的骨来进行治疗,但这些骨缺损治疗会受到自体骨供应不足、同种异体骨移植物的免疫排斥和高昂的医疗费用的限制,因此需要寻找更有效的骨移植替代方案[4]。为了满足这一医疗需求,骨组织工程已成为一种很有前途的选择,而且细胞、生长因子和骨工程支架通常认为是骨组织工程中的三个关键因素[5-6]。
间充质干细胞是非造血基质多能干细胞,具有自我更新和分化潜力,可通过分化成不同的组织细胞修复组织损伤。作为多能干细胞,间充质干细胞不仅能够分化成人体多种细胞[7-9],还能够分泌生长因子,这些生物活性因子能够在局部形成复杂的生物活性因子网络,促进体内微环境的稳定[10],为干细胞发挥缓解炎症[11]、免疫调节[12]、组织再生[13]等功能提供了适宜的环境。在众多的生长因子之中,骨形态发生蛋白-2(bone morphogenetic protein 2,BMP-2)、和成纤维细胞生长因子-2(fibroblast growth factor-2,FGF-2)在骨生成过程中扮演了不可或缺的角色[14-15]。具体来说,BMP-2能够诱导间充质干细胞向成软骨细胞和成骨细胞的定向分化与增殖,进一步促进成骨细胞的分化与成熟,从而在骨生长、发育和再生过程中起到关键作用,加速骨损伤的修复。而FGF-2作为一种细胞遗传促进因子,在伤口愈合与组织损伤修复中都有显著的作用。目前常见的生物材料如生物活性陶瓷因具有生物相容性、良好的机械性能、低毒性和易于加工等优点广泛应用于骨组织工程中[16-18]。然而,单纯的生物材料存在降解时间过长以致无法达到材料降解速度与骨再生速度相匹配的理想效果。这些性能上的不足极大地限制了生物材料在骨组织工程中的应用。为了克服这些不足,最常见的方法是将生物材料与具有互补特性并提供协同效应的材料相结合,制备为多功能复合材料。
近年来,纳米尺度新材料在这一方面表现出了一些独特的优势[19-20]。石墨烯及其衍生物(graphene derivatives,GDs)具有良好的导电性能、大的表面积、高机械强度和优异的生物相容性、独特的物理和化学性质,不仅可以为细胞提供结构支撑,还可以调节细胞的增殖、分化和迁移。石墨烯及其衍生物主要包括石墨烯(graphene)、氧化石墨烯(graphene oxide,GO)和还原氧化石墨烯(reduced graphene oxide,rGO),它们会在功能上模拟天然骨骼的特性,在骨组织工程中具备较大潜力。此外,GDs也可以与多种生物医学材料复合,如聚合物或生物活性陶瓷,从而制备出具有良好生物相容性的复合材料[21-23]。因此GDs近年来被研究者们广泛用来调控间充质干细胞的成骨分化,有望成为骨组织工程中最有前途的支架材料之一。
在本篇综述中,首先介绍了GDs作为骨工程支架和药物载体的体内应用,还总结了基于不同动物模型的体内外研究,以便充分验证GDs的诱骨效应。随后着重总结了成骨分化相关信号通路如Wnt/β-catenin信号通路,MAPK信号通路以及BMP信号通路,并梳理了这些信号通路各自发挥的作用及各条通路之间的相互关系,对阐明成骨分化调控机制具有重要意义。最后列举了GDs在应用于临床之前存在一些挑战与建议,以期为其向临床转化提供科学数据和参考。相信在不久的将来,以GDs为代表的新型二维纳米材料可以在骨修复的治疗中大放异彩。
2 石墨烯及其衍生物
石墨烯是由物理学家安德烈·盖姆和康斯坦丁·诺沃肖洛夫在2004年利用微机械剥离法从石墨中分离出来的,它是由碳原子以sp2杂化方式形成六边形蜂巢状结构的典型二维纳米材料。石墨烯的每个碳原子都与三个其他碳原子以共价键相连,而第四个电子则形成π电子,自由地分布在蜂巢结构之上[24-25],由于其独特的结构,石墨烯显示出独特的物理和化学性质。例如,优异的机械性能可以提供一个坚固而稳定的基底,支撑细胞的增长、扩散和分化;同时还能为细胞提供一个近似于天然骨骼的微环境,这有助于间充质干细胞的增殖、分化和成熟[26]。良好的导电性可以改善相关生物分子和蛋白质之间的电化学以及电子传导联系,进而加速间充质干细胞增殖和骨形成[27]。此外,大的比表面积还使其成为一个有效的载荷和控制释放药物和生长因子的平台。这种释放可以与电刺激相结合,进一步增强成骨分化[28]。
如前所述,石墨烯的衍生物包括GO、rGO和由其他官能团修饰的功能化石墨烯等[29-30]。其中, GO是通过对石墨烯进行化学氧化得到的衍生物。在这一过程中,石墨烯的表面引入了多种氧化物官能团,如羟基(-OH)、醚键(-O-)和羧基(-COOH)。上述官能团虽然破坏了石墨烯的原本的π结构,导致其导电性下降。但这些官能团也带来了一些优势。例如,这些官能团促使GO在水中分散均匀,形成稳定的胶体溶液。此外还能通过氢键、共价键以及静电作用与蛋白质结合,并能通过结构化功能修饰参与复合生物材料的构建[31-32]。rGO是GO经过一系列化学还原得到的,在此过程中大部分的含氧官能团被去除,部分π结构得以恢复,致使rGO的导电性远高于氧化石墨烯,但低于石墨烯。值得注意的是,rGO的表面仍保留一些含氧官能团,这些官能团赋予rGO与蛋白质、细胞和其他生物分子结合的能力,进而促进细胞黏附、扩散和分化,使得GDs成为骨组织工程和骨再生医学中的理想候选材料[33-34]。
综上所述,无论是石墨烯、GO还是rGO首先要具有可功能化修饰的含氧基团便于形成复合型骨工程支架材料。其次要具有出色的机械性能,这可以为干细胞成骨分化提供一个坚固和稳定的基底,促进了间充质干细胞的增殖、分化。此外还应具有良好的导电性,可增强细胞与其周围环境之间的电信号交流从而影响间充质干细胞的增殖、迁移和分化。总之,上述结构和理化性质使得GDs在成骨分化领域具有广泛的应用前景,为组织工程和再生医学提供了新的可能性。
3 石墨烯及其衍生物在骨组织工程中的应用与研究
3.1 新型复合支架的增强组分
传统骨组织工程材料如聚合物和生物活性陶瓷由于机械性能欠佳,生产成本高,生物活性低等缺点导致应用不理想。因此研发出良好的生物相容性、和机械强度高和能促进干细胞成骨分化的新型复合支架具有重要意义。GDs可以作为很多生物材料的增强组分,例如将rGO与生物陶瓷(例如羟基磷灰石,HA)结合后可有效提高骨组织工程支架的性能[35]。研究报道,rGO掺入到多孔的HA以及形状记忆聚氨酯(shape memory polyurethane,SMPU)/HA/精氨酰-甘氨酰-天冬氨酸(RGD肽)复合材料中,通过合成新型纳米复合材料以提高其间充质干细胞的粘附性,促进新组织形成和与周围骨组织的整合[36-37]。此外,KANG等人[38]还比较了氧化石墨烯薄片/胶原蛋白支架与作为对照组的胶原蛋白支架的成骨潜力。由于GO有较多含氧官能团为其提供了更多的活性位点,与胶原蛋白之间的粘附作用得到增强,进一步促进了间充质干细胞的增殖、迁移和成骨分化,而将GO加入到聚(L-乳酸-乙醇酸共聚物)(poly(L-lactic-co-glycolic acid),PLGA) /HA纳米纤维支架中也观察到了类似的效果[39]。以上结论表明石墨烯及其衍生物作为新型骨组织工程复合支架的潜在价值,而且还为其在骨修复和骨组织工程中的应用提供了有力的实验依据。
3.2 药物载体
石墨烯基纳米材料在被用作新型复合骨工程支架的同时还兼具药物载体的功能。大的比表面积使其具有较强的药物携带能力,同时还可以通过精巧设计让它对所装载的药物实现一定的控制释放。具体来讲,石墨烯衍生物的表面的分子结构以及一些修饰基团,使其可以通过π-π堆积、氢键、静电相互作用、疏水相互作用等方式搭载药物或生物分子(如核酸、肽链等)[40-41]。例如,KACHOUSANGI等[42]研究者利用一种基于氧化石墨烯的pH敏感纳米复合材料作为药物载体,评估其在不同的pH值下对药物阿霉素(DOX)负载量和释放量。结果表明该复合材料在pH=5.5时的释放量是pH=7.5时释放量的两倍,而且该复合材料的载药率高达79%,有效改善了DOX释放量及负载量。此外,WANG等人[43]还将功能化的GO和丝素蛋白(silk fibroin,SF)底物通过冷冻干燥法制备了 GO/SF复合支架材料用于负载大剂量的丹酚酸(salvianolic acid B,SB),在持续释放SB的同时还保持了SB的生物活性,显著促进了大鼠骨髓来源的间充质干细胞的成骨分化,这证实GDs在作为骨工程支架的同时又是药物递送的良好候选者。此外,体内结果还显示GO具有促进血管再生的功能,而血管化骨组织再生一直以来都是骨组织工程研究领域的难点,提示GO用于实现血管化骨组织再生具有很大的潜力[43]。
3.3 基于不同动物模型的研究
如前所述,石墨烯及其衍生物在细胞水平表现出其作为骨组织工程材料的应用潜力,但距离实际应用于临床修复骨缺损仍需大量体内实验验证。为了充分说明石墨烯及其衍生物的诱骨效应,如下介绍了基于不同动物模型的关于石墨烯及其衍生物在骨组织工程方面的应用研究。
大鼠和小鼠是骨修复研究中成熟的动物模型,经常被用来证实石墨烯及其衍生物的诱骨效应。最近,Zhou等人将GO和 聚(3-羟基丁酸-co-4-羟基丁酸酯)(Poly(3-hydroxybutyrate-co-4-hydroxybutyrate),P34HB)通过静电纺丝技术制备了P34HB/GO纳米纤维支架,并采用复合支架修复大鼠颅骨骨缺损模型,观察发现骨缺损处有较多胶原基质的沉积,表明P34HB/GO支架在体内快速骨再生方面的潜力,揭示了石墨烯纳米纤维支架有望用于骨缺损再生修复[44]。此外,DANESHMAND等人[45]还利用3D打印技术制备了磷酸钙石墨烯支架作为可吸收的骨诱导基质。体外结果表明它们具有细胞相容性,可诱导人间充质干细胞成骨分化,并且成骨基因碱性磷酸酶(ALP)和Ⅰ型胶原骨桥基因(COL1A1)的表达水平升高。该研究是通过建立小鼠非愈合颅骨缺损模型来验证支架材料的诱骨效应,组织学显示支架周围有抗酒石酸酸性磷酸酶 (TRAP)染色表明可能存在破骨细胞,进一步验证了上述支架可作为骨诱导基质支持体内骨形成。SU,YAN等人[46-47]将石墨烯和聚醚醚酮(PEEK)通过熔融共混法分别制备了石墨烯/PEEK和碳纤维增强聚醚醚酮(CFR-PEEK)复合材料,体外实验表明,经石墨烯修饰的PEEK显著改善了细胞的粘附性和增殖性,具有良好的生物相容性;将该复合材料植入到兔关节外移植骨受损部位,术后4周和12周进行CT分析和组织学评估,结果表明,经石墨烯改性的植入物的微观结构参数明显优于对照组,平均矿物附着率更高,植入物周围形成了更多的新骨。上述动物模型中获得的实验数据进一步说明GDs在骨组织工程领域具有较大的应用前景。
4 石墨烯及其衍生物诱导成骨的信号通路总结
在骨组织工程中,成骨分化相关的信号通路具有较复杂的调控机制,而且彼此相互联系,相互影响,从而组成了一个更复杂而精细的调控网络,共同参与干细胞分化及骨形成的调节[48]。下面将详细介绍石墨烯及其衍生物(含复合材料)促进成骨分化相关的三类信号通路,即Wnt/β-catenin信号通路,MAPK信号通路以及BMP信号通路如图1。

图1 成骨分化信号通路示意图
4.1 Wnt/β-catenin信号通路
经典的Wnt/β-catenin信号通路主要参与调控多种生物学过程并调节骨发育和骨重塑的过程。Wnt/β-catenin信号通路主要通过抑制复合体(包括Axin,APC,GSK3β等蛋白)并稳定β-catenin蛋白使其进入细胞核并调控成骨相关基因如ALP、COL1A1、Runt相关转录因子2(Runx2)和骨钙素(Osteocalcin,OCN)的表达,从而参与间充质干细胞成骨分化的过程[49-52]。
YANG,XU等人[53-54]分别评估了低浓度的氧化石墨烯量子点(graphene oxide quantum dots,GOQDs)对骨髓来源的间充质干细胞(bone marrow mesenchymal stromal cells ,BMSCs)和人类脱落乳牙牙髓干细胞(stem cells from human exfoliated decid-uous teeth,SHED)的增殖和分化的影响,发现低浓度GOQDs可诱导钙结节形成、ALP活性增加以及 OCN、Runx2、COL1A1和β-catenin 的基因和蛋白水平上调,表明低浓度的GOQDs通过激活Wnt/β-catenin信号通路显著促进了BMSCs和SHEDs的增殖和分化。此外,研究者们还合成了其他类型的石墨烯衍生物如香草酸甲酯(MV)/rGO复合物、原始氧化石墨烯纳米片和磁性氧化石墨烯(MGO)等,并通过碱性磷酸酶测定(ALP)、茜素红S染色(ARS)、免疫荧光染色和相关成骨标志物的基因表达证明上述石墨烯衍生物或者复合材料也通过Wnt/β-catenin信号通路诱导干细胞成骨分化[55-57]。
4.2 MAPK信号通路
MAPK(丝裂原活化蛋白激酶)信号通路是一系列功能性的蛋白酶,这其中包括ERK1/2(外源性丝裂原活化蛋白激酶)、JNK(c-Jun N-端激酶)以及p38 MAPK。ERK1/2作为MAPK家族的先驱成员,主要参与细胞的生长、增殖和分化过程。相较之下,JNKs和p38 MAPK则更多地参与细胞应激、炎症以及程序性细胞死亡的响应。在成骨分化的过程中,MAPK信号通路发挥着核心的调控功能[58]。
研究指出,石墨烯纳米片(GNS)与碳纳米管(CNTs)能够激活ERK/MAPK通路,从而增强细胞外基质的矿化,提高ALP的表达,并加强成骨基因Runx2的表达,进而促进间充质干细胞的成骨分化[59-60]。另外,光交联的丝胶甲基丙烯酰(SerMA)与GO构成的水凝胶(SMH/GO)同样可以通过激活ERK/MAPK信号通路以及与之相关的趋化因子信号传导来调控大鼠骨髓来源的间充质干细胞的迁移和成骨分化,从而实现骨组织再生[61]。
石墨烯纳米材料还可能通过激活JNKs信号通路诱导成骨。具体来讲, Forkhead boxO1 (FoxO1)一种转录因子,在调节成骨分化和骨形成中起着至关重要的作用,FoxO1可以直接与JNK相互作用,通过控制FoxO1的核定位来诱导成骨。据研究报导,低剂量的GO纳米片对FoxO1的活化是通过对FoxO1去磷酸化和核易位的方式来实现的,而FoxO1的激活过程依赖于JNK的活性。这证实了低剂量的氧化石墨烯纳米片在促进成骨分化的过程是通过JNK及其下游的FoxO1信号通路来实现的,如图2所示[62]。
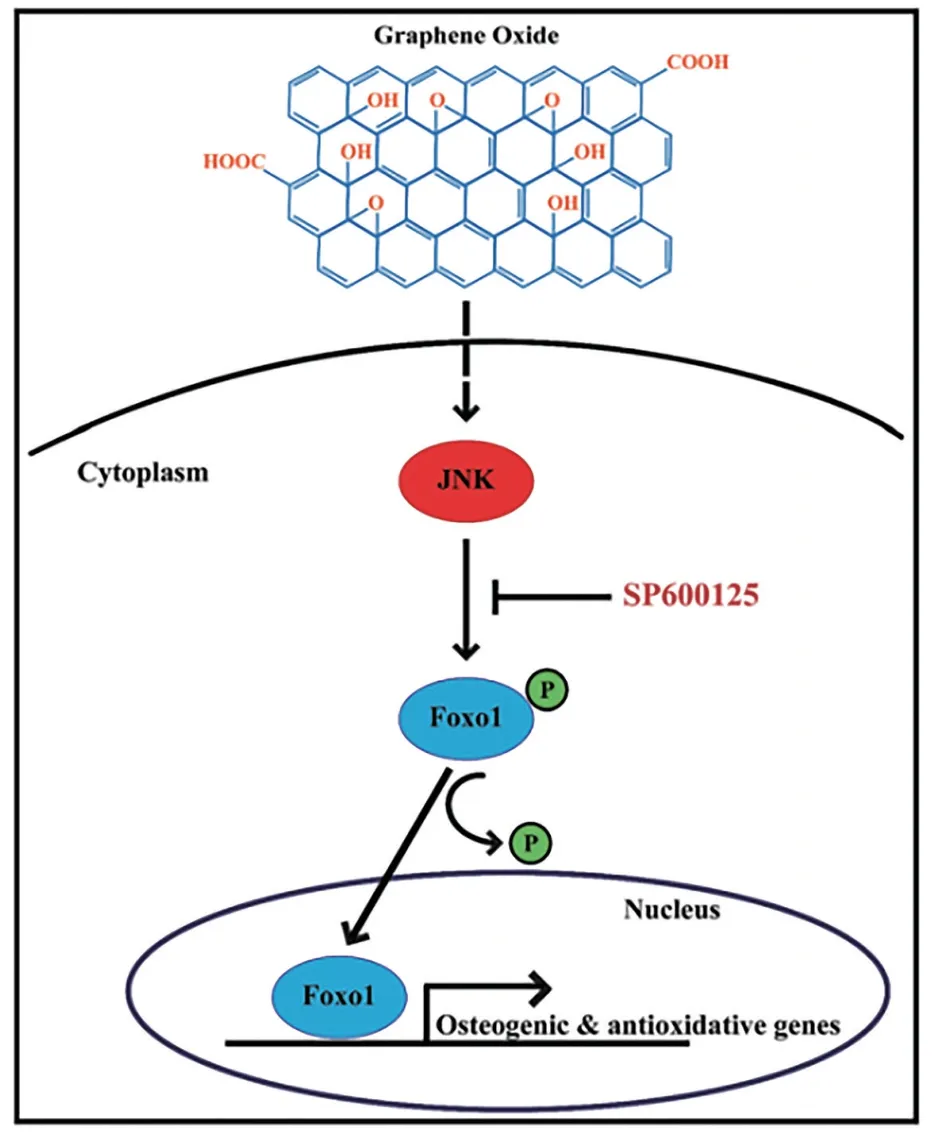
图2 成骨分化信号通路示意图
石墨烯衍生物对p38 MAPK信号通路的激活能够促进Runx2的磷酸化进而提高成骨相关基因的表达。通过对石墨烯与单壁碳纳米管(G/SWCNT)复合材料与大鼠来源的间充质干细胞(rMSCs)的相互作用进行研究,YAN等人[63]观察到, G/SWCNT处理后的rMSCs显示出更强的细胞活力,成骨相关基因Runx2和ALP的表达也相应上调。作者们进一步证实,G/SWCNT能够通过激活p38 MAPK信号通路来调控rMSCs的成骨分化。另外,将锶(Sr)-GO纳米复合材料掺入到生物相容性良好的胶原蛋白(COLI)支架形成Sr-GO-COLI增强型骨工程支架,结果表示,该支架能够同时激活MAPK/ERK和MAPK/p38信号通路并促进下游转录因子Runx2的磷酸化从而诱导人脂肪来源的间充质干细胞(hADSCs)成骨分化,表明GO复合材料有望成为增强骨工程支架组分的首要选择[64]。
4.3 BMP信号通路
BMP(骨形态发生蛋白)信号通路在成骨分化中同样发挥着至关重要的作用。BMPs作为转化生长因子-β(TGF-β) 超家族的一员存在于细胞外,属于分泌型蛋白,可以在血清中检测到。细胞外的BMPs与细胞膜上的BMP受体(BMPR-I和BMPR-II)结合后导致受体激酶的激活,活化的受体会磷酸化细胞内的下游信号转导分子Smad1/5/8,其与Smad4形成复合物后进入到细胞核内,结合到DNA序列上,从而调节BMP靶基因的转录[65]。
首先,石墨烯及其衍生物由于其表面的特殊性质可以为BMPs的粘附提供平台,具体来说,其富集效应使细胞周围形成一个富含BMPs的微环境,增强了BMPs与其细胞表面受体的相互作用,从而激活BMP信号通路[66]。其次,这种粘附作用不仅促进了BMP与受体的结合,还有助于Smad1/5/8蛋白的活化。活化后该蛋白会与Smad4结合形成复合体,进而转移到细胞核内,调控与成骨分化相关的基因表达。例如,LI等[67]制备了基于GO的纳米片用于增强hMSC的成骨能力,通过观察,使用BMP信号通路抑制剂LDN-193189后会抑制纳米片的骨诱导作用,表明GO功能化纳米复合材料是通过增强BMP-Smad1/5/信号通路促进hMSC成骨。此外,GDs还能够激发细胞自身更多地产生和释放BMPs,从而进一步强化BMP信号通路。例如,GO-羧甲基壳聚糖(CMC)水凝胶-BMP-2[68]、GO/SF/BMP-2电纺支架[69]以及三维石墨烯泡沫(GF)/BMP-2(GF/BMP-2)[70]等复合支架不仅证实可以极大提升BMP-2的释放量,还能促进细胞粘附和增殖,为优化骨工程支架提供了可行策略。
实际上,在骨组织的形成与再生过程中,三大信号通路起到了关键作用:BMP、Wnt/β-catenin和MAPK。这些通路之间不仅各自独立发挥作用,还相互交织与协作。例如作者制备了聚多巴胺(PDA)/GO复合材料用来评估多能干细胞的成骨性能。与对照组相比,在PDA/GO底物上培养的胚胎干细胞(ESCs)表达的骨形态发生蛋白受体I型和II型明显更高。而且观察到(ERK)1/2、p38和JNK的MAPKs的磷酸化[71]。此外,与对照组相比,PDA/GO上的细胞通过SMAD1/5/8磷酸化进行的BMP信号转导有所增加。细胞中SMAD1/5/8的核转位也随PDA/GO基质的变化而变化。阻断MAPK或SMAD信号通路的激活可抑制PDA/GO诱导的成骨分化。这些结果表明,PDA/GO复合物可通过MAPK和BMP/Smad信号通路刺激ESCs的成骨分化[71]。为了更直观地展示GDs如何通过上述信号促进间充质干细胞成骨,将它们的主要特点和功能总结在表1中。

表1 石墨烯及其衍生物介导间充质干细胞成骨分化相关的信号通路
5 总结与展望
本文综述了近年来GDs在骨再生和修复方面的进展,包括它作为新型复合骨工程支架的增强组分和药物载体的应用、基于不同动物模型的应用研究以及成骨分化相关信号通路等。具体来讲,GDs具有良好的机械性能和导电性能,可通过功能化修饰制备出新型复合支架,这为骨修复领域发展新型材料提供了新的方向。
然而,GDs新材料在应用于临床之前,仍存在一些挑战,包括以下几个方面。首先,虽然研究者筛选了不同层数(单层/多层)、剂量和不同功能化改性的GDs对诱导干细胞成骨效应的优劣,但考虑到骨工程支架材料的多孔结构会影响间充质干细胞的粘附生长情况,因此笔者认为也需要关注比表面积,孔隙率等其他性能参数。而且,因该类材料在诱导成骨分化的同时还可能对生物体兼具一定的免疫调节功能,因此其片径大小,微观形貌等理化性质对于骨工程支架的筛选应用考量也十分必要。其次,GDs的导电性质对于诱导干细胞成骨分化也相当重要,一类是利用GDs本身优异的导电性掺杂到基质中并在外部电极刺激下促进骨组织再生,其中它也可被用作电极。另一类是将GDs与其他材料复合制备出导电性质优良的新2D/3D复合材料来促进干细胞成骨分化。在未来的研究中,开发更多基于GDs的功能复合材料,将磁刺激、光刺激等各种外部刺激转化为电信号,从而进一步诱导间充质干细胞的成骨效应可能是重要的发展方向。
综上所述,GDs具有促进间充质干细胞成骨分化的特性,但要广泛应用于骨组织工程,仍需要大量的临床试验数据,以确保安全性和有效性。期待在不久的将来,以GDs为代表的新型二维纳米材料可以在骨骼疾病的治疗中大放异彩。
利益冲突所有作者均声明不存在利益冲突

