血型CD59基因在胰腺癌中的表达及临床意义
周仁龙 黄国清 李凌波 唐丹丹
1深圳市龙华区中心医院输血科,广东 518110;2吉林省健康管理学会、深圳爱康生物科技股份有限公司;3深圳市南山区医疗集团总部,广东 518055
目前,胰腺癌(pancreatic adenocarcinoma,PAAD)是导致患者死亡的第三大癌症[1],是一种预后极差、全球发病率不断上升的恶性肿瘤[2-5]。手术干预是提高患者长期生存率的唯一途径[6];标准的放化疗并不能明显延长PAAD患者的寿命,大约80%~85%的PAAD患者出现了无法手术切除的广泛转移[7]。此外,PAAD在早期通常没有明显症状[8-9],大约需要6个月才能被诊断出来。同一临床阶段的患者可能会出现不同的临床特征和治疗结果[10],这表明基于传统临床指标的肿瘤预后并不完全准确。传统的预后指标包括TNM分期、病理分级和组织学分级。患者的临床分期决定了化疗和免疫治疗策略。因此,为PAAD患者确定新的预后指标以提高他们的生活质量至关重要。
CD59血型抗原是一种膜表面糖蛋白,2014年,鉴于CD59相关的基因位点、分子生物学结构、免疫血清学反应等已基本确定,国际输血协会(international society of blood transfusion,ISBT)将其确认为一个新的血型系统[11],编号为35号。从20世纪50年代至今,研究发现血型与癌症、糖尿病、消化性溃疡、心脑血管疾病等多种疾病的发生具有某种联系。血型CD59抗原由编码基因CD59编码,它是一种高频抗原,在人群中的分布超过99%。抗原表位位于CD59抗原糖蛋白肽链的N末端。
CD59基因与肿瘤的相关研究已有不少报道[12],王卫东等学者[13]研究发现,CD59低表达的肺癌患者生存时间更短。孙伟等学者[14]研究发现CD59在胃癌组织中低表达可能对胃癌的早期诊断具有意义。在泌尿系统肿瘤中,CD59血型抗原的表达较高[15]。在肠道肿瘤[16]、前列腺癌[17]和卵巢癌[18]中CD59也有高表达。研究表明,肿瘤细胞过度表达CD59血型抗原可使其免受攻击,这被称为肿瘤细胞逃逸性[15]。这主要是因为CD59血型抗原是补体末端调节蛋白,在正常情况下,它可以保护细胞免受攻击而避免溶血。然而,这也使得肿瘤细胞逃脱了免疫监视和靶向作用,从而使抗肿瘤药物失效。目前,CD59与PAAD的研究报道较少,本研究旨在通过生物信息学研究CD59基因在PAAD中的表达及其临床意义。
资料与方法
1 GEPIA数据库分析
GEPIA数据库(http://gepia.cancer-pku.cn/)是一款新开发的交互式网络服务器,用于使用标准处理管道分析TCGA和GTEx项目中9736个肿瘤和8587个正常样本的RNA测序表达数据[19]。GEPIA提供可定制的功能,如肿瘤、正常差异表达分析、根据癌症类型或病理分期进行分析、患者生存分析、相似基因检测和相关性分析等。本研究运用GEPIA数据库分析CD59在PAAD和正常组织中的表达差异。使用log2(TPM+1)作为对数转换后的数据进行绘图。检索方法:①Box Plot中输入CD59基因;②肿瘤类型PAAD。
2 HPA数据库分析
HPA数据库(https://www.proteinatlas.org/)[20]是基于蛋白组学,转录组学以及系统生物学数据,可以绘制组织、细胞、器官等图谱。不仅收录了肿瘤组织,也涵盖了正常组织的蛋白表达情况。本研究通过HPA数据库分析了CD59在PAAD以及癌旁组织蛋白表达情况。
3 TIMER数据库分析
TIMER数据库(https://cistrome.shinyapps.io/timer)是利用RNA-Seq表达谱数据检测肿瘤组织中免疫细胞的浸润情况[21]。TIMER则提供6种免疫细胞(B 细胞, CD4+ T细胞,CD8+ T细胞,中性粒细胞(Neutrphils),巨噬细胞(Macrophages)和树突状细胞(Dendritic cells)的浸润情况。本研究通过TIMER数据库分析了CD59在PAAD中6种免疫细胞相关性。检索方法:①基因CD59;②肿瘤类型PAAD;③6种免疫细胞。
4 UALCAN 数据库分析
UALCAN数据库(https://ualcan.path.uab.edu/index.html)是一个综合的数据库[22]。基于癌症基因组图谱(the cancer genome atlas,TCGA)的数据,寻找在特定癌症中高或低表达的基因;分析感兴趣的基因、miRNA和lncRNA在癌症中的表达、对患者生存的影响;探究基因的启动子甲基化水平以评估基因表达的表观遗传调控;泛癌分析等。基于CPTAC的数据,UALCAN为研究者提供了包括总/磷酸蛋白在内的临床蛋白质组学联合数据分析。基于CBTTC的数据,还能对儿科脑肿瘤的基因表达和蛋白质表达进行分析。本研究主要分析CD59在PAAD中参与信号通路和蛋白表达。给定癌症类型的样本中值的标准差。Z值表示给定癌症类型的样本中值的标准差。检索方法:①基因CD59;②选择癌症类型为PAAD。探索CD59在PAAD患者中的蛋白表达与正常癌旁组织的表达差异。
5 String数据库分析
String数据库(https://www.string-db.org/)是一个可以用来检索已知蛋白和预测蛋白之间相互作用的数据库[23]。本研究主要是通过数据库分析CD59与上下游蛋白的关系,获得相应的关系网络图。检索方法:①基因CD59;②物种选择“homo sapiens”;③相互作用选择连接数10。
6 单因素和多因素相关性分析
从TCGA数据集(https://portal.gdc.com)获得了CD59在PAAD的RNAseq数据(level3)和相应的临床信息。单变量和多变量Cox回归分析并通过“forestplot” 包使用森林图来显示每个变量(P值,HR和95%CI)。根据多变量Cox比例风险分析的结果,通过与每个风险因素相关性来计算患者的预后风险。
7 基因集功能富集分析
对于基因集功能富集分析我们使用R软件包org.Hs.eg.db (version 3.1.0)中基因的KEGG和GO注释,以此作为背景,将基因映射到背景集合中,使用R软件包clusterProfiler (version 3.14.3)进行富集分析,以获得基因集富集的结果。设定最小基因集为5,最大基因集为5 000,P<0.05有统计学意义。
8 统计学处理
本研究采用t检验比较CD59mRNA表达差异,采用Log-rank检验比较不同表达水平的生存差异从而得出P值,免疫细胞的浸润采用Sperman's相关性检验,*表示P<0.05,以P<0.05表明结果具有统计学意义。
结 果
1 CD59在PAAD以及正常组织表达情况
本研究使用GEPIA数据库分析了CD59血型基因在正常组织和PAAD中的mRNA表达水平,并利用UALCAN数据库分析了CD59在正常组织和PAAD中的蛋白表达水平。GEPIA数据库分析结果显示,CD59的mRNA在PAAD患者中呈表达显著升高,有统计学意义(P<0.05)(图1A)。UALCAN数据库分析结果显示,在74例正常组织和137例PAAD中,CD59蛋白在PAAD患者中也显示出上调(图1B)表达差异显著,有统计学意义(P<0.05)。

图1 CD59在PAAD 中的表达
2 CD59在PAAD组织以及正常癌旁组织中蛋白表达水平
本研究使用HPA数据库在线分析了CD59在PAAD和人癌旁胰腺组织中的免疫组织化学染色结果。结果显示,癌组织免疫组化染色较正常组织更深,在正常癌旁中CD59的染色水平较低,而在PAAD中CD59的染色强度较高(见图2)。这一结果与GEPIA和UALCAN数据库在PAAD中CD59表达上调的结果一致。据此可以得出结论,CD59蛋白在PAAD中的表达上调。

图2 CD59蛋白在正常癌旁胰腺组织中以及在PAAD中的表达水平
3 CD59在PAAD中与免疫浸润细胞的相关性分析
肿瘤和免疫之间的相互作用是医学研究的热点,免疫细胞能够通过其抗肿瘤免疫力杀死肿瘤细胞。因此,本研究利用TIMER数据库分析了CD59基因表达与PAAD中免疫细胞浸润的相关性。在对CD8+T细胞、B细胞、CD4+ T细胞、巨噬细胞、中性粒细胞、树突状细胞,进行肿瘤纯度(Purity)校正后,结果显示(见图3和表1),在PAAD中CD8+ T细胞、巨噬细胞、中性粒细胞和树突状细胞的浸润与CD59基因表达呈正相关(P<0.05)。
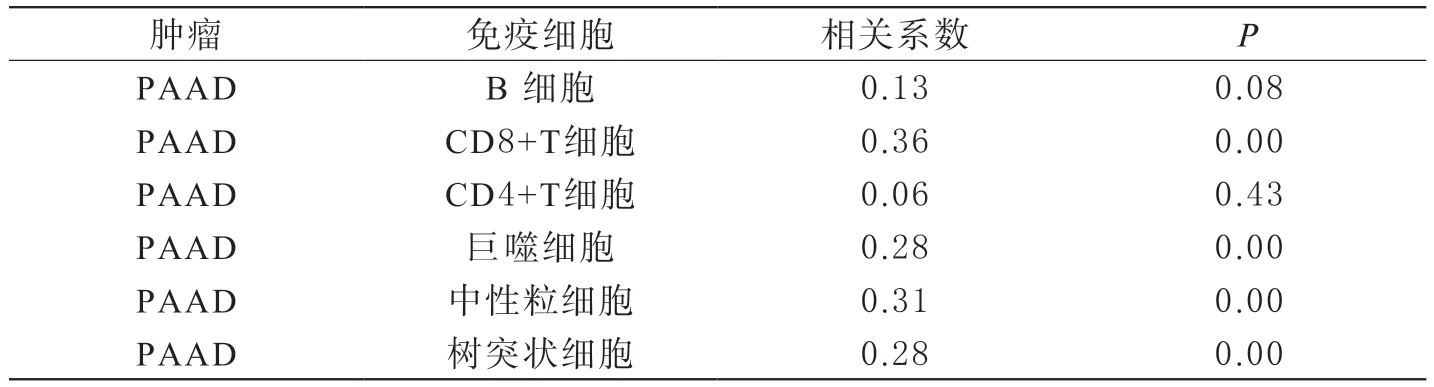
表1 CD59基因表达水平与PAAD免疫细胞浸润水平的关系
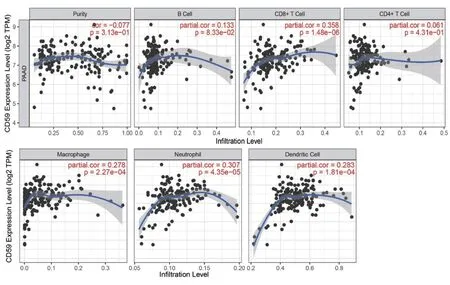
图3 CD59基因表达水平与PAAD免疫细胞浸润水平的关系
4 CD59在PAAD参与信号通路
本研究利用UALCAN数据库分析了CD59在PAAD和正常组织中的表达水平与mTOR和Hippo信号通路的相关性。研究结果显示,与正常组织相比,PAAD患者的mTOR和Hippo信号通路存在显著相关性(图4A和B,P<0.05)。
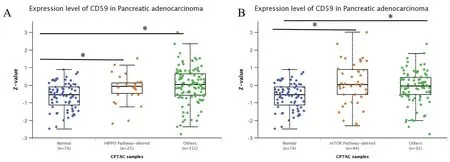
图4 CD59在PAAD参与mTOR和Hippo信号通路
5 CD59相互作用蛋白网络分析
使用String数据库分析CD59蛋白的相互作用,发现多个蛋白与CD59相互作用(见图5),包括C9、VTN、CD46、CR1、CD2、CD55、PIGA、CAV1、CFH、C3。CD59是一种细胞表面蛋白,它与多种其他蛋白质发生相互作用,包括调节补体系统的蛋白质、参与细胞膜信号传导的蛋白质、参与细胞膜糖脂合成的酶等。

图5 CD59的相互作用蛋白网络图
6 单因素和多因素Cox回归结果分析
单变量Cox回归结果显示PAAD患者的发生和发展与CD59、分期(pT-stage、pN-stage)、分级(Grade)相关P<0.05,而与分期(pM-stage、pTNM-stage)无关(图6A,P>0.05)。多变量Cox回归分析显示PAAD患者的发生和发展与分期(pN-stage)、分级(Grade)相关P<0.05,而与CD59、分期(pT-stage、pM-stage、pTNM-stage)无关(图6B,P>0.05)。这些结果表明,CD59可能在PAAD的发生和发展中发挥一定的作用,但其作用可能还受到其他因素的影响。

图6 单因素和多因素Cox回归分析
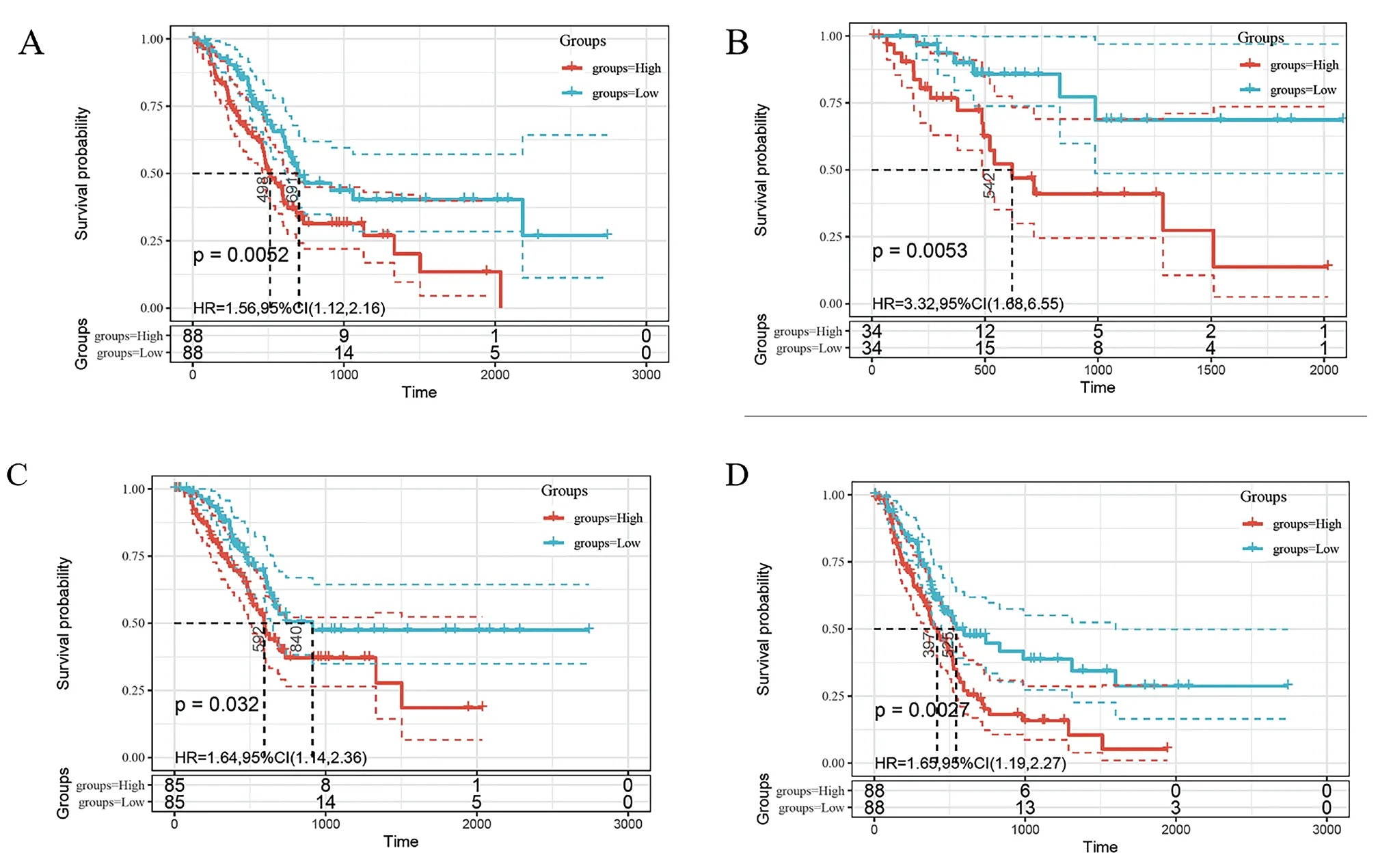
图7 CD59表达与PAAD患者生存曲线图
7 CD59表达与PAAD患者预后的关系
本研究运用TCGA数据库中的临床预后数据分析了PAAD患者CD59表达量与患者生存期之间的相关性,根据最佳截断值将PAAD患者分成高(High)低(Low)两组。分别对总生存期(overall survival,OS),疾病特异性生存期(disease free survival,DSS),无进展间隔期(progression free interval,PFI ),无疾病间隔期(disease free interval,DFI)进行分析。结果表明CD59高表达与PAAD患者OS、DSS、PFI、DFI(图A、B、C和D,P<0.05)的不良预后相关,而低表达患者的预后好。
8 KEGG和GO富集分析结果
为了明确CD59基因在KEGG和GO通路中的富集情况,进一步理解基因的生物学功能和调控机制做了KEGG和GO富集分析,KEGG富集分析结果显示,候选基因参与了补体和凝血级联、粘着斑、蛋白多糖与肿瘤、金黄色葡萄球菌感染、造血细胞谱系、糖基磷脂酰肌醇锚定生物合成、流体剪切应力与动脉粥样硬化、肌动蛋白细胞骨架的调控、Ecm受体相互作用和上皮细胞的细菌侵袭等,其中占主导地位的是补体和凝血级联通路(图8A)。GO富集分析结果显示候选基因参与了蛋白质加工的调控、蛋白质加工水平的调控和急性炎症反应蛋白过程补体激活的调节等。其中蛋白质加工的调控信号通路占主导地位(图B)。
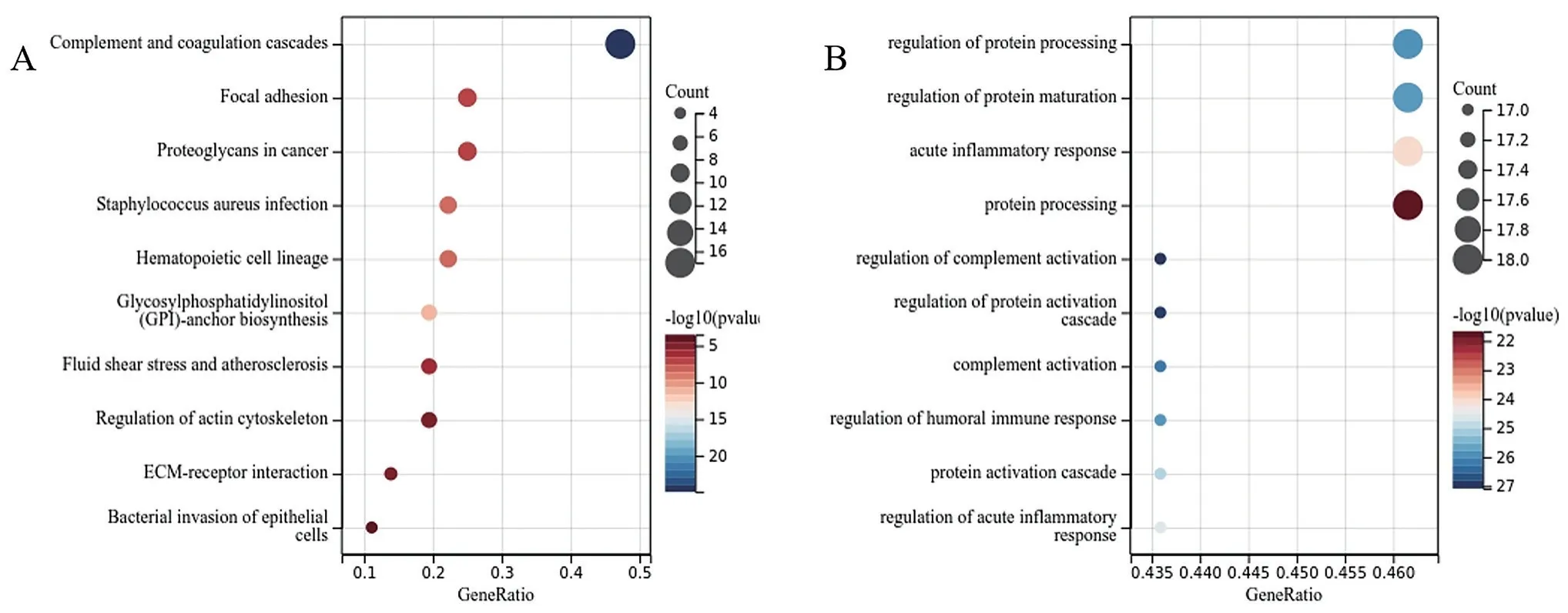
图8 富集分析KEGG和GO图
讨 论
PAAD是一种高度致命的癌症,五年生存率约为11%,随着发病率的增加,预计到2030年,它将成为美国癌症相关死亡的第二大原因[24-25]。PAAD治疗选择方式是有限的,只有15%~20%的患者接受前期手术;其余患者表现为不可切除远处转移。深入了解PAAD的分子发病机制,开辟多种治疗途径,如靶向治疗、细胞治疗和免疫疗法,将进一步提高PAAD的生存率[26]。PAAD的诊治相对复杂且异质性较高,因此寻找与PAAD预后相关的关键基因对于早期监测和治疗靶点的研究具有重要意义[27]。多项研究发现血型与癌症发生存在一定的关联。黄彬亮等学者[28]报道,ABO血型与不同良恶性疾病的发生和预后相关,例如结直肠癌[29]、过敏性鼻炎和支气管哮喘[30]、静脉血栓栓塞症[31]胰腺癌[32]、肝癌[33]、胃癌[34]等。血型作为人类的一种稳定和非常独特的遗传标志[35],不仅在红细胞表面表达,而且在许多其他组织中也有表达,肿瘤细胞表面血型抗原的修饰表达可以改变肿瘤细胞的运动性、耐药性、细胞凋亡和免疫逃逸能力。
红细胞CD59血型抗原,属于膜分化抗原,通过生物信息学研究它与胰腺癌之间的相关性,有望提高对PAAD发病机制的认识。CD59是一种膜结合蛋白,可抑制补体膜攻击复合物(membrane attack complex,MAC)的形成,从而促进肿瘤细胞免疫逃逸[36]。有研究报道,在前列腺癌症患者骨转移中CD59的表达水平高于原发性前列腺癌症病变,这表明CD59可能在癌症前列腺骨转移中发挥重要作用[36]。CD59还可以抑制肿瘤的细胞凋亡和新生血管形成[37-38]。CD59在大多数肿瘤中过表达,并非常有效地保护肿瘤细胞免受补体攻击[39]。
本研究基于临床大样本数据库分析CD59血型基因在PAAD患者中mRNA和蛋白均高表达,CD59在PAAD中表达水平与CD8+ T细胞、巨噬细胞、中性粒细胞、树突状细胞在PAAD中呈正相关(P<0.05),这个结果表明CD59可能在PAAD的免疫反应过程中发挥重要作用。CD59的高表达水平可能与免疫细胞的活化、浸润以及免疫反应的调节有关,有望为进一步探究PAAD的免疫逃逸机制和新的治疗策略提供线索。对肿瘤的生存期研究有重要的临床意义,了解肿瘤患者的生存期可以帮助医生评估疾病的预后,并为制定个体化的治疗方案提供依据。生存曲线结果显示与CD59低表达组相比高表达的PAAD患者预后不良。PI3K/Akt/mTOR信号通路是在癌症患者中最常见的失调信号通路之一,在促进肿瘤的发生、发展和治疗中起着至关重要的作用[40]。Hippo通路在许多生物过程的调节中发挥着至关重要的作用,如细胞增殖和分化、器官生长、胚胎发生和组织再生/伤口愈合。Hippo通路的失调可导致多种疾病,包括癌症、眼部疾病、心脏疾病、肺部疾病、肾脏疾病、肝脏疾病和免疫功能障碍[41]。CD59表达水平在PAAD中参与mTOR和Hippo信号通路影响肿瘤的发生和发展,mTOR通路是一种受多种细胞信号调控的丝氨酸/苏氨酸蛋白激酶,而Hippo信号通路则参与了多项生物学功能,包括细胞增殖、凋亡、干细胞自我更新等。CD59在PAAD中的表达与这两个信号通路存在相关性,并可能对该肿瘤的发生和发展产生重要的影响。本研究结果显示CD59与C9、VTN、CD46、CR1、CD2、CD55、PIGA、CAV1、CFH、C3等蛋白具有相互作用。这些相互作用可以调节免疫反应、促进细胞黏附和迁移、影响细胞膜的形成和信号传导,从而参与肿瘤的发生和发展。
综上所述,CD59参与PAAD的发生与发展,其有望作为PAAD的预测及治疗靶点。然而,本研究存在一定局限性,研究所用的临床数据均来自公共数据库,没有进一步做细胞和组织实验的验证,因此CD59在PAAD中的具体作用机制、预后评估以及治疗靶点的价值需要进一步深入研究。
利益冲突所有作者均声明不存在利益冲突

