单中心自体造血干细胞采集效果影响因素分析*
张成鑫 杨杰 郝欣欣 王秋实
中国医科大学附属盛京医院,辽宁沈阳 110004
造血干细胞移植(hematopoietic stem cell transplantation,HSCT)是恶性血液系统疾病主要治疗方法之一[1]。主要工作原理是将骨髓中造血干细胞(hematopoietic stem cell,HSC)动员至外周血中,通过血细胞单采机采集足量的HSC供移植使用。根据HSC的来源可以分为自体HSCT(auto-HSCT)和异体HCST(allo-HSCT)。HSCT成功的关键是采集当天外周血中有足够的HSC,并设置合适的采集参数采集出足够的HSC[1-3]。
外周血中CD34+细胞计数是预测外周血中HSC含量最有效的参数,一般认为行auto-HSCT时CD34+细胞数至少为2×106/kg[2-3],多数患者因需要采集时间较长,没有足够时间等待外周血CD34+细胞计数完成后即开始采集。因此多数根据动员剂使用情况、采集动员时间、当日白细胞计数确定是否采集[4-5]。以往研究发现诊断时间长、化疗周期6个周期以上,骨髓中浆细胞含量超过20%是HSC采集不足风险因素[6-8]。本研究回顾性调查了2018年1月—2023年1月应用便携式血细胞采集仪MCS+进行的140次自体HSC采集情况,分析不同采集效果的患者采集前以及采集时参数的差异,旨在发现影响HSC采集效果的因素,预测患者采集效果,为后续采集和治疗提供预测方案。
材料与方法
1 研究对象
以2018年1月—2023年1月在中国医科大学附属盛京医院行auto-HSCT的63名患者的140次HSC采集为研究对象。采集前签署HSC动员和血细胞分离单采知情同意书。纳入标准:年龄≥14岁,拟行auto-HSCT,完成一次完整HSC采集。排除标准:异基因HSC采集,年龄<14岁,患者不能耐受或者采集时有特殊情况中途停止采集。数据回顾性调查经中国医科大学附属盛京医院伦理委员会批准。不涉及患者隐私,免除知情同意。
2 试剂与仪器
便携式血细胞采集仪(MCS+,美国血液技术,美国)、血细胞分析仪(XP-100,Sysmex,日本)、重组人粒细胞集落刺激因子250 μg(批号:N19K312,格拉诺赛特,日本)、一次性使用血细胞分离器971E(批号:8921132,美国血液技术,美国)、 血液保存液ACD-A(批号:2202271,山东威高,中国)、葡萄糖酸钙注射液(批号:20220512,华润双鹤利民药业,中国)。
3 HSC动员
患者动员方案:多发性骨髓瘤(Mutiple myeloma,MM)患者采用CE动员方案(环磷酰胺3 g/m2,d1;依托泊苷100 mg,d1-4)。淋巴瘤患者采取ESHAP动员方案(顺铂20 mg/m2,d1-4;依托泊苷100 mg,d1-4;甲基强的松龙500 mg,d1-4;阿糖胞苷1 500 mg/m2,d5)。联合粒细胞集落刺激因子。从化疗后患者白细胞到达最低值(简称低点)开始回升时给予粒细胞集落刺激因子5 μg/(kg·d),1次/12 h皮下注射,d4-5或白细胞升高至3×109/mL开始干细胞采集。
4 HSC采集前评估
采集当日复查血常规,并在采集前2 h使用粒细胞集落刺激因子。所有患者采集后以CD34+含量≥2×106/kg作为采集效果较好判断标准[2-3],根据患者需要移植干细胞数量决定是否再次采集。
5 HSC采集
使用便携式血细胞采集仪MCS+进行采集,程序为外周血HSC采集,采集区间选择分光度45%~12%,后推8~12 mL红细胞,再循环比例1∶4,循环总血量设定为患者总血容量的1.5~2倍,根据终体积进行微调。采集过程应用枸橼酸抗凝,抗凝比例为1∶8~1∶12。采集过程中密切观察患者是否有口唇麻木,抽搐,心慌低钙反应等,每小时给予口服10%葡萄糖酸钙口服液一支,预防枸橼酸钠过量,采集后的干细胞进行血常规和CD34+计数。
6 分组
以采集终产物中的CD34+计数分组,其中的CD34+细胞计数≥2×106/kg计为良好组,<2×106/kg计为不佳组[9-10]。
7 观察指标
回顾性调查两组患者性别,年龄,体重,诊断,采血血量,低点天数,低点时白细胞水平,低点到采集天数,采集前1日白细胞计数,采集当日白细胞计数,采集当日淋巴细胞计数,采集当日单核细胞计数,采集当日血红蛋白(hemoglobin,HB)红细胞压积(hematocrit,HCT),采集干细胞容积,循环总血量。
8 统计学分析
应用SPSS 26.0软件进行统计学分析,数据均采用中位数(范围)及中位数(四分位间距)表示。计量数据均不服从正态分布,采用Wilcoxon两独立样本检验;计数数据采用卡方检验。风险因素分析采用Logistic回归分析。采用DeLong方法对年龄、采集时间,有核细胞及总体模型曲线下面积进行比较[11]。
采用受试者特征(receiver operating characteristic curve,ROC)曲线下面积(area under the curve of AUC)评估模型的准确性。根据约登指数最大值确定截断值,计算灵敏度与特异度等指标。采用DeLong的方法对年龄、采集时间,白细胞及总体模型曲线下面积进行比较。P<0.05表示差异有统计学意义。
结 果
1 两组患者基本情况及采集情况
共63名患者140次自体HSC采集纳入分析,其中男性患者79例次,女性患者61例次,淋巴瘤88例次,MM 52例次。两组采集前实验室参数:动员到低点时间、动员时最低白细胞计数、低点到采集的天数、采集当天患者白细胞计数、单核细胞计数、淋巴细胞计数、红细胞压积和血红蛋白水平有统计学差异。两组患者基本情况以及采集情况见表1。
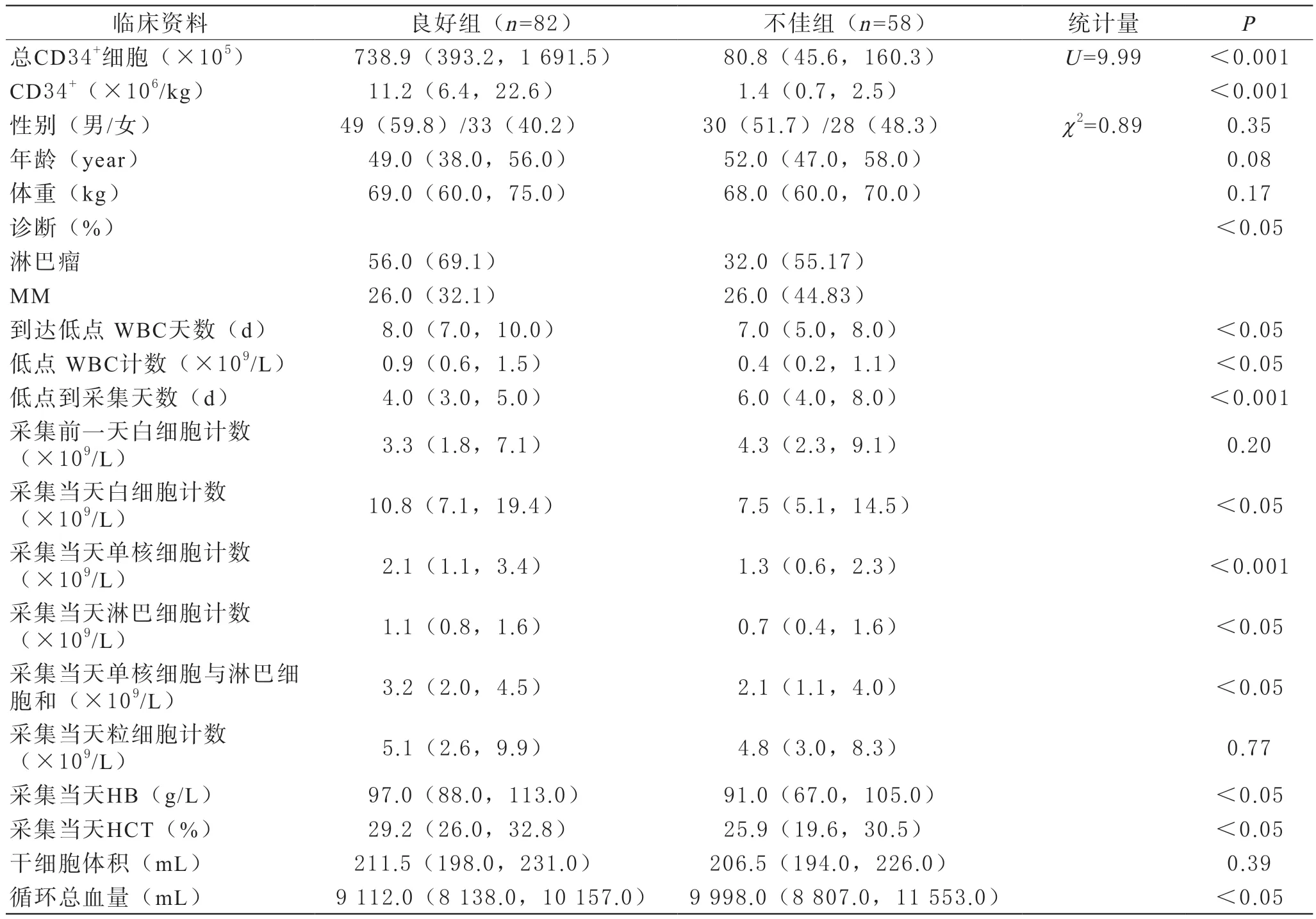
表1 两组患者基本情况以及采集情况
2 影响患者采集效果独立风险因素
Logistic回归分析后发现,患者年龄、低点到采集的天数以及采集当天单核细胞计数是影响采集效果的独立风险因素。影响采集效果独立风险因素见表2。

表2 影响采集效果独立风险因素
3 采集效果预测模型评估
患者年龄、低点到采集的天数、采集当天单核细胞计数的ROC曲线下面积分别为0.63,0.73,0.70。多变量模型的曲线下面积为0.81,高于单个变量的表现,P值均<0.05,有统计学差异。患者年龄、低点到采集的天数、采集当天单核细胞计数及总体模型曲线下面积见图1。

图1 患者年龄、低点到采集的天数、采集当天单核细胞计数及总体模型曲线下面积
讨 论
目前,HSC采集动员方案多数采取化疗联合粒细胞集落刺激因子进行动员,动员后几天或白细胞回升到一定程度时开始采集。HSC采集设备工作原理是利用透光度探针对采集到离心杯内离心全血进行透光度检测,血细胞为有形成分,含有不同类型细胞的血浆透光度不同,根据不同细胞透光度差异可以对目的细胞进行采集[12]。本研究对便携式血细胞采集仪MCS+的采集效果进行分析。
CD34+细胞目前是HSC成功采集的最有效的标志物和预测指标,在外周血中,含量低于0.1%,动员后的外周血中可以含有相当于骨髓甚至高于骨髓的CD34+细胞[1-3],因此可以通过采集动员后的外周血获得足够的HSC。但是由于CD34+细胞计数回报时间较长,动员后干细胞在体外容易快速分化成熟,另外由于HSC采集时间较长,因此一般不等待CD34+细胞计数结果,多数根据动员天数、白细胞计数等情况启动采集。本研究根据采集后CD34+/kg的数量进行分组后发现良好组和不佳组中包括诊断、到达低点天数、低点白细胞计数、低点到采集天数、采集当日白细胞计数、单核细胞和淋巴细胞计数、当日HB值、当日HCT、循环总血量均有统计学差异。与以往文献报告干细胞采集与患者性别、白细胞计数、动员方案、血小板计数,循环中不成熟细胞数量相关等部分一致[7-8]。提示患者的基础疾病以及对动员反应情况可能影响采集效果。
在分析基础疾病时发现患有淋巴瘤的患者采集效果优于MM患者,尽管均为恶性血液病,但是MM主要累计骨髓,骨髓中干细胞储备不足,导致即使使用了足量的动员剂,但是外周血中仍没有足够的HSC用于动员。PUSIC等[13]发现无论使用哪种动员方案MM患者多次采集率都高于淋巴瘤患者。
在干细胞动员的过程中,多数使用化疗药物结合集落细胞刺激因子方案。应用化疗药物后患者由于骨髓造血抑制,导致外周血中白细胞逐渐下降到最低,然后随着化疗停止,骨髓造血恢复,外周血中白细胞逐渐升高,结合集落细胞刺激因子作用,骨髓中HSC动员到外周血中,即可以进行采集。对比采集良好组,发现不佳组患者到达低点天数长,低点时白细胞计数低,低点到采集时间长,采集当日白细胞计数、单核细胞计数和淋巴细胞计数均较低。提示采集不佳组骨髓储备能力可能较差,化疗药物使用后,外周血细胞计数快速下降,停药后,尽管使用足量集落细胞刺激因子,但是由于患者体内没有充分HSC,导致外周血中成熟细胞和干细胞均较少,无法采集充足的干细胞[13]。
单针采集过程是采集一定量的外周血后,在离心杯中逐渐将透光度高的血浆推送到转移袋中,采集一定透光度区间的细胞成分,完成干细胞分离采集,采集过程和回输过程交替进行。因此,患者HB值和HCT会影响每次体外分离血量,贫血患者由于HCT低,需要更多离体血液用于分离HST。本研究结果显示,采集效果不佳组患者的HB和HCT均低于采集效果较好组。与李少文等[14]发现采集时HB低,采集的干细胞中HSC含量低结果一致。分析原因也可能与患者骨髓储备低有关,红系造血恢复较慢。对比总的循环血量,效果不佳组循环血量更多,单针干细胞采集时使用间断采集的方式,采集不佳组由于贫血患者较多,每次循环处理血量较多导致总处理量较多。另外,采集人员也会根据前次采集结果临时提高总处理量以期待采集更多的干细胞,但是从分析结果看,尽管循环血量增加,仍不能采集足够的干细胞,提示有效的动员时机和采集时机才是HSC采集效果的有效保障。
为了分析影响采集独立风险因素,本研究对17个因素进行的Logistic回归结果显示,患者年龄、低点到采集的天数、采集当日的单核细胞计数是影响采集效果的独立风险因素,以上因素对于预测采集效果的ROC曲线下面积分别为0.63,0.73,0.70。年龄小、低点到采集的时间短,采集当日单核细胞计数高与采集效果好相关,患者对于动员剂反应速度快,反应效率高是有效采集的重要保障。KONG等[15]和苗莹莹等[16]在对异基因供者采集影响因素中也发现供者年龄是影响采集效果的独立风险因素,在异基因供者不能及时进行CD34+细胞计数时,通过对上述3个参数判断可以预测采集效果,3个参数对于预测采集效果预测曲线下面积为0.81,可以较好预测采集效果,以为继续采集或者更换治疗方案做准备。
总之,通过应用MCS+采集的自体HSC回顾性分析发现患者的基础疾病、对动员剂的反应、患者采集前HB等在采集效果良好和不佳组有区别。患者年龄、低点到采集的天数、采集当日的单核细胞是影响采集效果的独立风险因素。
利益冲突所有作者均声明不存在利益冲突

