基于UPLC-Q-Exactive Orbitrap-MS 的经典名方温胆汤化学成分分析
张奎斌,邢斌,宋纹,王仁兴,张青青,刘志东,皮佳鑫
(1.天津中医药大学组分中药国家重点实验室,天津 301617;2.天津中医药大学现代中药发现与制剂技术教育部工程中心,天津 301617;3.天津宏仁堂药业有限公司,天津 301617)
温胆汤源于北周名医姚僧垣所撰《集验方》,始见于唐代孙思邈《急备千金要方》,谓:“治大病后,虚烦不得眠,此胆寒故也,宜服温胆汤。”《古代经典名方目录(第一批)》中:温胆汤由半夏二两、竹茹二两、枳实各二两,橘皮三两,生姜四两,甘草一两组成。现代临床在该方基础上进行加减裁化以用于治疗失眠、高血压、冠心病、抑郁、精神失常等疾病,效果显著[1-4]。目前关于温胆汤的作用机制研究报道较多[5-6],但其物质基础并不明确,且多从单味药入手,未考虑到复方煎煮过程的损失与新成分的生成,缺乏复方系统性研究。此外温胆汤成分复杂,给其质量控制带来一定困难。因此,明确温胆汤化学成分对其药效物质基础研究及进一步对其作用机制的阐明、质量控制尤为必要。超高效液相色谱-四极杆-静电场轨道阱高分辨质谱法(UPLC-Q-Exactive Orbitrap-MS)具有“三高”(高效率、高灵敏度、高分辨率)的特点,通过化合物精确的分子量、元素组成以及质谱碎片等信息,可快速确定化合物的结构。本文采用UPLC-Q-Exactive Orbitrap-MS 技术对温胆汤的成分进行分析。根据精确的分子量信息及质谱裂解规律进行解析,并与对照品对照或参考相关文献数据与质谱数据库,从而对温胆汤中化合物进行鉴定。
1 仪器与试剂
1.1 仪器 UltiMate 3000 超高效液相色谱仪,美国Thermo 公司;Q-Exactive Orbitrap 质谱,美国Thermo公司;Xcalibur 3.0 工作站,美国Thermo 公司;AX224ZH 万分之一电子天平,天津奥豪斯仪器有限公司;AX205 十万分之一天平,瑞士Mettler Toledo公司;Milli-Q 去离子水机,美国Millipore 公司;FDU-2100 冷冻干燥仪,东京理化器械株;N-10000旋转蒸发仪,上海爱朗琴仪器有限公司。
1.2 试剂 甘草饮片(批号:202001019,产地内蒙古)、竹茹饮片(批号:202001005,产地江西)、枳实饮片(批号:202001007,产地湖南)、陈皮饮片(批号:202001011-1,产地湖北)、生姜饮片(批号:190301-3,产地河北)、半夏饮片(批号:181209,产地甘肃)。上述饮片均由天津宏仁堂药业有限公司提供,均符合《中国药典》2020 年版一部有关规定。甘草酸(上海源叶生物科技有限公司,批号:Y02J11L113432,纯度≥98%);枸橘苷(成都瑞芬思生物科技有限公司,批号:G-019-171216,纯度≥98%);新橙皮苷(上海源叶生物科技有限公司,批号:231J6L2067,纯度≥98%);柚皮苷(四川维克奇有限公司,批号:wkq20020603,纯度≥98%);圣草次苷(上海源叶生物有限公司, 批号:M17D9S77644,纯度≥98%);芸香柚皮苷(上海源叶生物科技有限公司,批号:P25J9L66554,纯度≥98%);甘草苷(上海源叶生物科技有限公司,批号:213J11X108109,纯度≥98%);橘皮素(天津中新药业有限公司,批号:W14-1-2,纯度≥98%);甘草素(上海源叶生物科技有限公司,批号:C26A10Q87049,纯度≥98%);橙皮苷(上海源叶生物科技有限公司,批号:K09S11L123847,纯度≥98%);辛弗林(中国食品药品鉴定研究院,批号:110727-201107,纯度≥99.4%);腺苷(天津中新药业有限公司,批号:W17-0-9,纯度≥98%);芹糖甘草苷(NATURE,批号:120926-46-7,纯度≥98%);野漆树苷(中国食品药品鉴定研究院,批号:111919-201804,纯度≥95.5%)异甘草素(天津中新药业有限公司,批号:W05-1-3,纯度≥98%);甲醇(色谱纯,美国Fisher公司);乙腈(色谱纯,美国Fisher 公司);甲酸(质谱级,东京化学工业有限公司)。
2 方法
2.1 检测条件
2.1.1 色谱条件 色谱柱:Waters Acquity BEH C18(2.1×100 mm,1.7 μm)流动相:0.1%甲酸水(A)-乙腈(B),洗脱梯度(0~3 min,95%~86% A;3~7 min,86%~83% A;7 ~13 min,83%~75% A;13 ~15 min,75%~60% A;15~20 min,60%~20% A;20~22 min,20%~0%A;22.01~25 min,95%~95%A),进样量2 μL,柱温30 ℃,流速0.3 mL/min。
2.1.2 质谱条件 加热电喷雾离子源(HESI),正、负离子模式检测,鞘气流速35 L/min,辅助气流速10 L/min,喷雾电压分别为3.00 kV,毛细管温度320 ℃,辅助器温度350 ℃;扫描模式为Full MS/dd-MS2,扫描范围m/z 100~1500,碰撞能量20/30/40 eV。
2.2 对照品溶液的制备
2.2.1 单一对照品母液的配制 精密称取以下对照品,分别置于10 mL 容量瓶中,加甲醇溶解并稀释至刻度:芸香柚皮苷5.58 mg、辛弗林5.37 mg、橘皮素5.81 mg、新橙皮苷3.02 mg、甘草酸6.14 mg、甘草素6.48 mg、甘草苷5.41 mg、香蜂草苷5.92 mg、圣草次苷5.73 mg、枸橘苷5.44 mg、柚皮苷5.04 mg、腺苷2.15mg。另精密称取橙皮苷8.04 mg、芹糖甘草苷2 mg、野漆树苷5.90 mg 置于25mL 容量瓶中,加甲醇溶解并稀释至刻度。
2.2.2 混合对照品溶液的配制 精密量取芸香柚皮苷、辛弗林、橘皮素、甘草酸、甘草素、甘草苷、香蜂草苷、圣草次苷、枸橘苷、柚皮苷、橙皮苷、野漆树苷对照品母液1 mL,新橙皮苷、腺苷、芹糖甘草苷母液对照品2 mL 置于同一100 mL 容量瓶中,加甲醇定容。
2.3 样品制备
2.3.1 温胆汤干膏粉制备 根据《经典名方开发指引》一书剂量换算,一两折算成3 g,一升折合200 mL。此外,根据处方考证确定温胆汤的制备工艺为称取半夏饮片6 g,枳实饮片6 g,竹茹饮片6 g,陈皮饮片9 g,生姜饮片12 g,甘草饮片3 g,加水1 600 mL,煎煮至约400 mL,200 目纱布过滤,以60 ℃水浴减压浓缩至微黏稠状态,置于-80 ℃冰箱预冻,再置于FDU-2100 冷冻干燥机干燥24 h,干燥后研磨得到温胆汤干膏粉。温胆汤各单味药干膏粉均以此法制备。
2.3.2 供试品溶液制备 精密称定0.25 g 温胆汤干膏粉及各单味药干膏粉分别置于50 mL 具塞锥形瓶中,精密加入25 mL 50%甲醇,以320 W 功率超声处理45 min。取1 mL 上清液加入3 mL 50%甲醇稀释,涡旋1 min。将稀释后的样品以12 000 rpm离心15 min 取上清即可。
2.4 数据处理 根据一级质谱提供的精确的相对分子质量,采用Xcalibar 3.0 软件计算可能的分子式(误差范围±5.0 ppm),将未知化合物的二级碎片离子与对照品、PubChem、Mass Bank、HMDB 以及相关文献报道提供的裂解碎片进行比对,进一步确定未知化合物的分子式及结构,并根据二级质谱碎片推导化合物的质谱裂解途径。
3 结果
3.1 色谱峰鉴定 采用UPLC-Q-Exactive Orbitrap-MS 对供试品溶液进行分析,得到正、负离子模式下的TIC(总离子流图),见图1。通过分析准分子离子峰、碎片离子信息,结合对照品和文献报道以及相关数据库,共鉴别了121 个成分,包括70 个黄酮类成分,18 个香豆素类成分,9 个皂苷类成分,10 个生物碱类成分、3 个苯丙素类成分以及11 个其他类化合物。其中,15 个成分通过与对照品比对后确认。此外,对成分进行了单味药归属。表1 结果见开放科学(资源服务)标识码(OSID)。
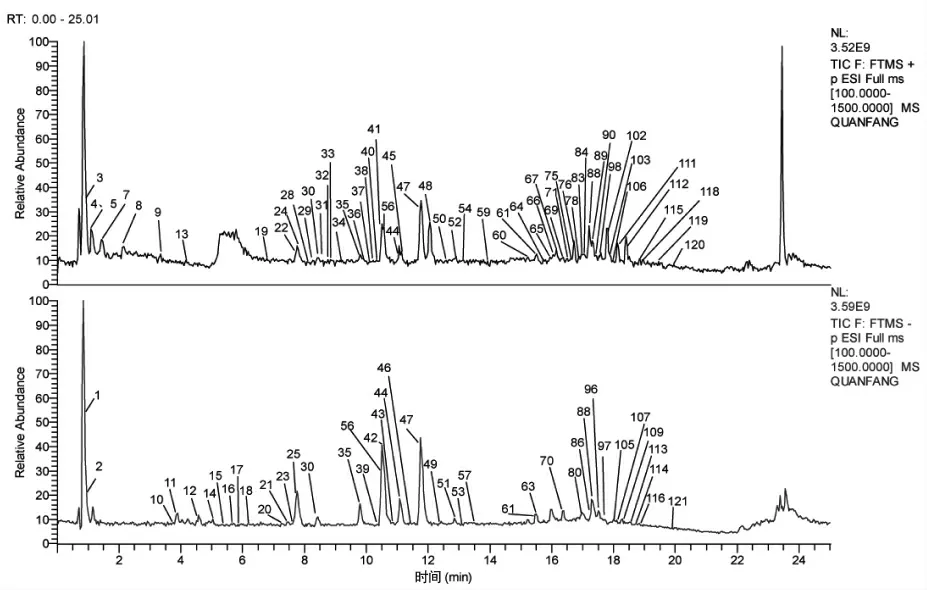
图1 温胆汤的TIC 图
3.2 主要化合物分析鉴定
3.2.1 黄酮类成分 温胆汤的黄酮类成分主要为游离的黄酮和黄酮苷以及少量的黄酮醇、查尔酮,且大部分来源于枳实与陈皮。其中黄酮苷类成分多为双糖苷,多存在同分异构体,如柚皮苷与芸香柚皮苷、橙皮苷与新橙皮苷、枸橘苷与新枸橘苷等。黄酮苷类成分多先裂解糖苷键,脱去糖基变成游离的黄酮。糖基可逐渐脱去,亦可整体脱去。游离的黄酮母核C 环易发生RDA(麦氏重排)裂解从而形成一系列特征性离子碎片。此外带有甲氧基的黄酮可失去甲基,继而再失去羰基。例如44 号峰,在正离子模式下,其准分离子峰的m/z 为611.196 9[M+H]+,误差为-0.240 ppm,推测其分子式为C28H34O15。其准分子离子峰发生中性丢失,丢失1 分子葡萄糖得到m/z 449.1433 1 碎片离子,再丢失1 分子鼠李糖得到m/z 303.086 49 的黄酮苷元,亦可直接从准分子离子峰脱去双糖基得到该离子碎片。该离子碎片带有甲氧基,丢失1 分子甲基,得到m/z 286.047 76 离子碎片,从而发生RAD 裂解,C 环裂解得到m/z 195.028 96 碎片和m/z 153.018 39 碎片。m/z 195.028 96 离子碎片具有邻二酚羟基,可脱去1 分子H2O,得到m/z 177.054 84。该峰特征碎片信息与橙皮苷对照品基本相同,且其保留时间基本一致,故可鉴定该峰为橙皮苷。见图2。
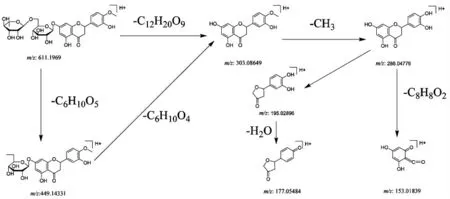
图2 橙皮苷的质谱裂解途径
3.2.2 香豆素类成分 温胆汤的香豆素类成分主要为简单香豆素类与呋喃香豆素类。简单香豆素易失去CO 形成苯骈呋喃离子碎片。此外,若是在6 或7 位碳原子具有甲氧基亦可失去甲基。呋喃香豆素的裂解规律亦是如此。如68 号峰,其准分子离子峰为m/z 193.049 79[M+H],推测其分子式为C10H8O4,误差为0.284 ppm。该准分子离子峰可先丢失1 分子甲基得到m/z 178.026 20 碎片离子,亦可先丢失1分子CO 得到m/z 165.054 76 苯骈呋喃离子,由于环内含氧可继续丢失CO,得到m/z 133.028 63 碎片离子,再丢失1 分子甲基得到m/z 118.034 81 碎片离子。与文献中东莨菪内酯质谱二级碎片信息基本一致,故可鉴定68 号峰为东莨菪内酯,见图3。

图3 东莨菪内酯质谱裂解途径
3.2.3 皂苷类成分 温胆汤的皂苷类成分,大多来源于甘草。以88 号峰为例阐述皂苷类成分结构鉴定过程。在正离子模式下,该化合物的准分子离子峰m/z 823.410 30[M+H]+,推测出分子式为C42H62O16,误差为-0.950 ppm。该化合物依次脱去1 分子葡萄糖先后得到m/z 647.379 46 碎片离子与m/z 471.346 86 苷元离子,该碎片脱去1 分子H2O,得到m/z 453.336 64 碎片离子,再进行RDA 裂解,得到m/z 261.112 34 碎片离子。此外通过与甘草酸对照品比对,该峰鉴定为甘草酸,见图4。
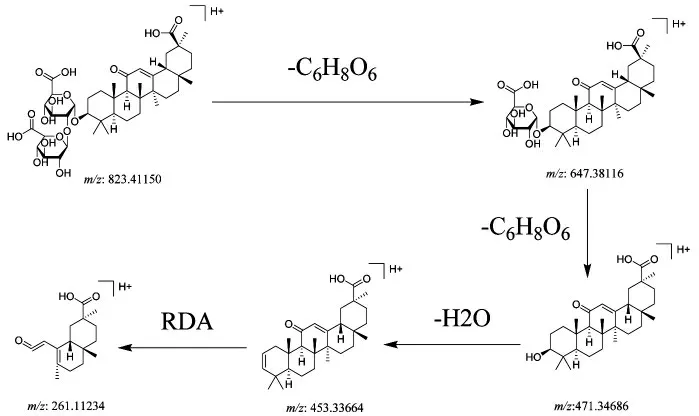
图4 甘草酸的质谱裂解途径
3.2.4 生物碱类成分 温胆汤的生物碱类成分主要来源于枳实与陈皮。鉴于枳实和陈皮中均含有辛弗林,且辛弗林为枳实的质量控制成分,因此以辛弗林为例解析其裂解规律。在正离子模式下,生物碱类成分响应较高,其准分子离子峰为m/z 168.102 10[M+H]+,脱去1 分子H2O 得到m/z 150.091 54 碎片离子,该碎片为仲胺离子可丢失1 分子甲基或丢失1 分子C2H5N,得到m/z 135.068 10 碎片离子和m/z 107.049 58 碎片离子。m/z 135.068 10 碎片亦可发生双键断裂丢失1 分子C=NH2得到m/z 107.049 58 碎片离子。该碎片脱去1 分子H2O 发生β 裂解,经重排生成稳定的卓鎓离子m/z 91.054 80。此外m/z135.068 10 碎片也可丢去1 分子NH3得到m/z 119.049 42 碎片离子,见图5。
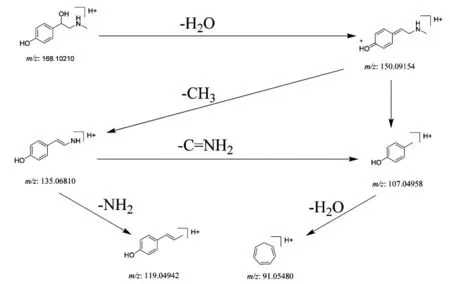
图5 辛弗林的质谱裂解途径
4 讨论
实验前期采用不同的梯度洗脱条件,考察了不同比例的甲酸水以及不同有机相的分离效果,发现在现用的洗脱梯度下,0.1%甲酸水-乙腈作为流动相具有较好的峰形和分离度。
实验结果表明温胆汤主要成分为黄酮成分,其次是香豆素类成分、皂苷类成分以及生物碱。这些成分主要来源于枳实、陈皮与甘草。而半夏、生姜、竹茹鉴定出的成分较少。一则可能是药物煎煮时间过长,导致相关成分发生降解。例如2020 版《中国药典》规定的生姜含量测定成分6-姜辣素、8-姜酚、10-姜酚均未在温胆汤中检出,但能检测出6-姜烯酚。有文献报道长时间的加热,6-姜辣素会转化为6-姜烯酚[36]。二则存在一些未鉴定出的化合物,还有待以后深入研究。
本实验利用UPLC-Q-Exactive Orbitrap-MS 技术对温胆汤进行快速分析。根据化合物的精确相对分子质量、二级碎片峰信息,通过参考相关文献、成分质谱裂解规律以及与对照品比对,鉴定出温胆汤中121 个成分,为温胆汤药效物质基础深入研究、阐明其作用机制、质量控制奠定基础。然而,本实验仍有不足之处,生姜、半夏、竹茹鉴定出的成分较少,且黄酮类成分占比居多。此外,鉴定出的化合物存在同分异构体形式,仅部分通过对照品确认,需进一步借助核磁技术进行鉴别和确认。

