基于两点一线为解剖标志的胃底体一体化游离方式在腹腔镜胃袖状切除术中的临床应用
屈兵 李盛波 彭志洋 罗建飞
腹腔镜胃袖状切除术(laparoscopy sleeve gastrectomy,LSG)是中、重度肥胖症的标准减重术式之一,近年来国内减重代谢手术LSG比例超90%[1]。LSG围术期出血、胃食管反流(GERD)、胃漏等并发症受到众多关注,文献认为此类并发症均与术中胃底部游离不完全、胃壁张力吻合等密切相关[2]。减重手术指南虽明确指出LSG胃底部完全游离的手术要求,但对完全游离的操作方式、左侧膈肌脚的显露标准以及胃无张力切割闭合的解剖学标志等尚无具体阐述[3]。基于实体解剖标志、定义明确的手术操作模型能确定可重复的LSG解剖学标准,从而解决手术标准不一致的问题。我们采用基于膜解剖指导下的TJ点(tri-junction Point)至左侧膈肌脚内侧缘顶点“两点一线”为解剖标志[2,4],采用胃底体一体化游离方式(two points and one line model,TPOL模型)LSG术治疗的肥胖症或肥胖合并代谢综合征病人135例。现报道如下。
对象与方法
一、对象
2019年1月~2022年1月我院肥胖病或肥胖合并代谢综合征病人135例,均行LSG治疗。纳入标准:符合《中国肥胖及2型糖尿病外科治疗指南(2019版)》规定手术适应证,年龄18~65岁。排除标准:有腹腔镜手术禁忌证;严重精神疾病;无法耐受麻醉;修正手术或腹腔镜胃旁路术。按照随机数字表法将病人分为TPOL模型组(研究组)和常规手术组(对照组)。研究组68 例,男23例,女45例,年龄(28.76±5.56)岁;体质指数(Body mass index,BMI)(33.84±5.62)kg/m2;合并脂肪肝61例,2型糖尿病17例,多囊卵巢综合征12例。对照组67例,男25例,女42例,年龄(30.16±3.38)岁;BMI(34.26±4.64)kg/m2;合并脂肪肝62例,2型糖尿病19例,多囊卵巢综合征10例。两组一般资料比较,见表1。本研究已获我院伦理委员会批准(20190710)。
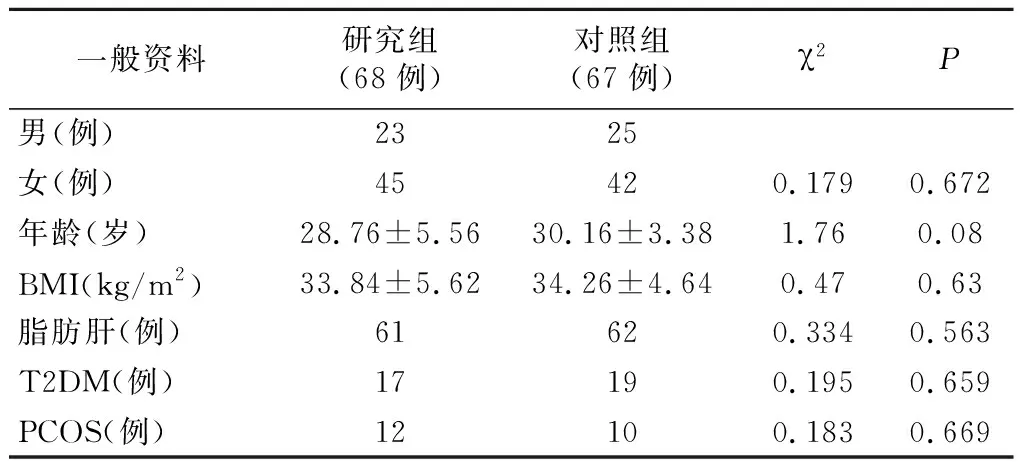
表1 两组一般资料比较
二、方法
1.手术方法:两种手术方式均由同一主刀者完成。全身麻醉,平卧位,主刀位于病人两腿之间,第一助手站立于病人左侧,扶镜手站立于病人右侧。(1)研究组:以TJ点为起点,分离胃左系膜与胃后系膜系膜床,以左侧膈肌脚内侧缘顶点为终点,连接“两点一线”斜向建立通道,沿通道充分暴露胃后血管(GPA)、胃短血管并离断,完整游离胃底体部。以两点一线为固定支点,将胃底体部扇形展开,采用切割闭合器行常规袖状胃无张力切除闭合。见图1。其余手术步骤同文献描述。(2)对照组:用超声刀于胃大弯中部紧贴胃壁游离切开胃结肠韧带,向上分离离断胃脾韧带,至胃食管结合部,紧贴胃后壁分离胃后系膜至左侧膈肌脚,显露出左侧食管裂孔,完全暴露His角,其余步骤同前。

A.显露TJ点;B.游离胃后间隙通道显露左侧膈肌脚;C.系膜根部结扎胃后血管及胃短血管;D.TJ点至左侧膈肌脚内侧缘顶点两点一线(TPOL)
2.观察指标:记录两组病人手术时间、胃底游离时间(TJ点为胃底游离起始时间,至左侧膈肌脚内侧缘顶点为胃底游离结束时间)、术中出血量、术中脾脏上极副损伤的发生例数、住院时间等指标。随访12~36个月,观察术后胃漏、出血、胃食管反流(GERD)发生率。GERD通过GERDQ量表进行诊断(>9分为阳性)。
三、统计学方法
结果
两组病人术中、术后临床指标比较见表2。所有病人均顺利完成LSG手术,术后随访12~36个月。研究组与对照组手术时间分别为(56.13±10.56)分钟和(62.45±12.74)分钟,胃底游离时间分别为(6.34±4.16)分钟和(12.58±6.37)分钟,住院时间分别为(3.84±0.42)天和(4.06±0.69)天,术中出血量分别为(10.87±1.28)ml和(15.56±3.39)ml,术后GERD发生率分别为7.35%(5例)和19.40%(13例),两组比较差异有统计学意义(P<0.05)。两组术后12个月多余体重减少以及术后出血、胃漏等并发症比较,差异无统计学意义(P>0.05)。

表2 术中、术后临床指标比较
讨论
LSG是国际国内指南重点推荐的常规术式,是目前临床上最常用的减重代谢手术方式之一,但LSG胃底完全游离方式、左侧膈肌脚的显露标准以及如何达到胃壁无张力吻合的解剖标志尚无具体阐述。而由于没有标准化的手术技术,导致手术标准、手术结果不一致,尤其肥胖病人腹腔空间相对狭小,术野暴露和胃底游离困难,容易导致脾上极撕裂和胃底游离不充分甚至胃壁损伤,出现多种并发症,如GERD(6.67%~22%)、胃漏(0.7%~7.0%)、出血(1.2%)等[5-7]。
胃袖状切除术后胃食管反流与术后操作过程中胃食管交界处解剖后食管下段括约肌受损、胃底内壁切除不完全,含产酸壁细胞的残余胃底发生胸腔内移位有关。胃袖状切除术后胃漏90%发生在靠近His角的胃食管交界处[8],可能是因为此处胃壁较薄,术中胃底部机械损伤及组织缺血,而术后狭窄与胃底游离不完全及胃壁存在张力吻合相关。过度的牵拉胃底或胃脾韧带可以扩大暴露术野,但增加胃底后方系膜和脾脏撕裂出血污染视野,导致手术困难,甚至中转开腹。
众多学者对于LSG胃底的规范化完整游离提出了思考。李世红等[9]提出了LSG改良三步法游离胃底能减少脾脏损伤、缩短手术时间,不增加并发症的风险,其在胃后壁操作主要是游离胃胰皱襞,但对具体操作方式未做详细阐述,且胃胰皱襞作为胃后与胰腺表面的连接,文献报道出现率约为20.4%~73.1%[2]。吴立胜等[10]提出,自贲门左侧胃后壁优先分离切开胃胰韧带和部分胃膈韧带,充分暴露胃短血管后离断,再用切割闭合器行常规袖状胃切除,其主要是从分离顺序的角度探讨胃底游离。
董志勇等[11]则提出了膜解剖理念在LSG中的应用,尤其在胃底及后壁游离时要求沿胃后壁脏层腹膜与胰腺被膜膜性结构分离,强调了向上向后的操作平面勿过深,但未明确游离起止点的解剖学标志。
Frosio等[2]结合120例的尸体标本解剖,提出保留胃窦后韧带(GAPL),解剖胃胰韧带、结扎胃后动脉(PGA)(出现率69.4%),暴露左膈肌脚右侧缘以及确保切割线的线性度等4个基于实体解剖标志的可重复的LSG解剖学标准,将LSG的规范化、标准化向前推进一大步。
龚建平教授团队[4,12-13]经过对膜解剖中胃系膜的实证研究及系膜切除完整度研究发现,腹中膜背侧近端分割揭示了腹腔镜手术的新解剖意义,验证了胃背侧系膜近侧段[14](proximal segment of dorsal mesogastrium,PSDM)的存在(包绕着胃及其指向后腹壁的腹腔干及其分支血管)、形态(桌子模型,table model)和悬挂于腹后壁的信封样结构。其中,PSDM三要素主要包括包绕部(胃)、连接部(血管)与悬挂点(腹后壁)。
PSDM模型由胃左系膜、胃后系膜、胃短系膜、胃网膜左系膜、胃右系膜和胃网膜右系膜等6个系膜构成。相当于6个“信封”样包绕的独立腔隙,腔隙的“出口”则位于血管根部。被脏层腹膜所覆盖的信封样系膜两两相贴互为系膜床,而在三三交汇(tri junction)处,膜桥的交点即为TJ点。TJ点的解剖特征普遍存在,代表着覆盖在系膜表面的浆膜程度不一的融合,在其下面即是疏松的融合间隙。因此,TJ点成为进入恰当间隙、扩大平面和稳定入路的解剖学标志。
在LSG术中,当切开胃左系膜、胃后系膜及胰腺系膜表面膜桥上TJ点处浆膜时,通过超声刀切割后的“空洞化”效应[15],可使膜桥浮起,展开膜间隙,就像撕信封一样在边界切开系膜,并利用腔镜的放大效应,可以清晰观察到PSDM模型中的胃左、胃后、胃短等系膜及其融合于系膜床的形态,可看到“天使的发丝”的组织解剖学基础。因此,我们将该TJ点作为LSG胃底及胃后壁一体化游离的起点。
三三交汇的系膜互为膜床,形成间隙通道。沿着该胃背侧系膜操作区间隙通道向上延续即至膈肌脚,通道底部为左侧膈肌脚表面,向前延续可贯通至左侧膈肌脚内侧缘顶点。此时通道左侧由胃后系膜延续为胃短系膜右侧缘,分别于胃后系膜及胃短系膜根部出口处剖扎胃后血管及胃短血管。至此,胃底、胃后壁体部一体化游离完成。牵拉游离后的胃底体部(即PSDM包绕部),可将其扇形自由展开,下缘为PSDM悬挂点,亦即TJ点至左侧膈肌脚内侧缘顶点连线,遂分别作为TPOL模型胃底体一体化游离的起点与终点。
TPOL模型是膜解剖理论中PSDM模型的延伸,TPOL位于系膜根部,是系膜及系膜床相互融合的边缘,也是PSDM包绕部的悬挂点,解剖结构可以反复重现。以TPOL模型为标准进行分离,是沿着各系膜边缘进行分离,也是沿集束化的系膜轮廓进行剥离,其表面覆盖着自胃表面浆膜延续而来、退化不完全的浆膜,可以与网膜、后腹壁、各系膜床实现无血分离。
对于TPOL模型LSG,我们有以下心得体会:(1)TJ点作为胃背侧系膜近侧端系膜间的分界点,可以高效的将胃左系膜、胃后系膜、胰腺系膜完整分开,清晰显露胃后间隙,该间隙为疏松结缔组织,易于分离,可迅速显露左侧膈肌脚,直达内侧缘顶点,形成解剖学恒定通道,可重复性高,简单易学,易于形成操作标准化推广。(2)经TPOL模型一体化游离胃底体部,游离通道为疏松结缔组织,可稳定实现无血分离,保护左侧膈肌脚表面肌筋膜,并有效缩短手术时间(P<0.05)。通道建立后,可在直视下显露GPA、胃短血管及脾上极内侧缘,避免过度牵拉致术野撕裂出血,术者于胃后系膜及胃短系膜根部剖扎GPA、胃短血管,安全程度高,术中出血量均明显减少。(3)经TPOL模型完成胃底体部一体化游离后,以TPOL作为固定支点,可将整个胃底体部扇形自由展开,有效达到胃袖状无张力切除与闭合,避免胃扭转及狭窄,减少术后并发症。这也是研究组病人术后GERD明显减少的原因。
TJ点至左侧膈肌脚内侧缘顶点两点一线作为TPOL模型胃底体一体化游离的起点与终点,可将胃底体部完整游离,有望作为LSG胃底及胃后壁游离的解剖学标志。
综上,基于膜解剖指导下的TPOL模型LSG可高效、安全、完整游离胃底,达到无张力切割闭合,再次证实使用基于实体可重复的解剖标志的定义明确的手术技术,重现性更好,有利于提高手术安全性。另外,其使得LSG的胃底游离操作标准化,术者在LSG手术中能做到有章可循、心中有数,更容易使LSG手术操作规范化、同质化和规模化。
当然,TPOL模型仍处于初步阶段,其内涵与外延有待进一步完善。

