不同产地茯砖茶的品质、抗氧化性比较及“金花”菌形态特征分析
马荣蓉,冉莉莎,屈丽池,谢念祠,丁梦梅,朱洺志,3,4, ,王坤波,3,4,5,
(1.湖南农业大学园艺学院茶学教育部重点实验室,湖南长沙 410128;2.国家植物功能成分利用工程技术研究中心,湖南长沙 410128;3.植物功能成分利用省部共建协同创新中心,湖南长沙 410128;4.农业农村部园艺作物基因资源评价利用重点实验室,湖南长沙 410128;5.湖南农业大学黄埔创新研究院,湖南长沙 410128)
茯砖茶作为后发酵黑茶的代表,具有降脂减肥、降血糖、缓解代谢综合征等功效[1-3],同时因其在发酵过程中会产生大量金黄色的“金花”菌而闻名,主要以黑毛茶为原料经筛选、渥堆、气蒸、压制成型、发花、干燥和陈化等工序加工制作而成。茯砖茶品质特征形成的关键在于“发花”,其实质是在适宜的温度、湿度下,以冠突散囊菌为主的多菌群协同作用的固态发酵过程[4-5]。微生物的发酵作用不仅赋予了茯砖茶金花茂盛、菌香浓郁的特征,而且使得其内含活性成分发生了明显的变化[6]。
“发花”是茯砖茶加工过程中微生物作用最活跃的阶段,此过程改变了茯砖中茶多酚及儿茶素、黄酮和氨基酸等主要代谢物的组成,促进了茯砖茶滋味和汤色的形成[7]。已有研究证明真菌群落在茯砖茶代谢产物的形成中具有潜在作用,不同产地的茯砖茶其真菌群落的多样性和丰富度存在差异[8]。目前对茯砖茶中“金花”菌的分离鉴定技术已较为成熟,大多数学者将其鉴定为冠突散囊菌[5,9-10],也有学者将泾阳茯茶中的“金花”菌鉴定为赤散囊菌[11],不同茯砖茶中的“金花”菌在种属水平上存在差异。彭晓赟等[12]对分离自茯砖茶的冠突散囊菌进行发酵培养,揭示了冠突散囊菌的次级代谢产物具有多种生物活性,赋予了茯砖茶抗菌、抗氧化等生理功能。“金花”菌作为茯砖茶发酵过程中的优势微生物,人们往往通过判断其质量和数量来衡量茯砖茶品质的优劣。不同地区生产的茯砖茶因生产过程中所使用的原料和加工条件的不同对其微生物组成以及化学成分有所影响,可能导致不同地区茯砖茶的品质特征的形成。
因此,比较分析不同地区茯砖茶的主要化学成分,利用电子舌系统检测5 种茯砖茶的滋味属性,用不同方法检测其抗氧化活性,观察对比不同地区茯砖茶的“金花”菌形态特征,对了解不同产地茯砖茶品质及功能等方面的差异性,以及后续研究茯砖茶具有重要意义。
1 材料与方法
1.1 材料与仪器
茯砖茶 湖南省益阳茶厂、湖北省力沃茶业股份有限公司、陕西省泾渭茯茶有限公司、浙江省武义骆驼九龙砖茶有限公司和贵州省过江龙生态黑茶有限公司;没食子酸、咖啡碱、可可碱、茶叶碱、表儿茶素(EC)、表儿茶素没食子酸酯(ECG)、表没食子儿茶素(EGC)、表没食子儿茶素没食子酸酯(EGCG)、没食子儿茶素没食子酸酯(GCG)等标准品 纯度≥99%,美国Sigma 公司;总抗氧化力(FRAP 法)、(DPPH 法)、(ABTS 法)试剂盒 苏州科铭生物技术有限公司;麦芽膏、酵母膏、葡萄糖、琼脂、蛋白胨、氯化钾、硝酸钠、磷酸氢二钾、七水硫酸镁、七水硫酸亚铁等 纯度≥99%,国药集团化学试剂有限公司。
Scope.A1 显微镜 德国卡尔·蔡司股份有限公司;UV-2550 紫外分光光度计 日本岛津公司;SA 402B 电子舌(配备AAE,CTO,CAO,COO,AE1 传感器)日本Insent 公司;Waters 高效液相色谱仪e2695-2998 沃特世科技(上海)有限公司;VARIOSKAN FLASH 多功能酶标仪 美国Thermo Scientific 公司;YS6003 色差仪 深圳三时恩公司;SWCJ-2FD 超净工作台 苏州安泰空气技术有限公司;GR85DA 高压灭菌锅 致微(厦门)仪器有限公司。
1.2 实验方法
1.2.1 茶汤色差检测 参照GB/T 23776-2018,茶叶感官审评方法[13]冲泡茶汤,趁热过滤并迅速冷却,对茶汤进行拍照;以蒸馏水为对照,用色差仪对茶汤进行色差检测[14]。
1.2.2 主要品质成分测定 游离氨基酸参照GB/T 8314-2013,茶游离氨基酸总量的测定[15]、水浸出物参照GB/T 8305-2013,茶水浸出物测定[16],茶多酚参照GB/T 8313-2018,茶叶中茶多酚和儿茶素类含量的检测方法[17]进行测定,并用UV-2550 紫外分光光度计进行吸光度检测。游离氨基酸准曲线y=3.915x+0.0234,R2=0.9962,茶多酚标准曲线:y=0.01x+0.0222,R²=0.9993。黄酮类化合物总量的测定采用三氯化铝比色法[18],称取3 g(准确至0.001 g)磨碎试样于500 mL 锥形瓶中,加沸蒸馏水450 ml,立即移入沸水浴中,浸提45 min(每隔10 min 摇动一次),浸提完毕后立即趁热减压过滤,残渣用少量热蒸馏水洗涤2~3 次。将滤液转入500 mL 容量瓶中,冷却后用水定容至刻度,摇匀作为供试样液。
1.2.3 儿茶素组分及生物碱检测方法 采用本实验室的高效液相色谱法进行检测,参照GB/T 8314-2013,茶游离氨基酸总量的测定[15]进行样品提取,色谱条件:色谱柱为C18(4.6 mm×150 mm),检测波长278 nm,进样量10 μL,柱温35 ℃,流速1.0 mL·min-1。流动相A 为超纯水,B 相为N,N-二甲基甲酰胺、甲醇和冰乙酸以39.5:2:1.5 为比例的混合液;B 相以9%的初始比例进行梯度洗脱,10 min 内上升至14%,27 min 内至36%并持续4 min,32 min 下降至9%并持续到37 min 结束。
1.2.4 电子舌检测茶叶的滋味属性 参照1.2.1 方法进行茶汤处理,进行传感器的活化和系统自检,室温维持在20 ℃进行检测,味觉传感器和陶瓷参比电极共清洗210 s,平衡30 s 后开始样品测试,每个样品测量30 s,回味测量30 s。每个样测试4 次平行,取后三次的平均值作为测试结果进行分析。
1.2.5 抗氧化活性测定 参照1.2.2 提取试液,采用苏州科铭生物技术有限公司DPPH、ABTS 及FRAP检测试剂盒对样品DPPH 自由基清除能力、ABTS+自由基清除能力及FRAP 抗氧化力进行检测。正式检测之前将试液稀释为干茶浸出物6、3、1.5、1.2 mg/mL 进行预实验,当浓度为1.2 mg/mL 时ABTS、FRAP 试剂盒检测效果最好,1.5 mg/mL 时DPPH 试剂盒检测效果最好,每个指标按照最佳浓度稀释试液后严格按照试剂盒方法进行,使用酶标仪分别在波长515 nm(DPPH)、734 nm(ABTS)、593 nm(FRAP)处检测各样品吸光值。样品清除DPPH 自由基能力、ABTS+自由基能力以及总抗氧化能力用从标准曲线上获得的抗氧化剂的量(µmol Trolox/mL)来表示。相关标准曲线如下:
式中,y 表示吸光差值ΔA;x 表示Trolox 浓度(µmol/mL)。
1.2.6 “金花”菌形态观察 “金花”菌的形态观察参照王磊等[19]的方法进行。参照赵仁亮等[4]、Visagie等[20]的方法配制察氏培养基(CZ)、察氏酵母琼脂培养基(CYA)、察氏酵母膏琼脂改良培养基(CYAS)、麦芽汁琼脂培养基(MEA)、麦芽汁酵母琼脂培养基(M40Y)。将分离自不同产地茯砖茶的菌株分别接种于上述5 种培养基于28 ℃培养7 d,记录菌落特征并拍照,挑取CZ 培养基上少量菌落用乳酸酚棉蓝染液对5 个菌株孢子进行染色,在光学显微镜下观察其形态结构及生长状况。
1.3 数据处理
采用Microsoft Office Excel 2016 进行记录整理,实验重复3 次,结果使用平均值±标准差的形式表示。IBM SPSS Statistics 25.0 软件对数据进行差异显著性分析,P<0.05 表示显著性差异,GraphPad Prism 8、Cytoscape 进行图形绘制。
2 结果与分析
2.1 茶叶色泽分析
由表1 和图1 可知,5 个茯砖茶色泽存在明显差异,湖南茯砖干茶色泽青褐,金花茂盛,茶汤橙黄尚亮;湖北茯砖黄褐带金花,浅橙红尚亮;陕西茯砖棕褐带金花,橙黄明亮;浙江茯砖棕褐带金花,橙红尚亮;贵州茯砖棕褐带金花,茶汤红橙明亮。对茶汤进行色差检测发现其色差值存在显著差异(P<0.05),其中湖南茯砖亮度最高(86.60),浙江茯砖红度和黄度最高分别为(8.52、57.73)。茶汤颜色的不同主要是由于茶叶中茶黄素、茶红素和茶褐素的含量存在差异,黄亚辉等[21]的研究表明,茯砖茶中的茶黄素含量均偏低,而茶褐素作为茶黄素和茶红素的氧化产物在茯砖茶中偏高,茶褐素是茶汤颜色“乌褐”的主要成分,浙江茯砖较深可能是由于其茶褐素较高的原因。在茯砖茶加工过程中,由于“金花”菌本身具备合成色素的能力,因此茯砖茶的汤色差异还可能受到微生物的影响。

图1 不同产地茯砖茶茶汤及干茶Fig.1 Soup and shape of Fu brick tea in different origins

表1 不同茯砖茶样品茶汤色差结果Table 1 Results of color difference in tea broth of different Fu brick tea samples
2.2 不同产地茯砖茶品质成分分析
水浸出物、游离氨基酸、茶多酚、黄酮等成分是茶叶滋味的主要贡献物。由图2 可知,湖北茯砖水浸出物含量显著低于其他地区茯砖茶,水浸出物是一切可溶性物质的总和,其含量的高低对茶叶品质的优劣有重要作用。5 个茯砖茶游离氨基酸含量均在10 mg/g 以内,贵州茯砖含量最高(9.03 mg/g)。游离氨基酸是茶叶中鲜味的主要来源,但由于茯砖茶选用原料本身较粗老,其游离氨基酸含量较低。在茯砖茶渥堆过程中,由于湿热作用的影响,发生脱氨、脱羧等反应进一步转化为香气等成分[22],在发花过程中,微生物又将氨基酸类物质作为氮源以维持自身生长繁殖,而导致其含量进一步降低[7]。茶多酚包括儿茶素、花青素、黄酮等化合物,其含量与原料有关,在茯砖茶加工过程中也受到湿热作用和微生物作用的影响。5 个茯砖茶样品茶多酚含量存在显著差异(P<0.05),其中湖北茯砖含量最低(90.8 mg/g),浙江茯砖最高(132.93 mg/g)。黄酮类化合物是茶叶中重要的功能成分,但在自然状态下不稳定,茶叶加工和储藏过程中容易发生转化,因此在茶叶中含量较低[23],5 个不同产地茯砖茶黄酮含量均低于9 mg/g。
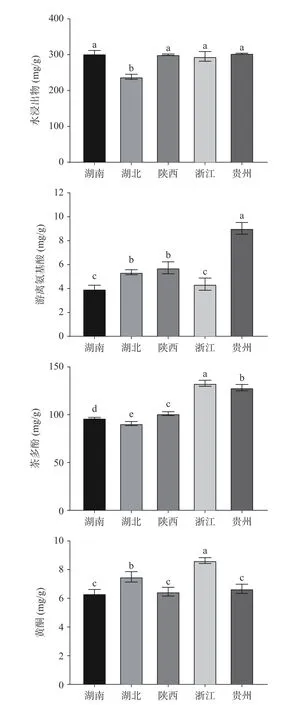
图2 不同产地茯砖茶主要品质成分含量Fig.2 Contents of main quality components of Fu brick tea in different origins
茶叶中的生物碱主要有咖啡碱、可可碱和茶叶碱。可可碱和茶叶碱呈苦味,含量较低,互为同分异构体。咖啡碱呈苦味,可以和儿茶素、氨基酸等络合,使茶汤具有苦后回甘的特色[24]。因其本身较为稳定,所以在茯砖茶加工过程中含量变化不大。从表2可知湖南茯砖咖啡碱含量最高(31.513 mg/g),湖北茯砖最低(14.52 mg/g),导致这一差异可能是由于原料的不同。没食子酸属酚酸类物质,其形成是由于茯砖茶发酵早期的湿热作用[25],没食子酸儿茶素在湿热作用下通过水解逐渐分解,然后产生相应的非没食子酸儿茶素和没食子酸[26],而EGCG 是没食子酸生物合成的主要途径[27]。湖南茯砖、浙江茯砖及贵州茯砖之间没食子酸含量存在显著差异(P<0.05),可能是由于加工过程中不同的水分和温度条件导致。儿茶素作为茶多酚的主要组成部分,可分为简单儿茶素(DL-C、EC、EGC)和酯型儿茶素(ECG、EGCG、GCG)[28]。酯型儿茶素是强苦味和涩味的重要供体,简单儿茶素则收敛性较弱[29-30]。湖南、湖北茯砖儿茶素总量较低,陕西、浙江、贵州茯砖含量较高;浙江茯砖含有更多的简单儿茶素,陕西茯砖含有更多的酯型儿茶素。有研究表明渥堆及发花程度的不同都会造成茯砖茶儿茶素不同程度的降低[31]。因此,不同产地茯砖茶中儿茶素的差异一方面可能是由于发花过程中大量微生物的繁殖,释放胞外酶使儿茶素各组分进行酶促氧化而大幅下降;另一方也可能是由于原料的不同导致。
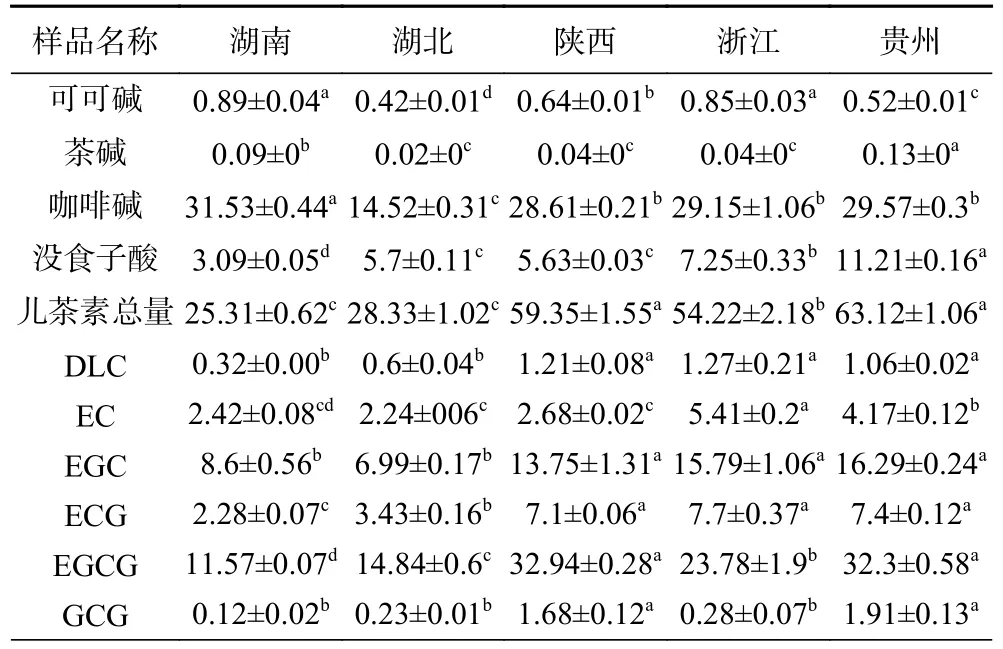
表2 不同产地茯砖茶儿茶素组分及咖啡碱含量(mg/g)Table 2 Content of catechin fraction and caffeine in Fu brick tea from different origin (mg/g)
2.3 不同地区茯砖茶滋味特征分析
通过电子舌研究了茯砖茶的滋味属性,由雷达图(图3a)可知,湖南茯砖茶具有最强的苦味,但其苦味回味值低于浙江茯砖茶。浙江茯砖茶具有最强的咸味,陕西茯砖茶具有最强的涩味,其涩味回味值也较高;贵州茯砖茶具有最强的鲜味和丰富度。从聚类分析图(图3b)来看,茯砖茶样品的滋味属性被分为三组:湖南-湖北、贵州、陕西-浙江;这表明湖南和湖北茯砖茶的聚类表现出相似的滋味特征,陕西和浙江茯砖茶的聚类表现出相似的滋味特征。

图3 不同地区茯砖茶滋味特征及聚类分析Fig.3 Taste characteristics and clustering analysis of Fu brick tea from different origins
2.4 不同地区茯砖茶抗氧化活性分析
不同地区的茯砖茶有不同的抗氧化活性,采用三种不同的方法来评估5 个不同地区茯砖茶的抗氧化活性见图4。结果显示,5 种茯砖茶样的DPPH 自由基清除率无显著差异;湖北茯砖与其余4 个地区茯砖之间FRAP 总抗氧化能力存在显著差异(P<0.05);湖北茯砖和浙江茯砖之间ABTS+自由基清除能力存在显著差异(P<0.05)。其中,湖北茯砖茶的FRAP 总抗氧化活性最高(0.18 µmol Trolox/mL),湖南、浙江茯砖茶最低(0.12 µmol Trolox/mL)。浙江茯砖茶的ABTS+抗氧化活性最高(0.4 µmol Trolox/mL),湖北茯砖茶最低(0.31 µmol Trolox/mL)。

图4 不同地区茯砖茶DPPH、FRAP、ABTS抗氧化活性比较Fig.4 Comparison of the antioxidant activity DPPH,FRAP and ABTS of Fu brick tea from different origins
2.5 不同地区茯砖茶主要化学成分与抗氧化活性及滋味特征的关系
对不同地区茯砖茶主要化学成分、滋味特征与抗氧化活性进行相关性分析,以探究其相互之间的内在联系。抗氧化能力的差异是基于不同茯砖茶中多酚类物质的存在,如茶多酚、类黄酮、儿茶素等[32],由图5 可知,FRAP 与咖啡碱、可可碱、水浸出物含量呈显著负相关(P<0.05);而ABTS 抗氧化活性与茶多酚、EC、EGC 等含量存在显著正相关(P<0.05),但DPPH 抗氧化活性意外地与这些化学成分不存在显著相关性。有研究报道,茯砖茶的抗氧化活性,还应考虑没食子酸、儿茶素和茶色素的特性,它们可以协同或拮抗[8]。因此茯砖茶中关键的抗氧化因子及其相互关系还有待进一步的研究。

图5 茯砖茶主要生化成分与其抗氧化性及滋味特征相关性分析Fig.5 Correlation analysis of the main biochemical components with their antioxidant properties and taste characteristics of Fu brick tea
水浸出物、游离氨基酸、茶多酚等成分是茶叶滋味的主要贡献物,相关性分析也显示各化学成分与滋味属性存在不同的相关性。苦味与氨基酸、没食子酸、GCG 含量呈显著负相关(P<0.05),与可可碱呈显著正相关(P<0.05);涩味则与儿茶素类物质以及茶多酚、咖啡碱、水浸出物等呈显著正相关(P<0.05);除可可碱以外,其余物质大多与鲜味和丰富度存在显著正相关性(P<0.05);没食子酸、茶多酚与儿茶素类物质与咸味存在显著正相关性(P<0.05)。
2.6 不同培养基上菌落形态特征
对5 个产地茯砖茶分离的5 株“金花菌”在不同培养基的形态特征进行观察(图6)。5 个菌株形态差异变化受培养基影响较大,主要体现在菌株生长速度及颜色,菌株在CYAS 和M40Y 培养基上生长快,菌株直径分别为35~42 mm、48~56 mm,菌落致密,菌丝较厚且闭囊壳大量,干燥粗糙;在MEA 培养基上生长速度次之,菌落致密,颜色呈现中央橙黄色,边缘黄色特征;在CYA 上生长速度较慢,菌落呈现中央黑褐色或褐色,边缘黄色或淡黄色;在CZ 培养基上,菌株生长缓慢,闭囊壳少量,有色素扩散至培养基,形态差异较小。仅湖南、陕西菌株在CYA 上有渗出液,其它菌株在5 种培养基上均无渗出液。

图6 不同产地茯砖茶中分离的“金花”菌在不同培养基上的形态特征Fig.6 Morphological characteristics on different media of"golden flower" fungi bacteria isolated from Fu brick tea of different origins
5 株“金花”菌在同培养基上差异相对较小,在CYA 上,湖南和陕西菌株颜色较深,中央黑褐色边缘淡黄色,其它菌株颜色较浅;湖南菌株在CYAS 及M40Y 生长速度快于其它菌株,湖北菌株在M40Y上呈黄色云朵状(图6b4)。
2.7 光学显微镜下金花菌结构特征
在显微镜下,“金花”菌的有性结构子囊果呈球形或近球形,子囊果在生长后期破裂形成子囊,子囊成熟后释放子囊孢子[10]。如图7 所示,5 株“金花”菌均发现子囊孢子和子囊,其子囊呈球形或近球形,直径117~156 μm(图7a~图7e)。陕西、浙江、贵州菌株均发现有性结构子囊果,直径分别为270、543、395 μm,并且存在多核有隔菌丝(图7j~图7l),但在湖南菌株中并未发现子囊果,湖北菌株中发现已破裂的子囊果(图7f)。湖北、陕西、浙江、贵州菌株均发现代表有性结构的子囊果破裂产生子囊孢子团(图7f~图7i)。由此可见湖南菌株生长速度快于其他菌株,子囊果完全破裂释放子囊,并且子囊开始释放子囊孢子;其次是湖北菌株,并未发现完整的子囊果,而只有正在破裂释放子囊的子囊果。陕西、浙江、贵州菌株生长速度较慢。
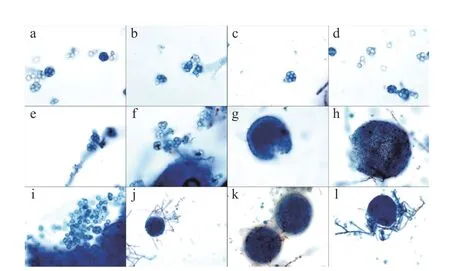
图7 显微镜下菌株的结构特征Fig.7 Structural features of the fungal under the microscope
3 结论
本研究中5 个不同产地茯砖茶的游离氨基酸、茶多酚、黄酮、儿茶素、咖啡碱含量存在显著差异(P<0.05)且滋味差异大。相关性分析显示,茯砖茶的主要化学成分与滋味属性显著正相关。抗氧化活性显示湖北茯砖与其余4 个地区茯砖茶的FRAP 抗氧化活性存在显著差异(P<0.05),湖北茯砖与浙江茯砖之间ABTS+抗氧化活性存在显著差异(P<0.05)。茶多酚与茯砖茶的抗氧化活性存在显著正相关(P<0.05)。分离不同产地茯砖茶中的“金花”菌发现它们的形态结构在察氏酵母琼脂培养基上存在明显差异,并且湖南菌株生长速度快于其他菌株,从干茶来看其金花也最为茂盛。
后续实验可将不同的“金花”菌接种于相同原料的黑毛茶进行“发花”,或将同一株“金花”菌接种于不同原料的黑毛茶进行“发花”,探究其品质差异。进一步揭示原料和微生物对茯砖茶品质的影响,为茯砖茶的深入研究提供理论基础。

