基于术后并发症及月经症状探讨宫腔镜下子宫内膜息肉切除术与宫腔镜下诊刮术在子宫内膜息肉患者中的效果对比
任利敏, 尹保娜, 沈萌萌
(1.沁阳市妇幼保健院a妇产科b妇科 河南 焦作 454550;2.焦作市妇幼保健院妇科 河南焦作 454000)
子宫内膜息肉是妇科常见疾病之一,约占妇科疾病25%,多发于育龄期和绝经期女性,发病率较高[1-2]。多数患者临床表现为子宫异常出血、月经量过多、白带异常、经期紊乱、阴道出血等现象,未及时治疗,易发生贫血、流产、甚至癌变等症状,危害患者生命安全[3-4]。以往多采用激素和铁剂治疗子宫内膜息肉,虽能改善患者临床症状,但长期服药易出现耐药性,治疗效果不理想[5-6]。因此,外科手术是临床治疗子宫内膜息肉主要方法。既往多以传统刮宫术治疗子宫内膜息肉,虽能刮除息肉,但因对子宫创伤较重,复发率较高,预后较差,前景受阻[7]。随着微创技术和腔镜技术不断发展,逐渐出现宫腔镜下诊刮术、宫腔镜下子宫内膜息肉切除术。基于此,本院收集121例子宫内膜息肉患者临床资料进行回顾性分析,基于术后并发症及月经症状探讨宫腔镜下子宫内膜息肉切除术与宫腔镜下诊刮术在子宫内膜息肉患者中的临床疗效。分析如下。
1 资料与方法
1.1 一般资料
收集2017年1月至2023年11月期间本院医治的121例子宫内膜息肉患者,根据不同手术方法分为诊刮组(n=59)、切除组(n=62)。
诊刮组:年龄20~65 岁,平均年龄(42.56±10.84)岁,息肉数量:47例单发、12例多发,病程1~7个月,平均病程(4.31±1.37)个月,息肉直径10~23mm,平均直径(16.72±2.96)mm,临床症状:51例月经不调、48例月经紊乱、37例白带异常、24例不孕,体质量指数(BMI)17.06~22.82kg/m2,平均BMI(19.84±1.25)kg/m2。
切除组:年龄21~66 岁,平均年龄(43.79±11.02)岁,息肉数量:49例单发、13例多发,病程1~8个月,平均病程(4.45±1.51)个月,息肉直径11~24mm,平均直径(17.48±3.04)mm,临床症状:56例月经不调、50例月经紊乱、43例白带异常、27例不孕,BMI17.12~23.11kg/m2,平均BMI(20.22±1.37)kg/m2。两组一般资料均衡可比(P>0.05)。
1.2 纳入与排除标准
纳入标准:①具有腹痛、白带异常、子宫不规则出血、不孕等临床症状;②经阴道超声、宫腔镜、病理学等检查确诊为子宫内膜息肉患者;③符合临床手术指征;④无腹部手术史;⑤符合《妇产科学》[8]中子宫内膜息肉诊断标准;⑥临床资料保存完整。排除标准:①存在手术禁忌;②年龄<20岁;③合并子宫肌瘤、子宫畸形、子宫异位妊娠等妇科疾病;④免疫功能、凝血功能、认知功能障碍者;⑤合并重要脏器功能障碍者;⑥麻醉不耐受。
1.3 方法
1.3.1 术前检查 患者术前均行阴道超声、血常规、白带、凝血功能、心电图、胸X 线、血人绒毛膜促性激素等检查;于患者经期后7d行手术治疗;术前7h,冲洗患者阴道,0.5h 后,阴道后穹窿处予以0.2m 米索前列醇片(规格:0.2mg,生产商:上海新华联制药有限公司/弘健制药(上海)有限公司,批准文号:国药准字H20094136)软化,以生理盐水膨宫,维持115mm Hg宫腔内压。
1.3.2 诊刮组 全麻,取膀胱截石位,铺放消毒巾,行宫腔镜下诊刮术。扩张宫颈管,置入宫腔镜,观察息肉大小、位置、形状及周围组织状况,明确病灶位置;采用适合型号刮匙刮出息肉,负压(8号吸管)吸除病灶,电凝止血;待完息肉全刮出后,退出内镜,生理盐水冲洗术区,术毕。
1.3.3 切除组 全麻,取膀胱截石位,铺放消毒巾,行宫腔镜下子宫内膜息肉切除术。扩张宫颈管,置入宫腔镜,观察息肉大小、位置、形状及周围组织状况,明确病灶位置;调整电切刀参电切凝(60W)、电切(80W)参数,于宫腔镜直视下环切息肉基底(2mm),依据患者病情可切除部分周围子宫内膜,负压(8号吸管)吸除病灶,电凝止血;术中避免对周围正常组织损伤,可进行少量多次切除病灶,直至完全切除息肉,退出内镜;随后以生理盐水冲洗术区,术毕。
1.3.4 术后措施 术后患者均予以抗菌、抗感染等对症治疗;术后3d口服甲羟孕酮片(生产商:北京京丰制药(山东)有限公司,规格:4mg,批准文号:国药准字H37021761)治疗月经症状,4mg/次,2 次/d,维持3周,随后改为经期第5d后口服甲羟孕酮片,4mg/次,2次/d,维持3个月;叮嘱患者术后2周内禁性生活、止盆浴等相关事项。
1.4 观察指标
1.4.1 手术指标 记录比较两组出血量、住院时间、手术时间。
1.4.2 月经症状 记录比较患者术前及术后2个月、3个月月经量、月经经期,其中月经量采用月经失血图(PBAC)评估,患者经期采用统一品牌卫生巾,使用完后自行放置塑料袋内,采用PBAC 评估、填表,总分值为0~20分,分数越高,月经量越多。
1.4.3 雌激素受体水平 收集患者术前及术后3个月子宫内膜病理切片,采用免疫组织化学染色法检测雌激素受体水平。
1.4.4 生化指标 术前及术后3个月,取患者静脉血4m L,3500r/min转速离心10min,取上层清液,采用酶联免疫法检测血管内皮生长因子(VEGF)、转化生长因子-β1(TGF-β1)水平;采用全自动血细胞分析仪检测血红蛋白(Hb)水平。
1.4.5 并发症 记录比较两组术后宫腔感染、宫腔粘连、出血、宫颈管狭窄等现象。
1.5 统计学方法
2 结果
2.1 两组手术指标对比
与诊刮组相比,切除组住院时间较短,出血量较少(P<0.05);两组手术时间相比,差异无统计学意义(P>0.05)。见表1。
表1 两组手术指标比较

表1 两组手术指标比较
组别例数 住院时间(d) 出血量(m L) 手术时间(min)切除组62 5.82±1.63 24.31±5.62 30.47±5.19诊刮组59 7.91±1.58 28.45±5.97 31.44±5.22 t值7.156 3.929 1.025 P 值0.000 0.000 0.308
2.2 两组月经症状比较
术后3个月,切除组月经经期、PBAC评分均低于诊刮组(P>0.05)。见表2。
表2 两组月经症状比较(±s)
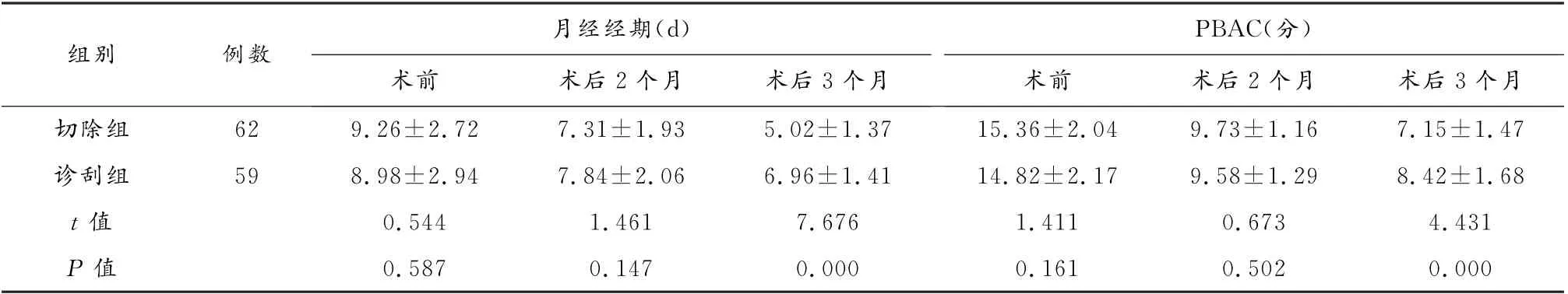
表2 两组月经症状比较(±s)
组别例数月经经期(d)术前术后2个月术后3个月PBAC(分)术前术后2个月术后3个月切除组62 9.26±2.72 7.31±1.93 5.02±1.37 15.36±2.04 9.73±1.16 7.15±1.47诊刮组59 8.98±2.94 7.84±2.06 6.96±1.41 14.82±2.17 9.58±1.29 8.42±1.68 t值0.544 1.461 7.676 1.411 0.673 4.431 P 值0.587 0.147 0.000 0.161 0.502 0.000
2.3 两组雌激素受体水平比较
术后3个月,两组雌激素受体水平显著下降(P<0.05);但组间相比,差异无统计学意义(P>0.05)。见表3。
表3 两组雌激素受体水平比较(±s,ng/m L)
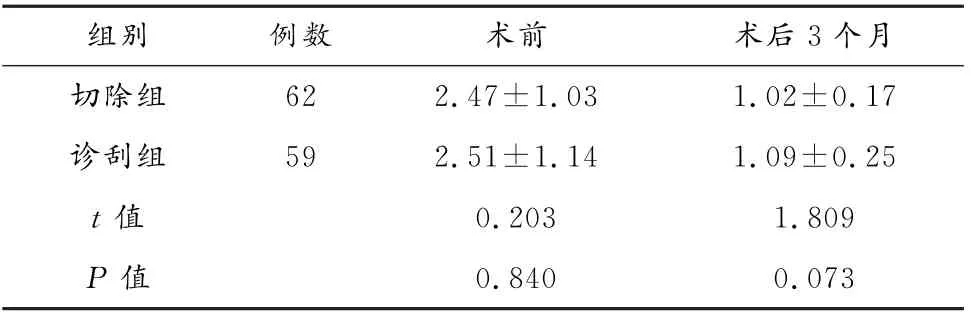
表3 两组雌激素受体水平比较(±s,ng/m L)
组别例数术前术后3个月切除组62 2.47±1.03 1.02±0.17诊刮组59 2.51±1.14 1.09±0.25 t值0.203 1.809 P 值0.840 0.073
2.4 两组生化指标比较
与诊刮组相比,切除组VEGF、TGF-β1水平较低,Hb水平较高(P<0.05)。见表4。
表4 两组生化指标比较(±s)
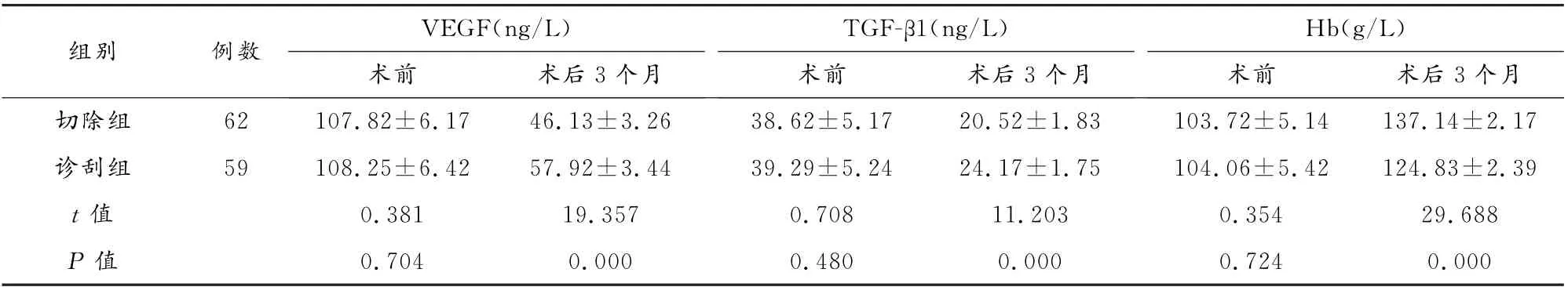
表4 两组生化指标比较(±s)
组别例数VEGF(ng/L)术前术后3个月TGF-β1(ng/L)术前术后3个月Hb(g/L)术前术后3个月切除组62 107.82±6.17 46.13±3.26 38.62±5.17 20.52±1.83 103.72±5.14 137.14±2.17诊刮组59 108.25±6.42 57.92±3.44 39.29±5.24 24.17±1.75 104.06±5.42 124.83±2.39 t值0.381 19.357 0.708 11.203 0.354 29.688 P 值0.704 0.000 0.480 0.000 0.724 0.000
2.5 两组术后并发症对比
切除组并发症发生率(1.61%)与诊刮组(8.47%)相比,差异无统计学意义(P>0.05)。见表5。

表5 两组并发症发生率比较n(%)
3 讨论
临床尚未清除子宫内膜息肉发病机制,认为和妇科炎症刺激、内分泌紊乱、雌激素水平过高等因素有关[9-10]。目前,宫腔镜下诊刮术和宫腔镜电切术是临床以治疗子宫内膜息肉主要术式,前者是在传统刮宫术技术联合宫腔镜刮除息肉,后者是在宫腔镜指引下,以环状电切刀切除息肉[11-12]。临床术式各有优势,为此,本院开展关于宫腔镜下诊刮术和宫腔镜电切术治疗子宫内膜息肉相关研究。
本研究显示,切除组住院时间、出血量均少于诊刮组(P<0.05)。提示,宫腔镜下子宫内膜息肉切除术能加快患者康复进程。息肉切除术于宫腔镜直视下环切息肉基底,减少对子宫内壁损伤,出血量较少,术后恢复较快,进而缩短住院时间。陈礼梅等[13]研究指出,子宫内膜血管病理增殖与子宫内膜息肉生长有关。郑贺等[14]研究指出VEGF 对血管内皮细胞具有高度特异性,可促进血管通透、基质细胞生长、血管新生。邱爽等[15]研究指出TGF-β1与疾病进程密切相关。本研究显示,切除组VEGF、TGF-β1水平、月经经期、PBAC 评分低于诊刮组,Hb水平高于诊刮组(P<0.05)。可见宫腔镜下子宫内膜息肉切除术能降低生化指标,改善患者月经症状。息肉切除术术中以宫腔镜和电切镜扩大手术视野,可精准切除病灶和两侧宫角内隐匿病灶,减少对子宫内壁和周围组织损伤,降低VEGF、TGF-β1水平,进而减少月经量和经期,提高Hb水平。诊刮术于宫腔镜指引下采用刮匙刮除息肉,手术视野受限,无法彻底清除宫角内隐匿病灶,TGF-β1、VEGF水平较高,导致月经量较多,经期较长。
宫腔感染、宫腔粘连、出血、宫颈管狭窄是子宫息肉切除术术后常见并发症,其中宫腔粘连是由于过度刮宫所造成并发症[16-17]。罗祥力等[18]研究发现,雌激素受体存在于子宫内膜心血管系统内,雌激素受体高表达可促进子宫内膜病理增殖,进而形成息肉生。本研究显示,两组雌激素受体水平和并发症发生率无显著差异。由此可见,两种手术方法均能降低雌激素受体水平,安全性较好。究其原因在于,宫腔息肉切除术在宫腔镜直视下环切病灶基底,对子宫及子宫内膜损伤较少,术后并发症较少;术中又采取少量多次切除方法环切病灶,可减少对子宫内壁损伤,极大程度上降低出血、感染等并发症发生几率。术后患者口服甲羟孕酮片并予以抗菌、抗感染等对症治疗,既能抑制雌激素受体水平,又能减少并发症发生。此外,还可能与本样本选取例数较少有关。术后,出现3例宫腔感染、1例宫腔粘连、1例出血、1例宫颈管狭窄,一经发现予以对症治疗后,患者均好转。
综上所述,宫腔镜下子宫内膜息肉切除术能改善月经症状,减少术后并发症,降低TGF-β1、VEGF、雌激素受体水平,预后效果较好。

